云南省部分地区规模猪场猪伪狂犬病流行病学调查
苏琳琳,朱 丽,钱祁昇,赵翔玥,吕念词,郑晓琳,张天羽,柴 俊,张以芳
(云南农业大学动物医学院动物健康检测与评价云中心,云南昆明 650201)
猪伪狂犬病(Pseudorabies,PR)是由伪狂犬病毒(Pseudorabies virus,PRV)引起猪的一种急性高死亡率传染病[1],传播速度快,致病性强,危害严重。PRV属于疱疹病毒科(Herpesviridae)α疱疹病毒亚科[2]。PR属于自然疫原性疾病,被我国列为二类动物疫病,被世界动物卫生组织(OIE)列为须通报动物疫病[3]。猪是该病的自然宿主[4],包括野猪[5-9]。PRV可以通过多种途径在猪群中传播,包括消化道、呼吸道、生殖道,也可以机械传播[10]。为了解云南省猪场中的PR流行情况,从而为预防和控制该病提供数据支持,在云南省部分大中小型猪场随机采样,对采集的血清进行 ELISA检测,对采集的可疑病料进行PCR检测。
1 材料与方法
1.1 材料
1.1.1样品 从昆明、曲靖、玉溪、楚雄、大理、宣威、西双版纳等9个地区的54个规模化猪场,随机采集6 555份全血和381份疑似病料(母猪52份、保育猪94 份、公猪精液20份、育肥猪103份、流产胎儿和仔猪112 份)。
1.1.2试验材料 猪伪狂犬病 gE-ELISA、gBELISA 诊断试剂盒(美国 IDEXX 公司);Mini BEST viral RNA/DNA extraction kit ver 5.0(Takara大连宝生物公司);2×Easy SuperMix(大连宝生物公司);胶回收试剂盒(全式金);ddH2O(大连宝生物公司)。
1.2 方法
1.2.1血清学检测 将采集的6 555份全血处理后,取其血清,根据猪伪狂犬病gE-ELISA诊断试剂盒使用说明进行抗体检测。在阴、阳性对照成立的前提下,如果待检样品的S/N值≤0.60,判定为PRV gB(gE)抗体阳性;如果待检样品S/N值>0.7,判定为PRV gB(gE)抗体阴性。
1.2.2病原学检测 将冻存的组织样品(主要是脾脏、淋巴结,少量为脑组织)取出,置室温解冻;在超净工作台中,用灭菌剪刀、镊子剪至米粒大小,然后转移至预先灭菌处理好的研钵中,加入液氮研磨;最后分装到2 mL灭菌离心管中,-70 ℃冻存待检。
1.2.3引物设计 根据GenBank中的PRV核苷酸序列,应用DNAStar软件设计1对引物(PRV-F、PRV-R)。引物由(华大基因)合成。引物信息见表1。

表1 PRV引物
1.2.4样品DNA提取 根据 Mini BEST viral RNA/DNA extraction kit ver 5.0 试剂盒使用说明进行样品DNA提取。
1.2.5PCR扩增 取1 μL所提DNA作为模板,加入12.5 μL 2X Easy Taq SuperMix、9.5 μL dd H2O、1 μL PRV-F、1 μL PRV-R。反应体系为:预变性94 ℃ 5 min;变性94 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 45 s,34个循环;终延伸72 ℃ 5 min。
1.2.6PCR产物纯化测序 对PCR 产物经琼脂糖凝胶电泳后,根据试剂盒说明书做胶回收目的条带,然后克隆转化;将回收产物将送至华大基因进行测序鉴定。
2 结果
2.1 血清学检测
2.1.1不同年份 2016—2017年在云南省不同地区采集的6 555份血清样品中,PRV gB抗体阳性率为88.7%,gE抗体阳性率(野毒感染率)为13.5%(表2)。
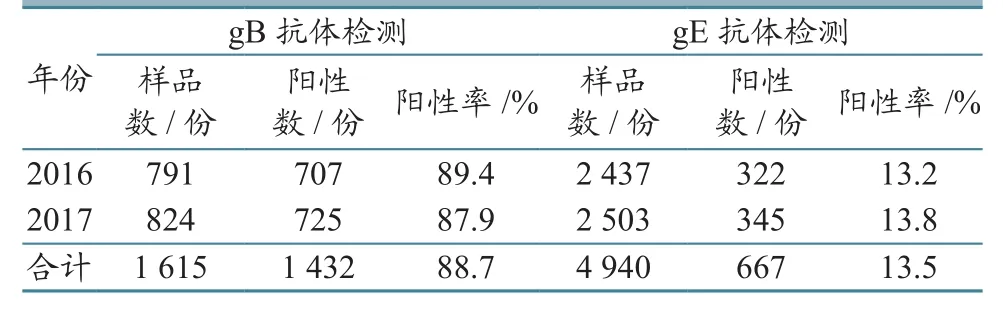
表 2 不同年份PRV抗体检测结果
2.1.2不同地区 检测结果显示:楚雄市的gB抗体阳性率最低,为78.5%,但gE抗体阳性率(野毒感染率)最高,为21.8%;大理市gB抗体阳性率最高,为95.1%,但野毒感染率最低,为6.0%(表3)。

表3 不同地区PRV抗体检测结果
2.1.3不同季度 检测结果显示,第2季度的野毒感染率最高,为20.3%,第1季度最低,为8.7%。不同季度的PRV抗体检测结果见表4。

表 4 不同季度PRV抗体检测结果
2.2 病原学检测
2.2.1不同年份 对不同年份送检的疑似PR病料进行 PCR 检测,发现2016、2017年的病原检出率分别为 22.1%、23.7%,表明云南省的PRV野毒感染较严重(表5)。对送检病料的PCR检测鉴定结果见图1。

表5 不同年份送检病料PCR检测结果

图1 部分病料的PCR扩增结果
2.2.2不同地区 对2016—2017年云南省不同地区送检的疑似病料进行PCR 检测,发现玉溪市病原检出率最高(52.6%),德宏市最低(16.4%)。具体检测结果见表6。

表6 不同地区送检病料PCR检测结果
2.2.3不同季度 对不同季度送检的疑似PRV 感染病料进行 PCR 检测,发现各季度的病原检出率较为均衡,在20%~30%之间。具体结果见表7。
2.2.4不同猪群 对云南省不同地区送检的不同生产阶段猪群病料进行 PCR检测。检测结果显示,母猪的病原检出率最高(28.8%),而育肥猪最低(20.4%)。具体结果见表8。
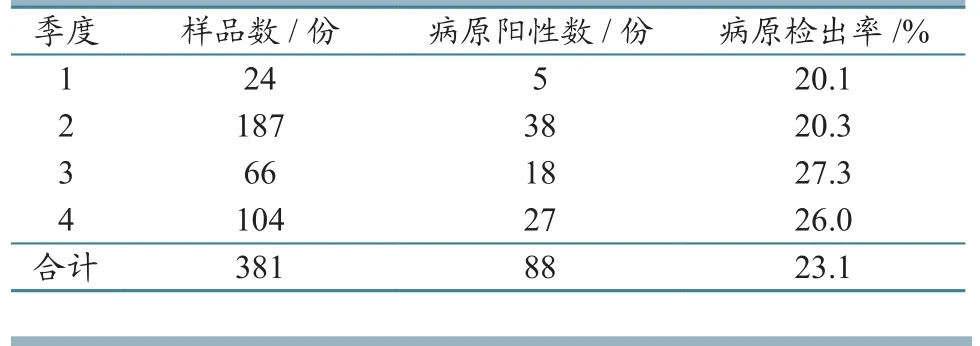
表7 不同季度送检病料PCR检测结果
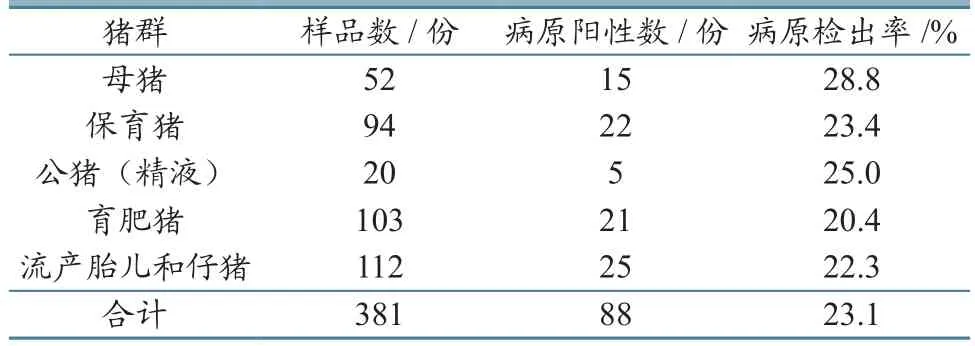
表8 不同生产阶段猪群病料 PCR 检测结果
3 分析与讨论
目前,我国应用 PRV gE基因缺失活疫苗来控制该病。因此,猪血清中检出gE抗体可确诊为野毒感染[11]。本次调查发现,2016、2017年的PRV gE抗体阳性率分别为13.2%、13.8%,疑似样品的病原检出率分别为22.1%、23.7%。该结果与杨珊珊[12]等报道的2016年江苏省部分地区PR样本阳性率(43.2%),以及毕俊龙[13]等报道的2009—2013 年云南省楚雄地区规模场PR样本阳性率(37.67%)相比偏低,而接近于邹敏等[14]报道的2012—2013 年全国18 个省份393 个猪场检出PRV gE抗体总体阳性率(16.13%)。这表明云南省内的PR流行仍然严重,因而要提高对PR防控的重视,认真做好预防控制工作,将可能产生的损失降低到最小。
从不同地区的检测结果来看,玉溪、宣威和西双版纳的PRV野毒感染率较高,表明这3个地区的PR发生风险较大。从不同季度样品检测结果来看,4个季度的野毒感染率较为接近,说明PR一年四季均可发生,没有明显的季节性,只是在初春和冬季较为多发。从不同猪群检测结果来看,母猪野毒感染率较高,说明在云南省存在较为严重的PR野毒感染。这可能与疫苗质量、免疫程序、接种方法和养殖户对免疫的错误认识有关。保育猪野毒阳性率高可能与母源抗体的干扰有关,也可能与母猪垂直传播有关;仔猪由于免疫系统还没有发育成熟,对PRV的抵抗力较弱。因此,母猪和仔猪的PR免疫与预防工作都应该得到重视。
4 结论
本次调查发现,云南省9个地区规模猪场的PR免疫抗体阳性率为88.7%,表明总体免疫效果较好;gE抗体阳性率为13.5%,表明云南省仍有一定程度的PR流行;gB抗体阳性率偏高的地区,gE抗体阳性率较低,说明免疫有助于预防PR野毒感染;第2季度野毒感染率最高,说明PR多发于低温季节;玉溪、宣威和西双版纳等地区,以及母猪、保育猪、仔猪和公猪精液的PR病原检出率较高,表明对于这些地区、此类猪群,应重点加强防控。
参考文献:
[1] 马沛,王和平. 猪伪狂犬病的流行情况及净化对策[J].湖南畜牧兽医,2013(4):23-25.
[2] SKODA R. Detection of neutralizing antibodies against the Aujeszky disease virus in swine in Southern Germany[J]. Berl munch tierarztl wochenschr,1971,84(21):411-414.
[3] 杨毅. 猪伪狂犬病疫苗的研究进展[J]. 江西农业学报,2010(3):154-157.
[4] 邓仕伟,薛春芳,汪勇. 我国规模化猪场对猪伪狂犬病的控制[J]. 中国畜牧兽医,2007(2):112-115.
[5] LOUKACHOV I I,NIKITINE N G. Aujeszky disease in U.S.S.R[J]. Bulletin-of fi ce international des epizooties,1968,69(11):2151.
[6] VESELINOVA A,MOTOVSKI A. Several features of Aujeszky disease virus[J]. Veterinarno-meditsinski nauki,1976,13(7):9-15.
[7] MÜLLER T,KLUPP B G,FREULING C,et al.Characterization of pseudorabies virus of wild boar origin from Europe[J]. Epidemiology and infection,2010,138(11):1590-600.
[8] MÜLLER T,KLUPP B G,FREULING C,et al.Pseudorabies virus in wild swine:a global perspective[J].Archives virology,2011,156(10:1691-705.
[9] MAHMOUD H Y,SUZUKI K,TSUJI T,et al.Pseudorabies virus infection in wild boars in Japan[J].Journal of veterinary medical science,2011,73(11):1535-1537.
[10] CORN J L,STALLKNECHT D E,MECHLIN N M,et al. Persistence of pseudorabies virus in feral swine populations[J]. Journal of wildlife diseases,2004,40(2):307-310.
[11] TONG W,LI G,LIANG C,et al. A live,attenuated pseudorabies virus strain JS-2012 deleted for g E/g I protects against both classical and emerging strains[J].Antiviral research,2016,130:110-117.
[12] 杨珊珊,徐璇,孙涛,等. 2016年江苏省部分猪场猪伪狂犬病血清流行病学调查[J]. 中国动物检疫,2017,34(8):17-19.
[13] 毕峻龙,杨培昌,肖俊,等. 2009—2013 年云南省楚雄地区猪伪狂犬血清流行病学调查和防控措施研究[J]. 动物医学进展,2015,36(4):117-120.
[14] 邹敏,杨旭兵,郑辉,等. 2012—2013年我国部分地区猪伪狂犬病流行病学调查[J]. 中国动物检疫,2015,32(4):1-5.