河北省部分猪场送检样品的猪蓝耳病抗体水平分析
王丽娟,罗尚星,崔荣飞,左玉柱
(1. 河北农业大学动物医学院,河北保定 071001;2. 河北省动物卫生监督所,河北石家庄 050081;3. 石家庄市畜产品质量监测中心,河北石家庄 050000)
猪蓝耳病(PRRS)是由套式病毒目的猪蓝耳病毒(PRRSV)引起的猪繁殖障碍、高热,出现呼吸道症状的一种传染病。本病于20世纪80年代末首先在美国被发现[1],后迅速蔓延至其他国家,20世纪90年代传入我国。本病具有高致死性,不仅会使仔猪成活率降低,还会导致育肥猪生长停滞[2],对养猪业危害较大。目前PRRSV两个基因型:一个是欧洲型,通常引起经典型PRRS;另一个是美洲型,引起变异型PRRS,危害往往更严重,会引发猪的急性死亡[3]。由于PRRSV基因组有10个开放阅读框,且ORF1、ORF3、ORF5极易变异[4],使得PRRS防治变得非常困难。
目前疫苗免疫仍是PRRS防控的重要措施之一,因此对猪群PRRS抗体水平的检测十分重要。它既可以评价免疫效果,也可以了解猪群健康状况,以便猪场及时调整免疫程序,从而减少经济损失。
本研究通过对河北省内不同规模猪场送检的血样进行PRRS抗体检测,对检测数据进行汇总分析,寻求PRRS的流行规律,为PRRS防控提供一些数据支持。
1 材料与方法
1.1 临床样品
2016—2017年来自河北省保定、石家庄、沧州、张家口、邯郸、衡水、邢台等7个地区送检的,对种群分类较为明确的猪场血样共计1 182份,其中散养户11家196份,中型猪场5家380份,大型猪场2家606份(表1)。每只猪采血2~3 mL,室温静置至血清析出,分离血清,置于4 ℃保存。

表1 不同规模猪场基本情况
1.2 主要试剂
猪繁殖与呼吸综合征病毒抗体检测试剂盒(美国IDEXX):购自北京爱德士元亨生物科技有限公司;Multiskan FC型酶标仪:购自Thermo公司。
1.3 试验方法
试验前将抗体试剂盒与血样室温孵育1 h,用血清稀释板将血样进行40倍稀释(5 μL血清+195 μL样品稀释液);将稀释好的样品转至抗原包被板中,每孔100 μL,分别加入2孔阴性对照与2孔阳性对照,每孔100 μL,阴阳性对照不稀释;室温下孵育30 min,弃去孔中液体,用配好的洗液洗涤板孔(洗液用蒸馏水10倍稀释),每孔250 μL,洗涤3~4次,最后一遍用力拍干;每孔加入100 μL酶标抗体,室温下孵育30 min,弃去孔中液体后洗涤,重复操作;每孔加入100 μL TMB底物液,在室温下孵育15 min,最后加入终止液,每孔100 μL,于酶标仪中650 nm条件下测量吸光值。
1.4 结果判定与计算
当阴性对照平均值<0.15,阳性对照平均值-阴性对照平均值>0.15时,试验结果有效。本试验通过S/P对结果进行判定。S/P=(样品OD值-阴性对照平均值)/(阳性对照平均值-阴性对照平均值)。当S/P<0.4时,判定为阴性;当S/P>0.4时,判定为阳性;当S/P>2.5时,如果样品数据离散度较高,则可能存在感染并发病,如果度较低,则可能存在感染但处于稳定期。
离散度计算公式:
离散度=D(样品方差)/样品平均值
2 结果与分析
2.1 不同规模猪场
对送检血样按规模猪场分类后,进行检测结果分析。结果显示,大型场阳性率最高,散户阳性率最低(表2)。这可能与大型猪场有较为系统或者固定的免疫程序有关。

表2 不同规模猪场检测结果统计
2.2 不同生产猪群
2.2.1散户 对11家散户的不同种群进行分析发现,不同生产猪群阳性率均在80%左右,但21~60日龄仔猪与公猪的阳性率偏低;散户不同猪群的离散度大部分低于60%,但21~60日龄仔猪、哺乳母猪、公猪的离散度高于60%(图1)。

图1 散户不同种群PRRS抗体水平分析
2.2.2中型场 对5家中型场不同猪群检测数据分析发现,不同猪群阳性率基本在80%以上,离散度在60%以下,其中100~150日龄育肥猪与空怀母猪的阳性率高于其他阶段猪群,21~60日龄仔猪、公猪的阳性率偏低(图2)。

图2 中型场不同种群PRRS抗体水平分析
2.2.3大型场 对2家大型场的不同种群的检测结果分析发现,不同种群的抗体阳性率基本在90%以上,但21~60日龄仔猪相对偏低,离散度大部分在40%左右,仅哺乳母猪与空怀母猪离散度稍高(图3)。

图3 大型场不同种群PRRS抗体水平分析
2.3 不同地区
对来自保定、石家庄、沧州等7个地区送检的血样,按照地区进行分类统计发现,各地区的抗体阳性率在80%左右,地域差异不大,其中大于2.5抗体值的猪场基本在15%左右,说明PRRS在河北省普遍存在(表3)。
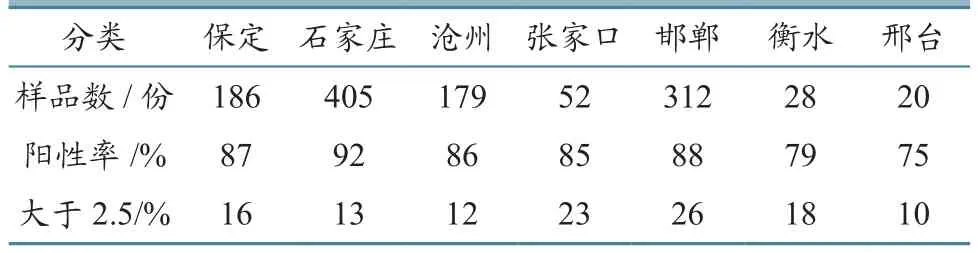
表3 不同地区PRRS抗体检测结果分析
3 讨论
PRRS是猪场危害较重的传染病之一,多发于夏秋季节[8]。由于其具有传播途径广、病死率高、致病力强、仔猪与育肥猪极其易感的特点[9-10],使得PRRS的预防与控制一直是我国养猪业以及动物疫病研究的热点。在美洲型PRRSV流行以前,该病通过免疫接种就可取得较好的防控效果,但在2008年以后,由于PRRSV变异株的流行,使得该病防控出现了病毒不断变异;毒力持续增强[11]的新问题,使得原本较为稳定的猪场大规模发病。鉴于以上问题的出现,对猪群免疫情况、猪群健康情况、猪群感染情况的监测显得尤为重要。对猪群做好抗体水平检测已经成为现阶段猪场科学养殖的重要手段。
本研究对2016—2017年河北省送检的1 182份血样进行了PRRS抗体检测。对检测结果进行统计分析发现:大型场阳性率(93%)高于中型场(87%)和散户(80%),抗体整齐度也较好。其原因可能与大型场免疫程序较为规范,饲养水平较为科学有关。21~60日龄断奶仔猪抗体阳性率偏低,说明此阶段猪群易感染PRRSV,此外母猪的抗体整齐度也较差,需要加强对这些猪群的监管和免疫。7个地区的抗体阳性率基本在80%左右,地域差异不大,说明送检样品猪场的PRRS免疫情况相似。因此,在PRRS防控中,应对抗体水平进行定期检测,根据整个猪群的健康状况、免疫情况及感染情况,合理制定疫苗免疫程序。这样才能降低PRRS发病率,减少经济损失。
此外由于目前的抗体检测并不能区分野毒抗体和疫苗抗体,需要根据样本数据的离散度和阳性率并结合猪场实际情况进行推测,所以分析结果具有一定的主观性,只能作为参考。
4 结论
本研究对2016—2017年河北省保定、石家庄、沧州等7个地区送检的1 182份血样进行了PRRS抗体检测,发现整体免疫效果较好,平均阳性率均在80%以上,尤其是大型规模化猪场,免疫效果更好。地区差异不大,各地阳性率在75%~92%之间。散养和断奶仔猪群的阳性率相对偏低,是发生PRRS的威险猪群,应对其加强防控;母猪与育肥猪的整齐度较差,可能与其本身易感染PRRSV有关。PRRS的免疫程序需要根据抗体检测情况进行合理制定,只有这样,才能取得好的免疫效果。
参考文献:
[1] 张青娴,王克领,张立宪,等. 高致病性蓝耳病的研究进展[J]. 中国畜牧兽医,2008,35(9):105-107.
[2] EMANUELA P,ENRIC M,王学强. 猪繁殖与呼吸综合征病毒(PRRSV)传播的研究进展及其对免疫程序的影响[J]. 中国猪业,2017(4).
[3] 陈泽芳,赵爱莉. 猪蓝耳病的研究进展[J]. 畜禽业,2017,28(3):1-3.
[4] 杨晓花,张其艳,艾军,等. 高致病性蓝耳病的研究进展[J]. 今日畜牧兽医,2010(7):24-26.
[5] 黄哲新. 一例规模猪场蓝耳病抗体监测分析[J]. 南方农业,2016,10(15):168-169.
[6] 于桂芳,王国良,温富勇. 高致病性猪蓝耳病免疫抗体监测分析报告[J]. 当代畜牧,2011(4):14-15.
[7] 权玉先,张洪智. 猪蓝耳病的综合防控措施[J]. 中国畜牧兽医文摘,2017,33(4):134-134.
[8] 吾际舟. 高致病性猪蓝耳病的研究进展[J]. 中国猪业,2007(8):4-6.
[9] 李建玲,杨小亮. 高致病性猪蓝耳病的研究进展[J].中国兽医杂志,2014,50(6):61-63.
[10] 吴增坚. 高致病性猪蓝耳病[J]. 北方牧业,2007(15):7.
[11] 刘金彪. 猪蓝耳病的综合防控[J]. 中国动物检疫,2008,25(1):33-34.