5-羟甲基胞嘧啶表达与黑素瘤侵袭、转移、预后的相关性分析
王莹 康晓静 赵娟 梁俊琴 张德志 柴莉 王鹏 王唯嘉
830001乌鲁木齐,新疆维吾尔自治区人民医院皮肤性病科
研究表明,启动子甲基化可通过灭活肿瘤抑制基因导致恶性肿瘤发生,而甲基化转移酶可通过沉默肿瘤抑制基因使胞嘧啶发生甲基化而致病。5-羟甲基胞嘧啶(5⁃hmc)是5甲基胞嘧啶(5⁃mc)发生异常甲基化形成的一种重要的表观遗传学标记,参与多种生理及病理过程[1]。我们通过免疫组化技术检测5⁃hmc在黑素瘤中的表达,探讨5⁃hmc表达与黑素瘤临床病理参数的关系,分析其临床意义。
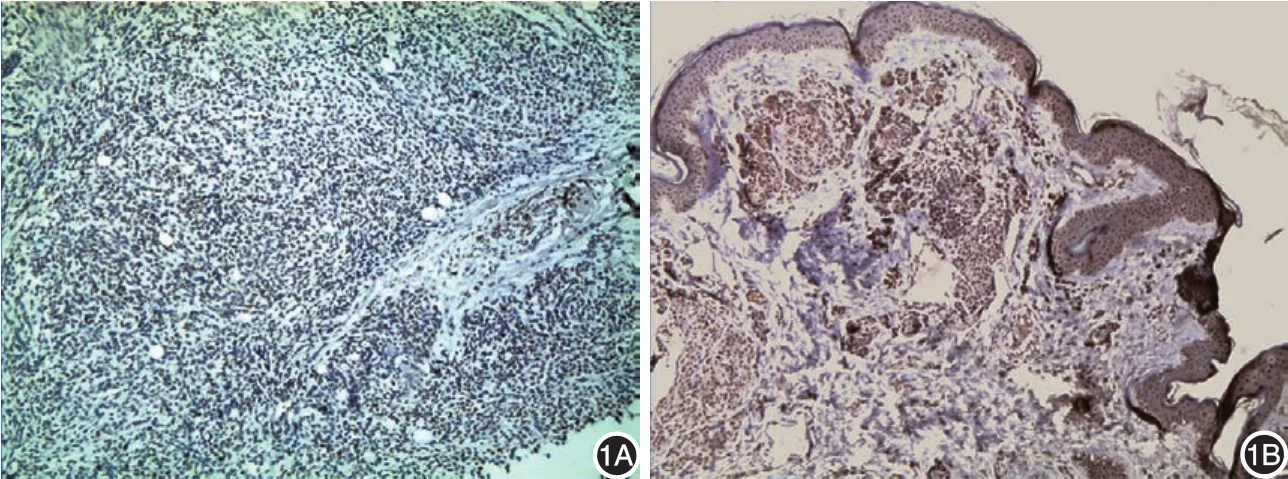
图1 免疫组化检测5-羟甲基胞嘧啶(5⁃hmc)表达(×100) 1A:黑素瘤组织表达5⁃hmc;1B:色素痣组织高表达5⁃hmc
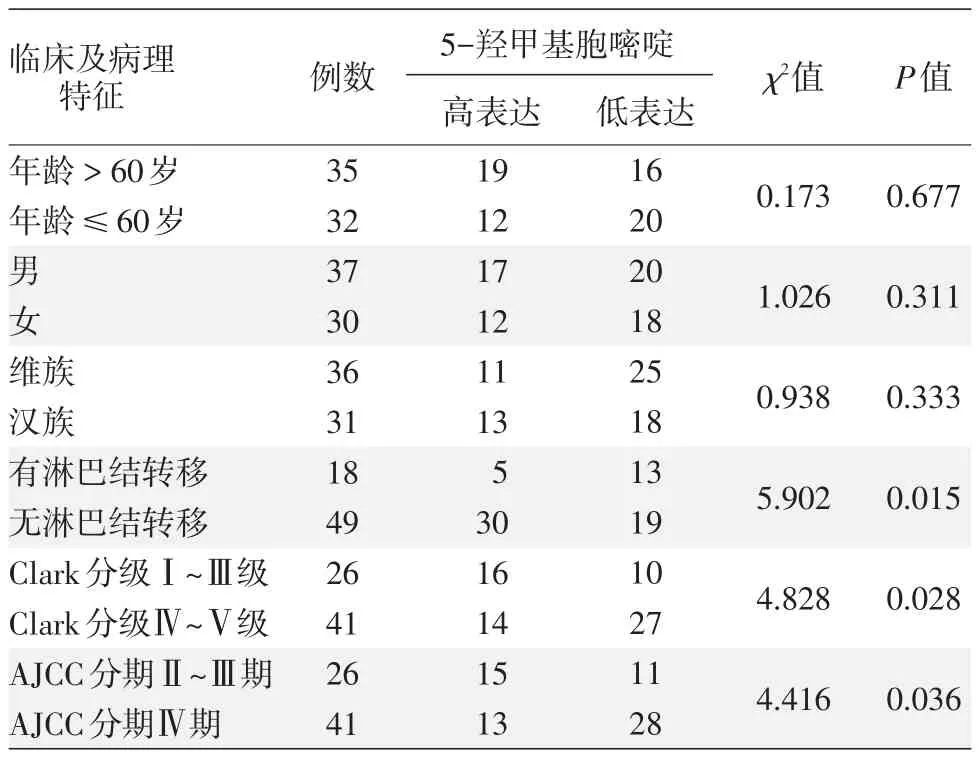
表1 黑素瘤中5-羟甲基胞嘧啶表达与临床病理特征的相关性
一、材料及方法
1.标本来源及临床病理特征:选取新疆维吾尔自治区人民医院病理科及皮肤科2004年1月至2015年12月病理确诊为黑素瘤的石蜡包埋组织67份及色素痣石蜡包埋组织20份。67例黑素瘤患者均无家族史,发病年龄28~95(62.01±13.28)岁,其中20~40岁5例,41~50岁11例,51~60岁15例,61~70岁16例,71~95岁20例。维吾尔族36例(53.73%),汉族31例(46.27%)。男性37例(55.22%),女性30例(44.78%)。病程1个月至22年,中位病程31个月。18例(26.87%)发生淋巴结转移,49例(73.13%)无淋巴结转移。参照美国癌症联合会(AJCC)临床分期基于病理对原发病灶的评估,将初诊患者分为以下3期:Ⅱ期20例(29.85%),无区域及远处淋巴结转移;Ⅲ期6例(8.96%),有区域淋巴结转移;Ⅳ期41例(61.20%),有远处淋巴结转移。Clark分级Ⅰ~Ⅲ级26例(38.81%),Ⅳ、Ⅴ级41例(61.19%)。67例患者中45例接受手术治疗(包括局部肿瘤切除、截指/趾及扩大切除),22例因年龄等因素未接受手术治疗。
2.主要试剂:一抗为兔抗人多克隆5⁃hmc特异性抗体,来自美国Active Motif公司,浓度为1∶500。鼠抗兔通用型二抗、二氨基联苯胺(DAB)显色剂均为北京中杉金桥生物技术有限公司产品。
3.免疫组化SP法检测5⁃hmc的表达:将4%甲醛固定、石蜡包埋的黑素瘤或痣组织切片,常规烤片、脱蜡、水化;浸入0.01 mmol/L pH6.0的枸橼酸盐缓冲液内,热抗原修复3 min;3%H2O2室温孵育30 min;DAB显色1 min左右;自来水冲洗,苏木精复染,通透、脱水,中性树胶封片,显微镜下观察。磷酸盐缓冲液代替一抗作为空白对照。
4.结果判断:5⁃hmc阳性染色为棕黄色颗粒,主要定位于细胞核。观察全片,借助高分辨显微镜随机选取不重叠的5个100倍视野,得出阳性细胞所占百分比。采用半定量积分法,对每张切片的阳性细胞率及阳性细胞着色强度进行分级计分。染色强度分为3级:无着色0分,浅着色1分,棕黄色2分;按阳性细胞的百分比分为4级:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。每张切片最后的得分即5⁃hmc表达水平为染色强度和阳性细胞百分比分级的乘积,≥3分是高表达,<3分是低表达。
5.随访:对入选本研究的67例黑素瘤患者进行电话随访,生存期的计算自患者接受手术之日起至死亡或2016年12月31日末次随访日,至末次随访日仍存活者生存时间定为删失值。
6.统计学方法:采用SPSS18.0统计软件。采用卡方检验比较5⁃hmc在黑素瘤和色素痣组织中的表达率,并分析黑素瘤患者5⁃hmc表达水平与患者临床病理特征的关系;计算不同组的生存率,应用Kaplan⁃Meier法绘制累计生存率曲线;利用Cox比例风险回归模型进行单因素和多因素回归分析。P<0.05认为差异有统计学意义。
二、结果
1.5⁃hmc在黑素瘤及色素痣中的表达:见图1。67例黑素瘤中,27例表达5⁃hmc,表达率为40.30%;42例(62.69%)为低表达,25例(37.31%)为高表达。20例色素痣组织中,15例表达5⁃hmc,表达率为75%。5⁃hmc在黑素瘤组中的表达率明显低于色素痣组,差异有统计学意义(χ2=7.428,P=0.006)。
2.黑素瘤中5⁃hmc表达与临床病理特征的关系:临床分期较晚期黑素瘤组织中5⁃hmc表达水平明显低于早期黑素瘤组织(χ2=4.416,P=0.036)。淋巴结转移患者表达水平明显低于无淋巴结转移患者(χ2=5.902,P=0.015),且5⁃hmc表达水平随黑素瘤组织Clark分级升高及浸润深度加深而降低(χ2=4.828,P=0.028)。5⁃hmc表达水平在不同年龄、性别、民族黑素瘤患者之间分布差异均无统计学意义(P>0.05)。见表1。
3.黑素瘤患者生存情况:67例患者均获得完整随访记录,随访时间[M(P25~P75)]为36(12~47)个月,随访期间死亡 14例,存活时间[M(P25~P75)]为32(11~ 38)个月。采用寿命表法计算1年、3年、5年生存率分别为79%、47%、32%,标准误分别为0.008、0.010、0.011。发生淋巴结转移、未行手术切除、5⁃hmc低水平表达、Clark分级较高、临床分期较晚患者生存期明显缩短。见图2。
4.COX回归分析结果:单因素回归分析显示,淋巴结转移、Clark分级、临床分期、5⁃hmc表达水平与黑素瘤预后相关,年龄、性别、民族与预后无关,见表2。将单因素分析中与预后不良有关指标纳入模型进行多因素Cox回归模型分析,结果显示,远处淋巴结转移(P=0.01)、未手术切除(P=0.04)、5⁃hmc低水平表达(P=0.03)、Clark分级(P=0.03)、AJCC分期(P<0.01)为预后不良的独立影响因素,见表2。
三、讨论
5⁃hmc是5⁃mc经DNA羟化酶家族成员TET(ten⁃eleven translocation)催化发生去甲基化生成。5⁃hmc作为DNA去甲基化的重要中间产物,仅存在于哺乳动物中[2⁃3],在一系列恶性肿瘤中存在缺失表达[4⁃5],提示5⁃hmc缺失是细胞分化和肿瘤进展过程中重要的表观遗传学事件之一。对黑素瘤及其他恶性肿瘤研究发现,TET家族酶表达减少可导致5⁃hmc缺失表达[5⁃6]。Lian等[7]运用DNA羟甲基化免疫共沉淀⁃芯片检测技术检测全基因组DNA羟甲基化状态,发现在黑素瘤患者全基因组中,无论启动子、外显子、内含子还是基因间结构均存在5⁃hmc低表达。
研究显示,黑素瘤患者存在大量基因位点的低甲基化以及特定基因和抑癌基因的高甲基化[8⁃9],多基因位点的DNA异常甲基化可能作为黑素瘤与色素痣的诊断鉴别要点[9⁃10]。但目前仍未发现特征性的表观遗传修饰可作为分子学标记应用于黑素瘤恶性程度的诊断与评价。有学者通过建立动物模型,发现提高5⁃hmc表达可抑制黑素瘤生长并提高无瘤生存率,同时5⁃hmc在黑素瘤及色素痣中存在差异表达,提示5⁃hmc对黑素瘤可能具有一定诊断价值[7⁃8]。近来研究也证实,5⁃hmc对于黑素瘤诊断具有一定意义[11⁃13]。
我们采用免疫组化技术检测5⁃hmc在黑素瘤中的表达,结果显示,黑素瘤5⁃hmc表达阳性率为40.30%,明显低于色素痣(75%)。而且随着肿瘤浸润程度加深及临床进展,5⁃hmc表达水平逐渐下降。5⁃hmc总体表达水平与淋巴结转移、Clark分级、AJCC分期、总体生存率有明显的相关性。本文结论与Lian等[7]和Uchiyama等[10]研究结果一致。
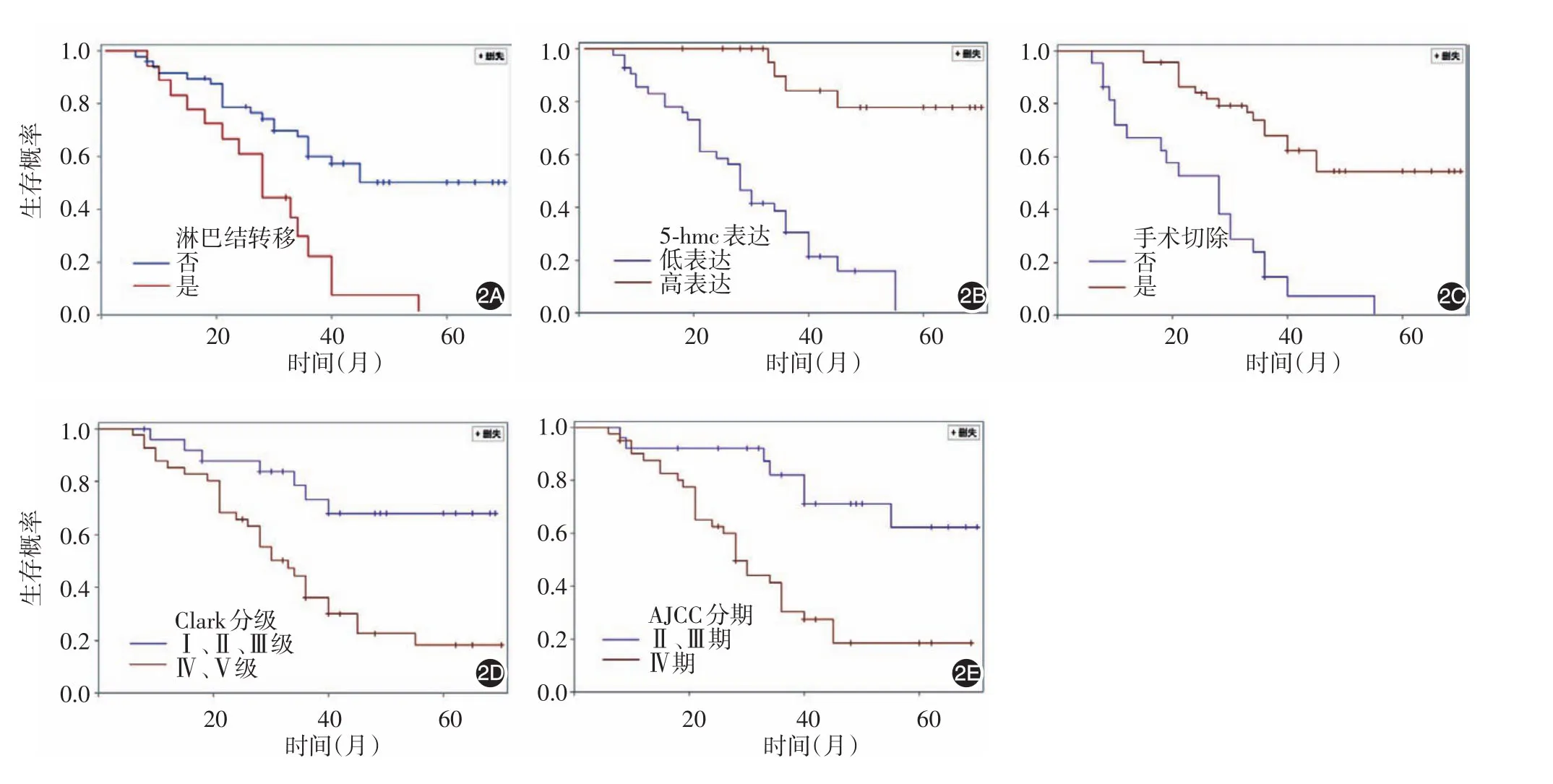
图2 黑素瘤独立预后因素相关生存曲线 2A:淋巴结转移相关生存曲线;2B:5-羟甲基胞嘧啶(5⁃hmc)表达相关生存曲线;2C:手术切除相关生存曲线;2D:Clark分级相关生存曲线;2E:AJCC分期相关生存曲线
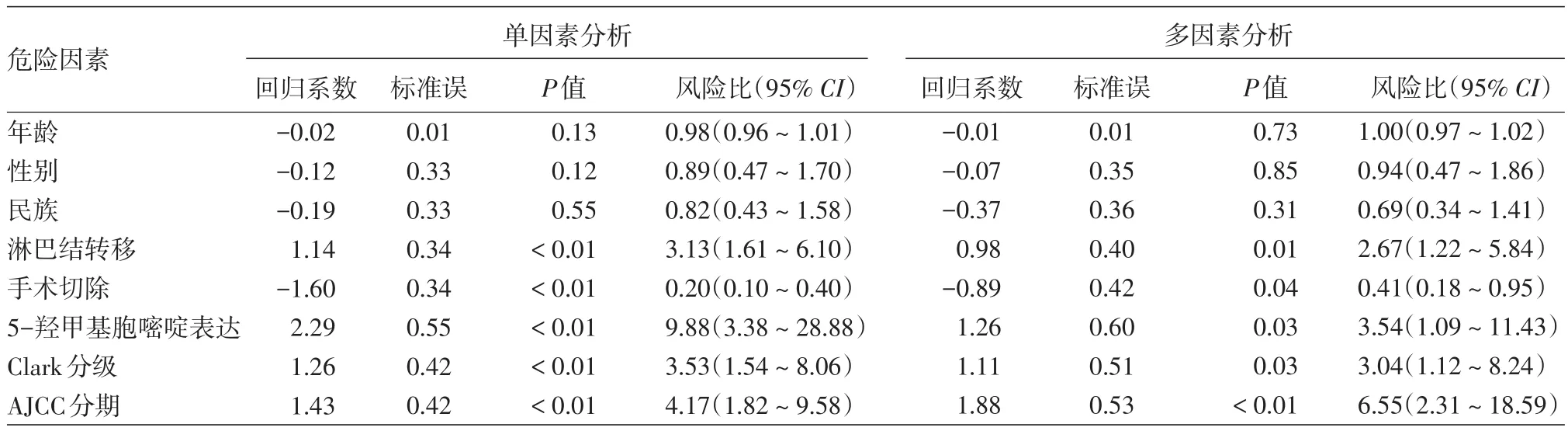
表2 影响黑素瘤生存时间的单因素及多因素分析结果
我们运用单因素Cox回归模型分析显示,淋巴结转移、Clark分级、AJCC分期、5⁃hmc表达水平与黑素瘤预后相关,多因素分析显示患者存在远处淋巴结转移、未手术切除、5⁃hmc低水平表达、Clark分级、AJCC分期与黑素瘤预后有关,与本课题组前期分析结果一致[14⁃15]。本研究中,临床分期较早并行手术切除的患者预后相对较好,而早期发生淋巴结及远处转移的患者临床分期较晚,不宜行手术切除,辅以放化疗及免疫靶向治疗,预后相对不佳,提示临床对黑素瘤早期诊断及行预后评估对延长患者生存率有一定意义。5⁃hmc在黑素瘤不同临床分期中表达水平有明显差异,在有淋巴结转移、临床分期较晚、未行手术切除的患者中表达水平降低,临床分期越晚,其水平越低,提示5⁃hmc可能作为临床黑素瘤早期诊断及预后评估的一个新的潜在表观遗传学标记物。
[1]Xu Y,Wu F,Tan L,et al.Genome⁃wide regulation of 5hmC,5mC,and gene expression by Tet1 hydroxylase in mouse embryonic stem cells[J].Mol Cell,2011,42(4):451 ⁃464.doi:10.1016/j.molcel.2011.04.005.
[2]Kriaucionis S,Heintz N.The nuclear DNA base 5⁃hydroxymethyl⁃cytosine is present in Purkinje neurons and the brain[J].Science,2009,324(5929):929⁃930.doi:10.1126/science.1169786.
[3]Tahiliani M,Koh KP,Shen Y,et al.Conversion of 5⁃methylcyto⁃sine to 5⁃hydroxymethylcytosine in mammalian DNA by MLL partner TET1[J].Science,2009,324(5929):930 ⁃935.doi:10.1126/science.1170116.
[4]Haffner MC,Chaux A,Meeker AK,et al.Global 5⁃hydroxymethyl⁃cytosine content is significantly reduced in tissue stem/progenitor cell compartments and in human cancers[J].Oncotarget,2011,2(8):627⁃637.doi:10.18632/oncotarget.316.
[5]Yang H,Liu Y,Bai F,et al.Tumor development is associated with decrease of TET gene expression and 5⁃methylcytosine hydroxy⁃lation[J].Oncogene,2013,32(5):663 ⁃669.doi:10.1038/onc.2012.67.
[6]Gambichler T,Sand M,Skrygan M.Loss of 5 ⁃hydroxymethyl⁃cytosine and ten⁃eleven translocation 2 protein expression in malignant melanoma[J].Melanoma Res,2013,23(3):218 ⁃220.doi:10.1097/CMR.0b013e32835f9bd4.
[7]Lian CG,Xu Y,Ceol C,et al.Loss of 5⁃hydroxymethylcytosine is an epigenetic hallmark of melanoma[J].Cell,2012,150(6):1135⁃1146.doi:10.1016/j.cell.2012.07.033.
[8]Kudo Y,Tateishi K,Yamamoto K,et al.Loss of 5⁃hydroxymethyl⁃cytosine is accompanied with malignant cellular transformation[J].Cancer Sci,2012,103(4):670 ⁃676.doi:10.1111/j.1349 ⁃7006.2012.02213.x.
[9]Ko M,Huang Y,Jankowska AM,et al.Impaired hydroxylation of 5⁃methylcytosine in myeloid cancers with mutant TET2[J].Nature,2010,468(7325):839⁃843.doi:10.1038/nature09586.
[10]Uchiyama R,Uhara H,Uchiyama A,et al.5 ⁃Hydroxymethyl⁃cytosine as a useful marker to differentiate between malignant melanomas and benign melanocytic nevi[J].J Dermatol Sci,2014,73(2):161⁃163.doi:10.1016/j.jdermsci.2013.09.008.
[11]Larson AR,Dresser KA,Zhan Q,et al.Loss of 5⁃hydroxymethyl⁃cytosine correlates with increasing morphologic dysplasia in melanocytic tumors[J].Mod Pathol,2014,27(7):936 ⁃944.doi:10.1038/modpathol.2013.224.
[12]Lee JJ,Granter SR,Laga AC,et al.5⁃Hydroxymethylcytosine expression in metastatic melanoma versus nodal nevus in sentinel lymph node biopsies[J].Mod Pathol,2015,28(2):218⁃229.doi:10.1038/modpathol.2014.99.
[13]Rodic N,Zampella J,Sharma R,et al.Diagnostic utility of 5⁃hydroxymethylcytosineimmunohistochemistryinmelanocytic proliferations[J].J Cutan Pathol,2015,42(11):807 ⁃814.doi:10.1111/cup.12564.
[14]陈文静,康晓静,孙振柱,等.新疆地区96例维族恶性黑素瘤临床特征及预后分析[J].中国麻风皮肤病杂志,2015,(5):259⁃261,264.
[15]曾颖,康晓静,张祥月,等.肢端型黑素瘤NRAS基因突变检测及预后分析[J].中华皮肤科杂志,2016,49(7):474⁃477.doi:10.3760/cma.j.issn.0412⁃4030.2016.07.006.

