二氧化碳分压和渗透压升高对CHO细胞维持期生长、代谢和产物表达的影响
王晨 汪嘉琪 赵亮, 范里, 刘旭平, 陈敏 张理想 谭文松,
(1. 华东理工大学 生物反应器工程国家重点实验室,上海 200237;2. 上海倍谙基生物科技有限公司,上海 200237)
抗体类药物因其高特异性、亲和性及安全性等优点被广泛应用于针对人类自身免疫性疾病、癌症类疾病及各种炎症类疾病的治疗过程中。应用动物细胞大规模培养技术生产抗体类药物已成为生物医药产业主流生产技术[1]。伴随细胞高密度及大规模培养,反应器内的二氧化碳分压(pCO2)的累积情况显著增加,甚至到达200 mmHg,显著高于生理水平(31-54 mmHg)[2]。过高的 pCO2除了可以抑制细胞生长、代谢和降低产率之外,对产物糖基化修饰也存在不利影响[3-6]。
除此之外,伴随着培养过程中CO2的大量累积,培养体系逐渐酸化。为有效控制培养体系pH,只能增加补碱量,进而导致体系中渗透压持续升高[7]。而作为另一个重要的培养过程变量,渗透压的升高也会对细胞生长、代谢和产率产生不利影响[4-5,8]。由于细胞高密度维持主要集中在流加培养后期(产物表达期)及灌注培养过程中,这一阶段的二氧化碳累积和渗透压升高问题更应该被关注。因此全面且深入的研究pCO2和渗透压升高对产物表达期细胞生长维持、产物表达及产品质量的影响,对于表达重组蛋白药物的哺乳动物细胞培养工艺优化放大和工业化生产过程的有效控制具有重要的参考价值。
为此,本研究以表达单克隆抗体的CHO细胞为研究对象,考察了不同pCO2和渗透压水平下,细胞生长、代谢和产物表达及产品质量的情况,深入了解了pCO2和渗透压升高对产物表达过程的影响,以期为动物细胞培养工艺放大过程中风险评估奠定部分基础。
1 材料与方法
1.1 材料
本研究所用细胞株为表达单克隆抗体(CD20)的重组CHO细胞株,该细胞株是在原始细胞株CHO-K1基础上共转染抗CD20重链、轻链和二氢叶酸还原酶(DHFR)基因,通过氨甲喋呤(MTX)加压筛选获得[9]。所使用的培养基为实验室自主开发的培养基[10]。培养基配制所需试剂均购于Sigma-Aldrich公司。培养基配制完后经0.22 μm微孔滤膜(Millipore)过滤除菌后使用。
1.2 方法
1.2.1 细胞培养方法
1.2.1.1 种子细胞培养 从细胞库中复苏重组CHO细胞,以5.0×105cells/mL的活细胞密度接种于50 mL细胞培养管(TPP),接种体积为20 mL,置于37℃、5%的CO2条件下进行悬浮扩增培养,摇床转速为220 r/min。每隔2 d进行种子细胞传代扩增,传代后活细胞密度控制在5.0×105cells/mL左右。
1.2.1.2 批式培养 取指数生长期的CHO种子细胞,1 000 r/min离心5 min后,弃培养上清,用新鲜培养基重悬细胞,以1×106cells/mL的活细胞密度接种于1 L(Corning)摇瓶,接种体积为300 mL。根据实验设计,流加培养至5 d,将细胞悬液1 000 r/min离心5 min后,弃培养上清,重悬于预平衡后的新鲜实验用培养基内。选取pCO2为40 mmHg(正常分压组)和150 mmHg(高分压组),渗透压为300、350、400、450 mOsm/kg这几组培养条件进行研究,采用正交法考察两者对CHO细胞产物表达的影响。通过调整培养基中NaHCO3的浓度及培养箱内CO2含量实现不同的pCO2条件,当NaHCO3添加量为2.2和5.5 g/L时,平衡后与之对应的pCO2分别为40 mmHg和150 mmHg。实验中渗透压用NaCl进行调整。将装有重悬后的细胞悬液的摇瓶分别置于32℃、5%或20% CO2的饱和湿度培养箱重新进行悬浮培养,摇床转速为120 r/min,每组实验重复3次。培养过程中第0、1、3、5、7、9天分别取细胞悬液1 mL进行细胞计数后,经10 000 r/min离心5 min后,取上清保存于-80℃,用于后期抗体产量和胞外代谢物浓度的检测。
1.2.2 分析方法
1.2.2.1 基础分析方法 细胞密度及活性首先用台盼蓝染色后,采用血球计数板进行计数。葡萄糖、乳酸、氨、谷氨酰胺和谷氨酸浓度采用NOVA Bioprofile 400生化分析仪检测。产物浓度采用Protein A-HPLC(Applied Biosystems) 方 法[11]检测。上清收获后采用rProtein A 亲和层析柱(GE Healthcare)纯化并收集抗体。
1.2.2.2 胞内代谢物提取及检测方法 取1×107个细胞进行胞内物质淬灭及提取,采用含1 μmol/L十四酸为内标的50%(V/V)乙腈水溶液的提取方法[12]。提取的胞内代谢物溶液采用SpeedVac(Thermo)进行真空离心浓缩至干粉后,保存于-80℃待测。干燥后的胞内代谢物首先使用甲氧胺盐酸盐进行酮基保护后,经MSTFA进行硅烷化衍生,使用安捷伦6890气象色谱(GC)加5975四级杆质量检测器(EI)(MS)进行分离及定量,气象分离采用HP-5毛细管为分离柱(30 m×0.25 mm,膜厚0.25 μm),具体分离方法如文献所述[13]。
1.2.2.3 HPLC法检测抗体电荷异质性 抗体电荷异质性采用弱阳离子交换色谱进行分离及检测[14]。
1.2.2.4 HPLC法检测抗体糖基化 抗体糖基化检测采用2-对氨基苯甲酰胺(2-AB)标记试剂盒(Prozyme)法进行检测[15]。简单来说首先用N-糖酰胺酶(PNGase F)将N-糖从60 μg抗体上解离下来,然后采用2-AB荧光染料标记后,使用TSK-GEL Amide-80(4.6×250 mm)色谱柱进行分离。流动相分别为A(125 mmol/L 甲酸铵,pH4.4)和B(100%乙腈),分离条件为:(1)30%-40% 线性梯度洗脱A 90 min;(2)40%-46% 线性梯度洗脱 A 54 min;(3)46%-95% 线性梯度洗脱 A 1 min;(4)95%-100%线性梯度洗脱A 3 min;(5)100%-30% 线性梯度洗脱A 4 min,流速为0.4 mL/min,检测器为荧光检测器。
1.2.2.5 数据分析 抗体比生成速率及营养物和代谢物的比消耗速率采用浓度与IVCC(活细胞密度对时间的积分)拟合的方法[16]进行计算。
2 结果
2.1 pCO2和渗透压对CHO细胞生长和抗体表达的影响
首先以1×106cells/mL的活细胞密度接种于1 L(Corning)摇瓶中,接种体积为300 mL。细胞在前2 d内快速生长,最大比生长速率为0.89±0.22 day-1,并于第4天达到最高细胞密度为(45.1±8)×105cells/mL后细胞进入稳定维持期。图1-A所示为CHO细胞在不同条件下的细胞维持曲线。如图所示,由于采用换液培养的手段,细胞在降温32℃条件下,细胞密度在pCO2和渗透压较低的情况下培养第6 d出现了明显上升,但随着渗透压的升高,细胞后期的维持密度下降,其中有3组实验组(Osm450-150,Osm400-40和Osm450-40)在第6天细胞密度仅出现维持状态。在相同渗透压情况下,随着pCO2的升高,细胞的后期维持有所改善。
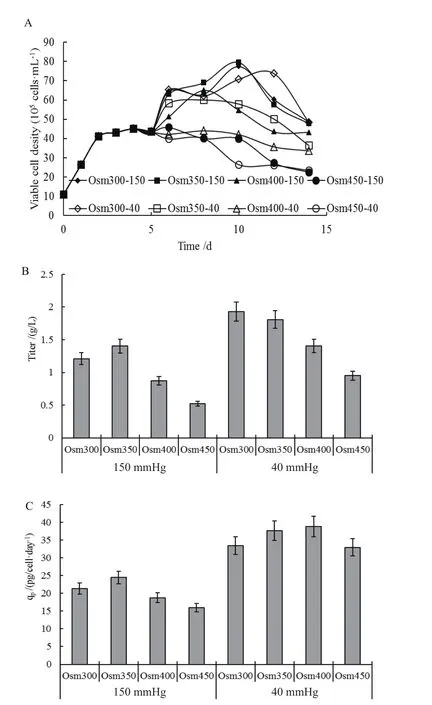
图1 不同pCO2和渗透压条件下细胞维持(A)、抗体浓度(B)及抗体比生产速率(C)
图1-B、C分别是CHO细胞在不同条件下的产量和产物比生成速率(qp)的数据。结果表明,在350 mOsm/kg和40 mmHg下,产物的最终表达量最高(2.03 g/L),在此pCO2下,随着渗透压的升高,细胞的产量成比例下降至最低49.2%。而将pCO2提高至150 mmHg时,产量整体下降,其中在300 mOsm/kg和450 mOsm/kg时,相较于350 mOsm/kg和40 mmHg这一培养条件下产量,分别下降至62.6%和27%。
此外,通过对比不同条件下产物比生成速率可以看出,正常分压组内渗透压改变对产物的比生成速率变化没有显著影响(P<0.05),产物平均比生成速率为35.7 pg/cell·day-1。同时,高pCO2抑制了产物比生成速率,在450 mOsm/kg时,相较于350 mOsm/kg和40 mmHg条件下qp,最大下降至52%。此外,在高分压组内,提高渗透压至450 mOsm/kg时,相对于350 mOsm/kg条件下,细胞的产物比生成速率由24.4 pg/cell·day-1明显下降至16 pg/cell·day-1。
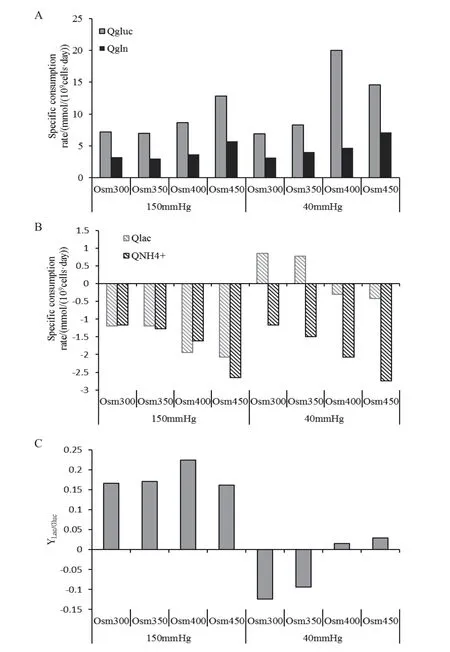
图2 不同pCO2和渗透压下CHO细胞葡萄糖和谷氨酰胺比消耗速率(A)、乳酸和氨比消耗速率(B)以及乳酸得率(C)情况
2.2 pCO2和渗透压对CHO细胞代谢的影响
图2-A、B是不同pCO2和渗透压水平下,CHO细胞胞外葡萄糖(Gluc)、谷氨酰胺(Gln)、乳酸(Lac)和氨离子(NH4+)消耗速率的数据。随着渗透压的升高,细胞的谷氨酰胺和葡萄糖的消耗速率逐渐增加。但是在正常分压组下,细胞渗透压从400 mOsm/kg升高至450 mOsm/kg时,葡萄糖消耗速率减少。同时,在高pCO2组和正常pCO2组内,随着渗透压的升高,胞外的氨和乳酸比生成速率持续增加,尤其在正常分压组内,随着渗透压的升高,乳酸则是完成了从消耗向生成的逆转。在渗透压一致的条件下,培养环境中的pCO2升高对谷氨酰胺和氨的代谢无显著影响,但是对乳酸和葡萄糖代谢影响显著。在300 和350 mOsm/kg下,不同pCO2下细胞的胞外葡萄糖的代谢情况较一致,而乳酸代谢则为相反代谢状态。在400和450 mOsm/kg 高pCO2下,其葡萄糖的消耗速率明显下降,乳酸的生成速率明显提高。通过进一步比较乳酸对于葡萄糖的得率(YLac/Gluc)(图2-C)可知,在高分压下,不论渗透压水平如何变化,乳酸的得率相较正常分压组明显升高;在正常分压组内,随着渗透压的升高,乳酸得率越来越高,但最高仅为450 mOsm/kg和150 mmHg组乳酸得率的18%。
除此之外,进一步考察不同条件下细胞的胞内代谢物情况。图3是不同pCO2和渗透压水平下,CHO细胞胞内各种代谢物在培养第10 d的相对含量图。如图所示,在正常pCO2组内,随着渗透压的升高,胞内物质含量总体升高;在高pCO2组内,渗透压升高至450 mOsm/kg后,胞内物质含量为组内相对浓度最高组。而在相同渗透压下,分压越高,胞内物质的含量越低,尤其以各类氨基酸和糖类为主要降低对象。其中乳酸含量在正常pCO2组内,随着渗透压的升高出现了明显累积,在高pCO2组内,当渗透压达到450 mOsm/kg时,也出现了浓度的升高;而当渗透压≥350 mOsm/kg时,在高pCO2组内乳酸的含量均低于正常pCO2组。观察3个TCA循环中间代谢物琥珀酸、柠檬酸和苹果酸的含量,可以得出提高环境中的pCO2可以提高琥珀酸胞内含量并减少柠檬酸含量(除400 mOsm/kg和150 mmHg条件),同时在正常pCO2情况下提高渗透压则会促进苹果酸的累积。结合胞内和胞外的代谢情况可知,渗透压及二氧化碳分压升高均会对细胞代谢产生复杂且显著的影响,伴随胞外葡萄糖和谷氨酰胺的消耗量增高,胞内物质浓度也大致出现相应的增加的现象。
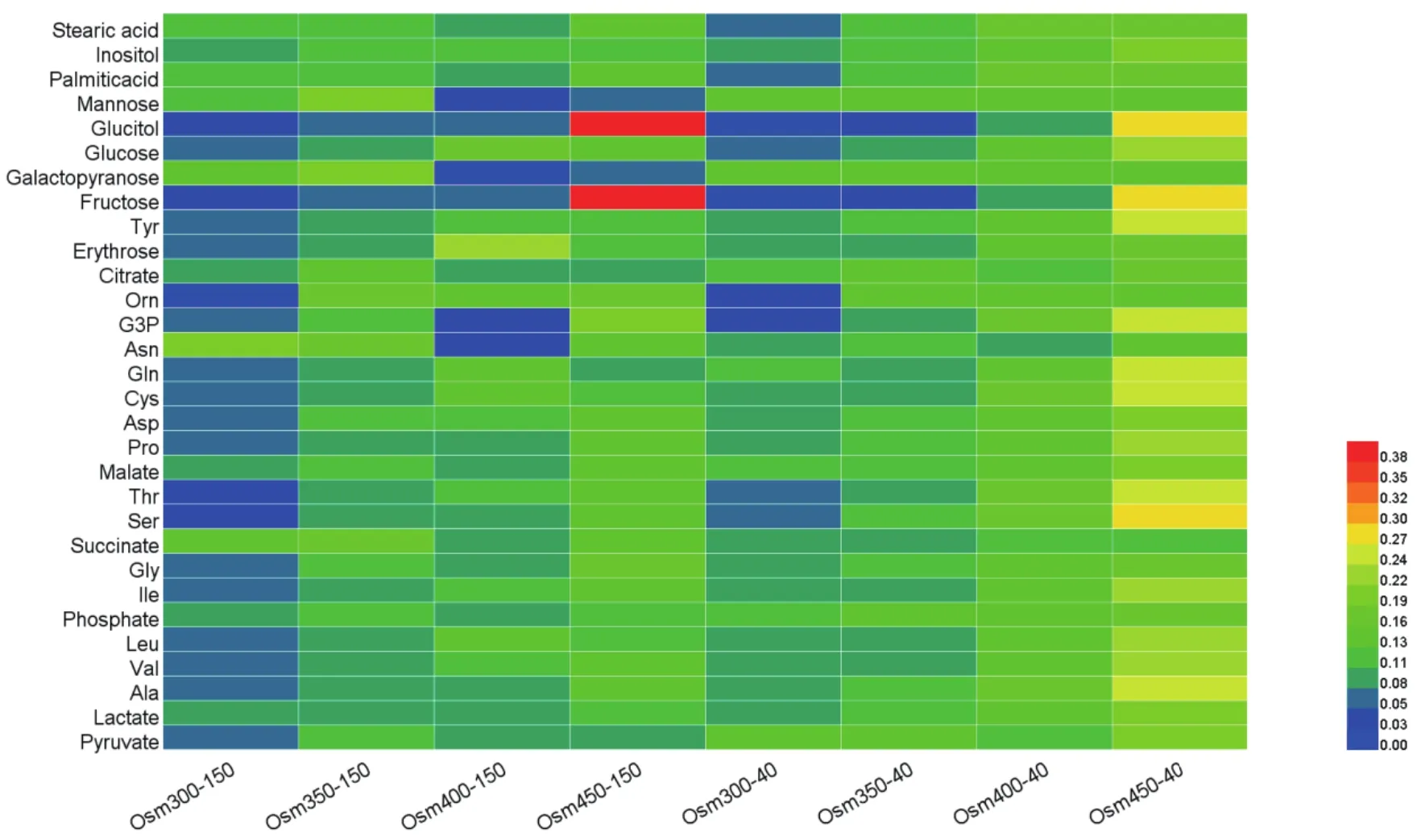
图3 不同pCO2和渗透压下CHO细胞胞内物质相对含量
2.3 pCO2和渗透压对CHO细胞产物产品质量的影响
2.3.1 pCO2和渗透压对CHO细胞产物糖基化的影响 表1为不同pCO2和渗透压下,最终收获的抗体上各种糖型结构的分布比例。如表所示,在相同的pCO2下,随着渗透压的升高,产物的甘露糖糖型含量升高,且半乳糖糖型含量下降,其中G1F的含量明显下降。而在相同渗透压下,二氧化碳含量的升高未导致各类糖型含量的明显变化。
2.3.2 pCO2和渗透压对CHO细胞产物电荷水平的影响 图4为不同 pCO2和渗透压水平下,产物的最终电荷分布情况。如图所示,在正常pCO2组内,渗透压从300 mOsm/kg升至450 mOsm/kg可以促进主峰含量升高43%;在高pCO2组内,同样梯度的渗透压升高也可促进主峰含量升高17%。与此同时,在同一pCO2组内,渗透压的升高导致酸性峰比例逐渐减少;在正常pCO2条件下,渗透压升高还会导致碱性峰含量的逐渐下降。
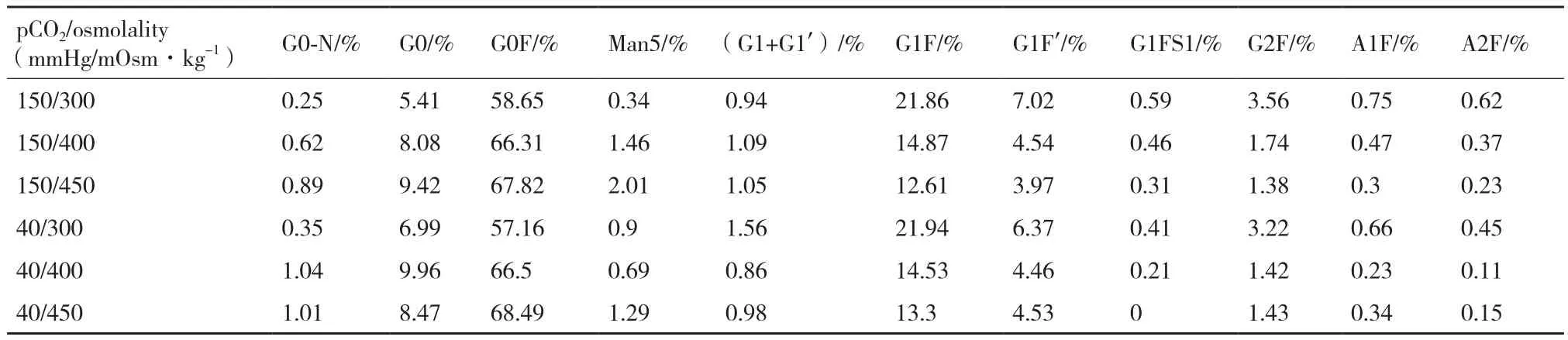
表1 不同pCO2和渗透压下产物糖型分布
在渗透压相同的情况下,高pCO2下,其主峰含量变少;且渗透压越高时,主峰含量差异越大,最大至降低20%(450 mOsm/kg)。其中在渗透压较低的范围(300,350 mOsm/kg)下,二氧化碳含量升高增加产物酸性峰含量,并减少了产物碱性峰含量;在渗透压较高的范围内(400和450 mOsm/kg)二氧化碳分压升高则主要增加其碱性峰的含量。

图4 不同pCO2和渗透压下产物电荷分布
3 讨论
以搅拌式反应器为培养容器,以重组哺乳动物细胞为表达载体生产蛋白类药物已经成为生物制药领域的主流方向之一。在培养规模放大过程中,随着细胞密度的升高,培养体系内CO2和渗透压也逐渐累积,因此pCO2和渗透压的控制也成为了反应器放大过程中的两个关键控制参数。为此,本研究以一株具有工业化应用潜力的表达抗CD20的dhfr-CHO细胞为研究对象,综合研究了pCO2和渗透压升高对细胞产物生成时期的生长维持、代谢、抗体表达和抗体关键质量属性的影响。
细胞培养过程中的最终产量由两方面影响,分别为产物比生成速率及累积活细胞密度(IVCC),其中累积活细胞密度与后期细胞活性维持息息相关。因此本文分别从这两方面了解pCO2和渗透压的升高对最终产量变化的影响。在细胞维持方面,同等渗透压下,高pCO2有利于细胞培养后期的生长维持。本实验体系中培养基的pH缓冲采用碳酸氢钠单独缓冲的体系,因此在培养pH一致时,高pCO2对应培养基中高碳酸氢钠浓度[6],高浓度的缓冲体系则意味着更强的pH缓冲能力,从而缓解了培养后期因为乳酸生成所引起的pH下降而导致的细胞活性的下降。而在抗体表达方面,高pCO2显著降低了细胞的产物比消耗速率,从而导致最终的产量下降,这一现象和前人报道一致[5]。
细胞物质及能量代谢过程中作为抗体生成量的代表性指标有培养过程中的乳酸代谢和细胞有氧代谢效率等,在产物高表达过程中通常伴随胞外乳酸的消耗[17]和胞内有氧糖酵解通路的增强[18]。通过调研不同pCO2下细胞胞外代谢物消耗速率和胞内代谢物的相对浓度可以发现,pCO2升高不利于葡萄糖的消耗,尤其是在渗透压较高的条件下(400和450 mOsm/kg);同时pCO2升高会显著加快代谢副产物乳酸的生成,并使胞内代谢物的平均含量减少。通过进一步计算乳酸得率(YLac/Gluc),可以观察到高pCO2组,其乳酸得率明显升高,这表示消耗单位葡萄糖其生成的乳酸越多,进入TCA循环的比例越低,细胞的物质代谢越低效。而进一步观察胞内代谢物含量可以发现,虽然在高pCO2条件下,多数胞内代谢物含量下降,但胞内琥珀酸的含量明显提高。据前人报道,纯CO2可以直接抑制胞内多种酶,例如,琥珀酸脱氢酶(SDH)[19]和NADPH生成酶[20],因而胞内琥珀酸累积可能和SDH抑制相关。综合胞内外代谢情况,可以看出高pCO2不利于细胞进行有效的有氧代谢。根据前人报道,细胞的线粒体脱氢酶在调节细胞有氧代谢和无氧代谢中具有重要地位,而其活性同产物比生成速率成正相关,因此高二氧化碳分压所导致的细胞有氧代谢低效也可能是造成产物比生成速率下降的重要原因之一[18]。同时观察高pCO2下,产物的关键质量属性(糖型修饰和电荷异质性)的变化,不同于文献关于糖型修饰的报道[3],pCO2的升高对单抗的糖型结构无显著影响,但是显著降低了抗体中性主峰含量[4]。
在相同pCO2内,随着渗透压的升高,细胞后期活性和最终产量逐渐下降,产物比生成速率出现先升高后降低的趋势。但在正常pCO2组内,提高渗透压对产物比生成速率的影响无统计学意义;而在高pCO2组内,当渗透压升高至400 mOsm/kg时,产物的比生成速率相对于150 mOsm/kg组显著下降。此现象说明在高pCO2条件下,增加培养过程中的渗透压水平会对细胞产物表达产生协同抑制作用。同时,通过考察同一pCO2不同渗透压条件下,细胞的胞外代谢速率和胞内物质含量可以分析出,渗透压的升高可以有效促进胞外葡萄糖和谷氨酰胺的消耗,并增强乳酸和氨的生成,同时胞内物质含量也随渗透压的升高而变多。通过进一步计算乳酸得率(YLac/Gluc),可以观察到提高渗透压显著升高了乳酸得率,即降低了细胞的单位葡萄糖有效利用率。除此之外,CHO细胞胞内ATP供给主要依赖糖酵解途径[21]。因此,随着渗透压的升高其葡萄糖利用速率的增加可有效增加细胞胞内ATP含量,此现象也吻合前人的报道[8]。上述结果表明,渗透压升高在一定程度上刺激了细胞中心碳代谢通量,因此其产物比生成速率呈现了先升后降的趋势,但渗透压对细胞生长的抑制作用可能存在除中心碳代谢之外的作用因素[22]。通过对比不同渗透压下产物的关键质量属性,可以看出随着渗透压的升高,产物半乳糖基化水平显著递减。与此同时,随着渗透压的升高,产物的酸性峰比例下调,中性峰比例升高,而其碱性峰比例在不同的pCO2条件下呈现了相反的趋势。
产物表达是CHO细胞表达重组蛋白的重要组成部分,而pCO2和渗透压是两个极易在此过程中累积的关键操作控制参数,因此通过系统了解pCO2和渗透压升高对细胞各项参数的影响,有助于我们在运用QbD(质量源于设计)方法[23]生产单抗药物时,对pCO2和渗透压进行相应的评估标准的设定并进一步指导放大过程的进行。
4 结论
当渗透压为300 mOsm/kg,pCO2为40 mmHg时,产物的最终产量最高,细胞的营养物代谢最高效,产物的糖型修饰也较完整,但是产物的中性电荷主峰含量为最低。在此基础上提高渗透压可以有效的增加产物的中性电荷主峰,但是其余参数水平下调。pCO2的升高不利于产物表达和产物产品质量。综合而言,在反应器放大的过程应当尽量避免pCO2和渗透压的过度累积以保证最终产量最大化。
[1] Bandaranayake AD, Almo SC. Recent advances in mammalian protein production[J]. FEBS Lett, 2014, 588(2):253-260.
[2] Altman PL, Dittmer D. Respiration and Circulation[M].Federation of American Societies of Experimental Biology, 1971.
[3] Brunner M, Fricke J, Kroll P, et al. Investigation of the interactions of critical scale-up parameters(pH, pO2and pCO2)on CHO batch performance and critical quality attributes[J]. Bioproc Biosyst Eng, 2017, 40(2):251-263.
[4] Schmelzer AE, Miller WM. Hyperosmotic stress and elevated pCO2alter monoclonal antibody charge distribution and monosaccharide content[J]. Biotechnol Progr, 2002, 18(2):346-353.
[5] Kimura R, Miller WM. Effects of elevated pCO2and/or osmolality on the growth and recombinant tPA production of CHO cells[J].Biotechnol Bioeng, 1996, 52:152-160.
[6] Goudar CT, Matanguihan R, Long E, et al. Decreased pCO2accumulation by eliminating bicarbonate addition to high celldensity cultures[J]. Biotechnol Bioeng, 2007, 96(6):1107-1117.
[7] Xing Z, Lewis AM, Borys MC, et al. A carbon dioxide stripping model for mammalian cell culture in manufacturing scale bioreactors[J].Biotechnol Bioeng, 2017, 114(6):1184-1194.
[8] Pfizenmaier J, Matuszczyk JC, Takors R. Changes in intracellular ATP-content of CHO cells as response to hyperosmolality[J].Biotechnol Progr, 2015, 31(5):1212-1216.
[9] Chen F, Fan L, Wang J, et al. Insight into the roles of hypoxanthine and thydimine on cultivating antibody-producing CHO cells:cell growth, antibody production and long-term stability[J]. Appl Microbiol Biotechnol, 2012, 93(1):169-178.
[10] 谭文松, 孙亚婷, 赵亮. 适于动物细胞表达产品大规模生产的化学成分明确培养基:中国, CN 104328158 A[P]. 2015-02-04.
[11] Yang JD, Lu C, Stasny B, et al. Fed-batch bioreactor process scaleup from 3-L to 2, 500-L scale for monoclonal antibody production from cell culture[J]. Biotechnol Bioeng, 2007, 98(1):141-154.
[12] Dietmair S, Timmins NE, Gray PP, et al. Towards quantitative metabolomics of mammalian cells:development of a metabolite extraction protocol[J]. Anal Biochem, 2010, 404(2):155-164.
[13] Zhao C, Nambou K, Wei L, et al. Evaluation of metabolome sample preparation methods regarding leakage reduction for the oleaginous yeastYarrowia lipolytica[J]. Biochem Eng J, 2014, 82:63-70.
[14] Zhang XT, Tang HP, Sun YT, et al. Elucidating the effects of arginine and lysine on a monoclonal antibody C-terminal lysine variation in CHO cell cultures[J]. Appl Microbiol Biotechnol,2015, 99(16):6643-6652.
[15] Guile GR, Rudd PM, Wing DR, et al. A rapid high-resolution high-performance liquid chromatographic method for separating glycan mixtures and analyzing oligosaccharide profiles[J]. Anal Biochem, 1996, 240(2):210-226.
[16] 陈以衡, 陶姝宇, 刘旭平. 微载体浓度与细胞接种密度对ST细胞生长的影响[J]. 生物技术通报, 2016, 32(4):242-250.
[17] Le H, Kabbur S, Pollastrini L, et al. Multivariate analysis of cell culture bioprocess data-lactate consumption as process indicator[J]. J Biotechnol, 2012, 162(2-3):210-223.
[18] Chen F, Ye Z, Zhao L, et al. Correlation of antibody production rate with glucose and lactate metabolism in Chinese hamster ovary cells[J]. Biotechnol Lett, 2012, 34(3):425-432.
[19] Edwards LJ. Carbon dioxide anaesthesia and succinic dehydrogenase in the corn earworm, Heliothis zea[J]. J Insect Physiol, 1968, 14(8):1045-1048.
[20] Friedlander A, Navarro S, Silhacek DL. The effect of carbon dioxide on NADPH production inEphestia cautella(Wlk. )pupae[J].Comp Biochem Phys B, 1984, 77(4):839-842.
[21] Martínez VS, Dietmair S, Quek LE, et al. Flux balance analysis of CHO cells before and after a metabolic switch from lactate production to consumption[J]. Biotechnol Bioeng, 2013, 110(2):660-666.
[22] Shen D, Kiehl TR, Khattak SF, et al. Transcriptomic responses to sodium chloride-induced osmotic stress:A study of industrial fedbatch CHO cell cultures[J]. Biotechnol Progr, 2010, 26(4):1104-1115.
[23] Rathore AS. Roadmap for implementation of quality by design(QbD)for biotechnology products[J]. Trends Biotechnol, 2009,27(9):546-553.
——2017年渗透压相关高考真题赏析

