Ad-pre-microRNA-494抑制Survivin对膀胱癌UM-UC-3细胞的凋亡诱导作用
王礼平 卢晓明 阳东荣 李兰 王进峰 周国洋 尹九湖 刘亚东 董彬彬
尿路上皮癌是最常见的膀胱癌之一,其在膀胱癌中占90%以上,具有术后复发率高、复发后恶性程度增加的特点[1]。Survivin作为凋亡抑制蛋白家族抑制作用最强的成员之一,表达于包括膀胱癌在内的绝大多数恶性肿瘤,主要作用于细胞有丝分裂G2/M期,在细胞中发挥着促进增殖、抑制凋亡的作用[2]。Vol'pina等[3]对膀胱癌术后标本分析显示,膀胱癌组织中Survivin表达较周围正常组织显著增高,且与分化程度和临床分期呈正相关。Diakos等[4]及本课题既往研究[5]均发现上调miRNA-494的表达能够有效抑制Survivin蛋白表达,进而诱导肿瘤细胞凋亡。本研究应用生物学软件TargetScan 5.2预测microRNA-494与Survivin mRNA配对情况,成功构建腺病毒载体Ad-pre-microRNA-494[6-7],将其作用于膀胱癌UM-UC-3细胞,观察其对Survivin的抑制作用及对膀胱癌细胞的影响。
材料与方法
一、材料
1.细胞株及腺病毒载体:应用生物学软件Target Scan 5.2对miRNA-494基因与Survivin mRNA进行匹配评分(图1),RT-PCR法调取目的基因,将其连接线性化后的穿梭质粒载体,联合骨架质粒转染入293细胞同源重组后产生重组腺病毒载体,构建成功后测序并检测保存(图2)[5],人膀胱尿路上皮癌UM-UC-3细胞株购自美国模式培养物集存库(American Type Culture Collection, ATCC),HEK-293A细胞株购自上海中国科学院细胞库。
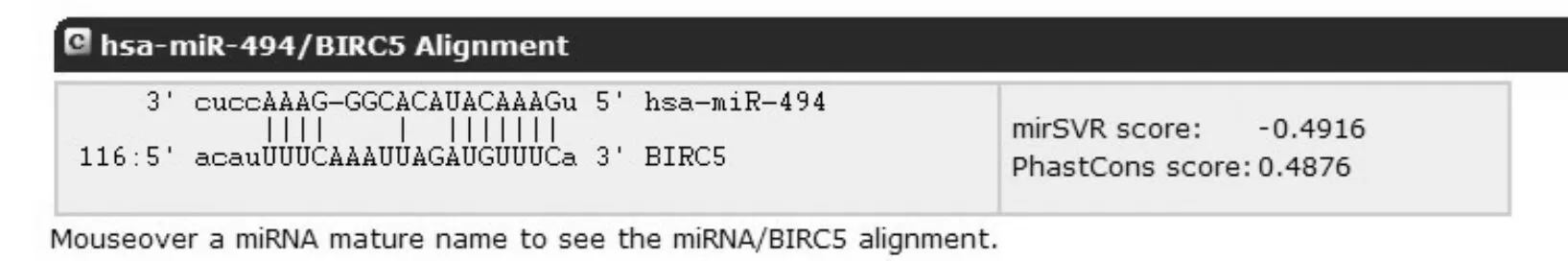
图1miRNA-494与Survivin基因数据库匹配结果

图2腺病毒质粒阳性克隆测序结果
2.主要器材及试剂:胎牛血清、Ham's F12及RPMI-1640培养液均购自Gibco公司,逆转录酶MMLV购自Fermentas公司;逆转录试剂盒购自Promega公司;Real-time PCR试剂盒SYBR FAST Qpcr Kit Master Mix(2×) Universal购自KAPA Biosystems公司;PI kit、Annexin Ⅴ-APC/7-AAD kit购自Abnova公司;Braford蛋白含量检测试剂盒购自上海捷瑞生物工程有限公司,兔抗人Survivin单克隆抗体购自CST公司、Rabbit anti-GAPDH 多克隆抗体购自EarthOx公司、HRP标记的羊抗兔IgG购自武汉博士德生物工程有限公司。
二、实验方法
1.细胞培养:UM-UC-3细胞使用添加了10%胎牛血清的Ham's F12完全培养液培养、HEK-293A细胞使用添加了10%胎牛血清的RPMI-1640培养液培养,培养环境均为含5% CO2的37 ℃细胞培养温箱。
2.重组腺病毒的扩增、纯化及滴度测定:取出保存的Ad-pre-microRNA-494腺病毒载体及空病毒载体置入37 ℃、5% CO2水箱中复苏,将病毒原液离心后按每100 μl原液感染5×106个HEK-293A细胞的比例进行接种,荧光显微镜检测绿色荧光表达,待70%~80%细胞漂浮后收集离心并置入EP管,于-70 ℃冰箱保存。氯化铯离心纯化后按稀释法进行病毒滴度测定。测定好的腺病毒感染UM-UC-3细胞:实验分为PBS、空腺病毒载体(简称Ad)、Ad-pre-microRNA-494(简称Ad-494)3组,使用Ad以50、100、200 MOI剂量感染UM-UC-3细胞48 h,光镜及荧光视野下分别观察感染了50、100、200 MOI剂量Ad的细胞情况,可见200 MOI感染的细胞出现细胞漂浮、圆缩的病毒毒性作用;其余剂量组细胞与PBS对照组相比无显著差别,荧光视野观察几乎所有细胞均呈现绿色荧光,表明50、100 MOI感染剂量的Ad对细胞毒性作用极小,且感染效率高达95%以上(图3)。我们遵照选择感染效率高、毒性低的原则,选择50 MOI作为最优剂量。
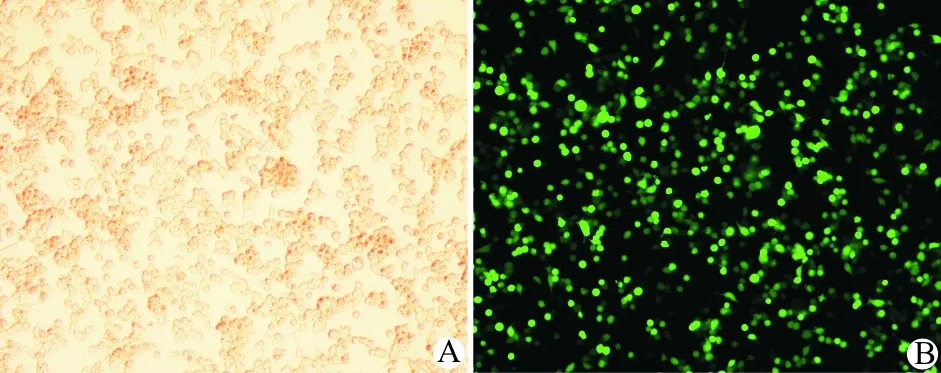
A:光镜观,×100;B:荧光镜观,×100
图3腺病毒在293细胞中成功扩增(光镜、荧光镜)
3.MTT法检测各组细胞生长情况:使用50 MOI感染各组细胞,MTT法检测24、48、72 h的细胞生长情况,紫外分光光度计测定吸光度(OD)值,并绘制成细胞生长曲线。
4.RT-PCR法检测Survivin mRNA表达情况:将感染腺病毒后24、48、72 h的细胞加入Trizol进行总mRNA提取,Promega试剂盒进行cDNA逆转录,反应条件:70 ℃ 5 min,37 ℃ 5 min,42 ℃ 1 h,-70 ℃ 10 min。
PCR引物序列(对照内参GAPDH):Survivin-F 5′-GCATGGGTGCCCCGACGTTG-3′;Survivin-R 5′-GCTCCGGCCAGAGGCTCAA-3′。
反应条件:94 ℃ 2 min,94 ℃ 52 s,58 ℃ 50 s,72 ℃ 54 s,30个循环,72 ℃ 10 min。2%琼脂糖凝胶电泳检测PCR结果。
5.Western blot法检测Survivin蛋白表达:收集各时间段细胞蛋白后按照试剂盒说明书实行蛋白定量,孵育并洗膜,柯达胶片曝光、显影、定影,进行条带光密度值检测(Bio-Rad Quantity One软件)。
6.细胞周期阻滞及凋亡检测:收集腺病毒感染后24、48、72 h的各组细胞约4×106个,PBS清洗后去除上清液,经PI、Annexin Ⅴ-APC/7-AAD单染色及双染色后,使用流式细胞仪进行细胞周期、凋亡率检测。
三、统计学方法
结 果
腺病毒复苏、扩增、纯化成功,稀释法滴度检测结果为5×108GFU/ml。
由细胞生长曲线来看(图4),Ad-494组相对于Ad组、PBS组对细胞存在生长抑制作用,以72 h时间段作用最为明显。
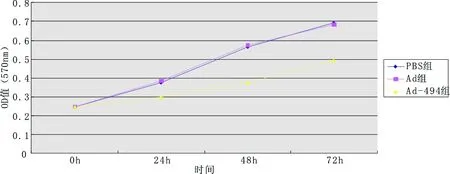
图4不同时间段各组细胞生长曲线
RT-PCR法检测Survivin mRNA表达,如图5所示,相比对照组,Ad-494组24、48、72 h后Survivin mRNA 表达明显下调,呈现明显的时间依赖性(P<0.05)。
Western blot法检测Survivin蛋白表达,结果(图6)表明Ad-494组对Survivin蛋白表达有显著抑制作用;通过灰度分析软件分析显示,与Ad组相比,Ad-494组24、48、72 h后Survivin蛋白表达分别为(23.14±3.21)%、(16.32±3.68)%、(11.46±2.25)%。

图5各组不同时间段Survivin mRNA表达情况
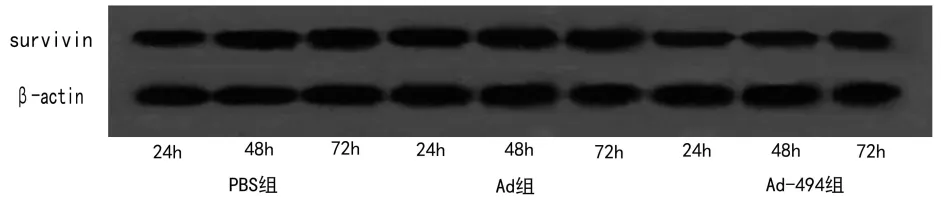
图6各组不同时间段Survivin蛋白表达情况
使用流式细胞仪检测细胞周期阻滞及凋亡情况,PI单染色后流式细胞周期检测结果显示,重组腺病毒感染后的细胞均呈现G2/M期阻滞,24、48、72 h结果分别为(21.26±3.12)%、(44.21±3.42)%、(53.31±3.78)%,显著高于PBS组[分别为(5.32±1.21)%、(5.47±1.32)%、(6.44±1.12)%]、Ad组[分别为(7.11±1.44)%、(7.82±1.26)%、(9.11±1.63)%](P<0.05)。进行Annexin Ⅴ-APC/7-AAD双染色后,各组细胞在72 h的凋亡率最高,分别为PBS组(3.29±2.24)%、Ad组(8.23±2.24)%、Ad-494组(24.42±4.45)%(P<0.05)(图7)。
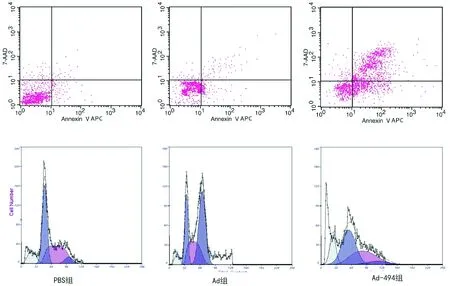
图7各组感染72 h后细胞周期及凋亡检测情况
讨 论
膀胱癌是常见的泌尿生殖系肿瘤之一,据Chen等[8]统计,2015年中国约有80 500例新发膀胱癌被确诊,32 900例膀胱癌患者死亡。其中90%以上为非肌层浸润性膀胱癌,即便进行规范的治疗,仍有50%~70%的患者可能出现复发或转移。
微小RNA(miRNA)是通过结合mRNA的3′非翻译区(UTR)从而调节蛋白质编码基因表达产生基因沉默效应的一类内源性非编码小RNA分子。既往的大量研究显示,异常表达的miRNAs与许多类型的肿瘤发生、发展密切相关,且超过一半的miRNAs通过作用于肿瘤基因组区域发挥作用,某些miRNA作为标志物甚至可以追溯到肿瘤的起源组织,为明确肿瘤的发生提供依据[9-10]。一部分高度表达的miRNAs通过抑制肿瘤抑制因子起癌基因的作用,另一部分则可以负向调节癌基因,发挥肿瘤抑制因子作用。miRNAs通过影响一系列调控网络发挥作用,单个miRNA甚至可以通过多个途径影响更多基因表达,调节一系列肿瘤相关基因。Survivin作为经典的凋亡抑制蛋白分子之一,几乎在所有常见的恶性肿瘤中过表达,并且表达Survivin 蛋白的肿瘤大多预后较差,肿瘤细胞凋亡率低[11]。其通过发挥调控细胞分裂和抑制细胞凋亡的双重作用,诱导肿瘤血管生成,促进肿瘤进展,基于上述特征也使其成为了肿瘤基因治疗的理想靶点[12]。Zhang等[13]近期研究发现,MicroRNA-542-3p可以通过转录后调节Survivin从而抑制膀胱癌细胞的细胞增殖,Yang等[14]则发现miR-138-5p可通过靶向膀胱癌细胞中的Survivin蛋白促进肿瘤细胞增殖和侵袭。另有研究发现,通过检测尿液标本中Survivin的表达水平可以为膀胱肿瘤的早期诊断提供重要的依据[15]。Jeon等[16]进行的一项包含2 165例膀胱癌患者的荟萃分析显示,Survivin蛋白高表达的患者预后更差。因此,本课题组通过构建过表达miRNA-494的腺病毒载体,靶向抑制膀胱肿瘤细胞中Survivin基因的表达来诱导肿瘤细胞凋亡,可能是一种较好的基因治疗方式。
本研究应用已成功构建的腺病毒载体Ad-pre-microRNA-494,靶向抑制膀胱癌UM-UC-3细胞,观察其不同时间段对Survivin的抑制作用及对细胞周期、凋亡情况的影响,检测结果显示过表达腺病毒载体Ad-pre-miRNA-494在体外能显著抑制Survivin表达,抑制膀胱癌UM-UC-3细胞生长,诱导其凋亡,且呈现时间依赖性,为miRNA介导的膀胱癌基因治疗提供了有益的尝试。
[1]Fleshner NE, Herr HW, Stewart AK, et al. The National Cancer Data Base report on bladder carcinoma. The American College of Surgeons Commission on Cancer and the American Cancer Society[J]. Cancer,1996,78(7):1505-1513.
[2]王鹏,李元春. Survivin在男性泌尿系统肿瘤中的临床意义[J]. 生殖与避孕,2013,33(12):854-859.
[3]Vol'pina OM, Zavalishina LE, Volkova TD, et al. The apoptosis inhibitor Survivin in transitional cell carcinoma of the urinary bladder[J]. Arkh Patol,2011,73(2):8-11.
[4]Diakos C, Zhong S, Xiao Y, et al. TEL-AML1 regulation of survivin and apoptosis via miRNA-494 and miRNA-320a[J]. Blood,2010,116(23):4885-4893.
[5]王礼平,阳东荣,单玉喜,等. 微小RNA-494通过抑制Survivin诱导前列腺癌PC-3细胞凋亡[J]. 中华实验外科杂志,2012,29(6):1043-1046.
[6]孙承文,王礼平,臧亚晨,等. 微小RNA-494过表达与RNA干扰抑制Survivin基因对前列腺癌移植瘤生长的比较[J]. 中华实验外科杂志,2013,30(8):1691-1694.
[7]Zhu J, Sun C, Wang L, et al. Targeting survivin using a combination of miR494 and survivin shRNA has synergistic effects on the suppression of prostate cancer growth[J]. Mol Med Rep,2016,13(2):1602-1610.
[8]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[9]Calin GA, Sevignani C, Dumitru CD, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci U S A,2004,101(9):2999-3004.
[10]Rosenfeld N, Aharonov R, Meiri E, et al. MicroRNAs accurately identify cancer tissue origin[J]. Nat Biotechnol,2008,26(4):462-469.
[11]阳东荣,单玉喜,杨光天. RNA干扰双位点抑制Survivin基因诱导雄激素非依赖性前列腺癌PC-3细胞凋亡[J]. 中华实验外科杂志,2006,23(3):348-350.
[12]Altieri DC. Survivin, cancer networks and pathway-directed drug discovery[J]. Nat Rev Cancer,2008,8(1):61-70.
[13]Zhang J, Wang S, Han F, et al. MicroRNA-542-3p suppresses cellular proliferation of bladder cancer cells through post-transcriptionally regulating survivin[J]. Gene,2016,579(2):146-152.
[14]Yang R, Liu M, Liang H, et al. miR-138-5p contributes to cell proliferation and invasion by targeting Survivin in bladder cancer cells[J]. Mol Cancer,2016,15(1):82.
[15]Abd El-Hakim TF, El-Shafie MK, Abdou AG, et al. Value of urinary survivin as a diagnostic marker in bladder cancer[J]. Anal Quant Cytopathol Histpathol,2014,36(3):121-127.
[16]Jeon C, Kim M, Kwak C, et al. Prognostic role of survivin in bladder cancer: a systematic review and meta-analysis[J]. PLoS One,2013,8(10):e76719.

