丹参酮II⁃A磺酸钠对大鼠油酸致急性肺损伤纤维化的干预效应
刘志平 罗力 李粉英 陈远彬 秦少萍 贺明 曾昭智 郑名华
1广东药科大学附属第二医院(广州新海医院)(广州 510300);2广东省中医院(广州 510120);3广东药科大学实验动物中心(广州 510006)
急性肺损伤(acute lung injury,ALI)是临床常见的急重症,是由多种原因引起的以肺泡毛细血管膜通透性增高为特征的肺损伤,是临床重症监护患者主要的死亡原因,现有研究[1-4]表明炎症细胞、肺泡上皮细胞和成纤维细胞产生的细胞因子扩大和加重了肺损伤中的炎症反应,细胞因子构成的炎症因子网络在其中发挥重要的作用。已有的研究表明,ALI早期即可出现纤维化,而肺纤维化对病情进展及预后有显著影响。因此,研究ALI中炎症因子的表达及相互关系,对更好地了解ALI纤维化发生机制及药物干预是非常重要的,并可为其治疗和预防提供新的途径。目前而言仍没有一种药物对此有确切疗效,为此本研究尝试用丹参酮Ⅱ⁃A磺酸钠对油酸诱导大鼠急性肺损伤纤维化进行干预作用,通过检查与其相关的白介素1(IL⁃1)、肿瘤坏死因子α(TNF⁃α)、Ⅲ型前胶原(PCⅢ)和转化生长因子β1(TGF⁃β1),探讨其可能的作用机制。
1 材料与方法
1.1材料丹参酮Ⅱ⁃A磺酸钠注射液:上海上药第一生化药业有限公司,批号:1603102;IL⁃1、TNF⁃α、PCⅢ、TGF⁃β1 ELISA检测试剂盒:上海哈灵生物科技有限公司,批号:201705;油酸:天津市致远化学试剂有限公司,批号:2016110142;10%中性福尔马林:广州化学试剂厂,批号:20150303。SD大鼠,雄性,180~220 g,南方医科大学实验动物中心提供,合格证号SCXK(粤)2016-0041。实验期动物饲养在屏障环境,实验动物使用许可证号:SYXK(粤)2012-1125。
1.2仪器FA2004B电子天平(上海精科天美),HZT⁃A1000电子天平(厦门华志),RM2235切片机(德国徕卡),AE2000倒置显微镜(厦门麦克奥迪)、HCP246恒温培养箱(德国Memmert),3K15冷冻离心机(德国SIGMA),Infinite 200 pro酶标仪(瑞士tecan),血气分析仪(美国ABBOTT公司),Forma 902超低温冰箱(美国Thermo)。
1.3方法1.3.1急性肺损伤大鼠模型建立66只大鼠一次性尾静脉注射油酸0.13 mL/kg建立急性肺损伤大鼠模型,12 h后经尾动脉取血约0.2 mL,用手持式血气分析仪进行血气分析,以氧合指数PaO2/FiO2≤300为造模成功。
1.3.2分组及给药取同批正常24只大鼠尾静脉注射生理盐水0.13 mL/kg作为正常对照组。选取建模成功的大鼠48只,随机分成模型组和丹参酮治疗组2组,每组动物24只,正常对照组和模型组腹腔注射生理盐水2 mL/kg,丹参酮治疗组腹腔注射丹参酮Ⅱ⁃A磺酸钠注射液10 mg/kg,每天1次,连续14 d。分别于停药第7天和14天每组随机处死12只大鼠进行相应指标的测定。
1.3.3指标测定给药前和停药第7、14天进行大鼠体重测定。大鼠尾动脉采血约0.2 mL,利用血气分析仪检测大鼠给药前和停药第7、14天血液PaO2、PaO2/FiO2值。分别于停药第7和14天取大鼠全肺称重,并按如下公式计算肺指数:肺指数=肺重(mg)/体重(g)。取左肺称重,置烘箱烘60℃烘干72 h,再次称重,进行湿/干质量比(W/D)计算,以此判别大鼠肺部的水肿程度。
1.3.4肺组织形态学评价经10%福尔马林固定停药第7和14天大鼠的右肺上叶,按常规方法制作石蜡病理切片,染色镜检。每组选6张玻片,每张玻片观察2个视野,按下述标准评定病变程度评分作为肺损伤的组织学半定量评价指标(IQA)。急性肺损伤肺组织学评分是根据肺组织充血水肿、红细胞和炎症细胞浸润、肺泡腔消失的程度评为0~3分。其中0分为肺组织无充血水肿、无红细胞和炎症细胞浸润,肺泡腔完好;1分为轻度充血水肿、偶见红细胞和炎症细胞浸润,偶见或局限肺泡腔消失;2分为中度充血水肿、红细胞和炎症细胞部分充盈肺泡、肺泡腔消失>20%;3分为显著充血水肿、红细胞和炎症细胞几乎充满肺泡腔、肺泡腔消失大于50%。
1.3.5血清IL⁃1、TNF⁃α、PCⅢ和TGF⁃β1含量测定分别于停药第7和14天大鼠动脉采血3 mL,1 000 r/min离心10 min离心取血清,ELISA法测定IL⁃1、TNF⁃α、PCⅢ和TGF⁃β1水平,含量测定实验步骤按照ELISA试剂盒说明书操作。
1.4统计学方法数据以表示,采用SPSS 12.0软件进行单因素方差分析。
2 结果
2.1丹参酮Ⅱ⁃A磺酸钠对ALI大鼠体重的影响与模型组比较,正常对照组、丹参酮治疗组大鼠在停药7 d和14 d后其体重差异无显著性(P>0.05),见表1,提示丹参酮Ⅱ⁃A磺酸钠对ALI大鼠体重无明显影响。
表1 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠体重的影响(n=24)Tab.1 The effect of sulfotanshinone sodium on the weight of ALI rats(n=24)±s
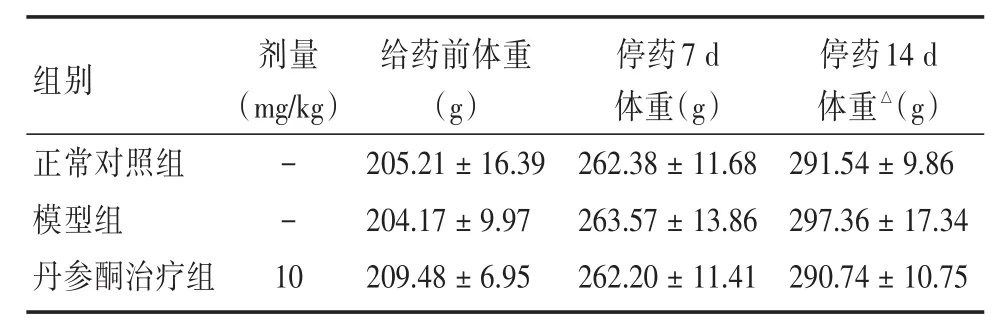
表1 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠体重的影响(n=24)Tab.1 The effect of sulfotanshinone sodium on the weight of ALI rats(n=24)±s
注:△表示n=12,下同
组别正常对照组模型组丹参酮治疗组- - 1 0 205.21±16.39 204.17±9.97 209.48±6.95 262.38±11.68 263.57±13.86 262.20±11.41 291.54±9.86 297.36±17.34 290.74±10.75剂量(mg/kg)给药前体重(g)停药7 d体重(g)停药14 d体重△(g)
2.2丹参酮Ⅱ⁃A磺酸钠对ALI大鼠血液PaO2、PaO2/FiO2值的影响模型组和丹参酮治疗组大鼠给药前PaO2、PaO2/FiO2值均显著低于正常对照组,说明ALI大鼠造模成功,丹参酮治疗组停药7 d和14 d后的PaO2、PaO2/FiO2值与模型组比较差异存在显著性(P<0.05),明显高于模型组大鼠,见表2。
2.3丹参酮Ⅱ⁃A磺酸钠对ALI大鼠肺指数及湿/干重比的影响与模型组相比,正常对照组和丹参酮治疗组停药7 d和14 d后其肺指数及湿/干重比均有不同程度降低,除丹参酮治疗组停药7 d肺指数外其余指标差异存在显著性(P<0.05),见表3。
表2 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠血液PaO2、PaO2/FiO2值的影响(n=24)Tab.2 The effect of sulfotanshinone sodium on the PaO2、PaO2/FiO2of ALI rats blood(n=24) ±s
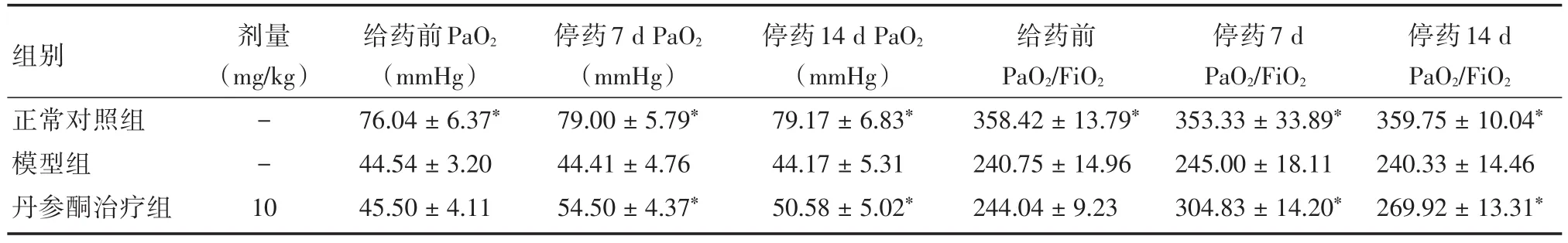
表2 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠血液PaO2、PaO2/FiO2值的影响(n=24)Tab.2 The effect of sulfotanshinone sodium on the PaO2、PaO2/FiO2of ALI rats blood(n=24) ±s
注:与模型组相比,*P<0.05
剂量(mg/kg)组别正常对照组模型组丹参酮治疗组--1 0给药前PaO2(mmHg)76.04±6.37*44.54±3.20 45.50±4.11停药7 d PaO2(mmHg)79.00±5.79*44.41±4.76 54.50±4.37*停药14 d PaO2(mmHg)79.17±6.83*44.17±5.31 50.58±5.02*给药前PaO2/FiO2 358.42±13.79*240.75±14.96 244.04±9.23停药7 d PaO2/FiO2 353.33±33.89*245.00±18.11 304.83±14.20*停药14 d PaO2/FiO2 359.75±10.04*240.33±14.46 269.92±13.31*

表3 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠肺指数及湿/干重比的影响(n=12)Tab.3 The effect of sulfotanshinone sodium on the index and wet/dry ratio of ALI rats lung(n=12) x±s
2.4丹参酮Ⅱ⁃A磺酸钠对ALI大鼠肺组织的形态学影响肉眼可见,模型组大鼠肺表面血红病变区,肺水肿且体积增大。经丹参酮Ⅱ⁃A磺酸钠干预治疗后,肺表面血红色区减少,水肿和充血大部分消失,接近正常组。光镜下正常组肺泡腔完好,肺泡炎细胞很少,几乎无肺水肿,支气管上皮无变形和管周炎,无纤维化。模型组肺泡腔消失,肺泡壁增厚和炎细胞增多,肺水肿和支气管上皮变形严重,肺结构破坏和纤维增殖明显。丹参酮Ⅱ⁃A磺酸钠干预治疗后,肺水肿和支气管变形等现象明显减轻或者消失,肺泡炎细胞和肺间质炎细胞明显减少,纤维化减轻,见图1。与模型组相比,正常对照组和丹参酮治疗组停药7 d和14 d后其肺损伤的组织学半定量评分(IQA)均有不同程度降低,差异存在显著性(P<0.05),见表4。
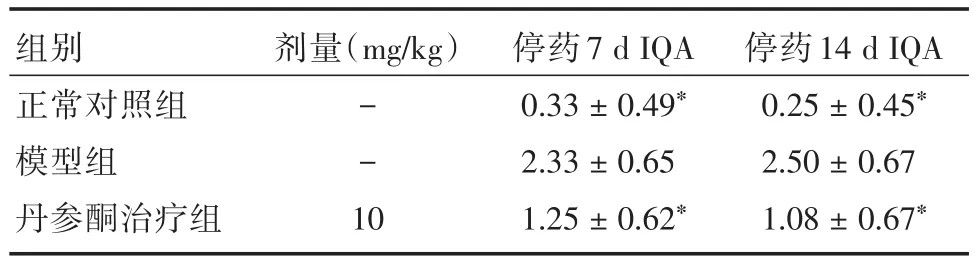
表4 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠肺损伤组织学半定量评分的影响(n=12)Tab.4 The effect of sulfotanshinone sodium on the IQA of ALI rats lung(n=12) x±s
2.5丹参酮II⁃A磺酸钠对ALI大鼠血液IL⁃1、TNF⁃α、PCⅢ和TGF⁃β1水平的影响与模型组比较,正常对照组和丹参酮治疗组停药7 d和14 d后大鼠血液的IL⁃1、TNF⁃α、PCⅢ、TGF⁃β1水平均明显降低,差异存在显著性(P<0.05),但停药14 d后血液PCⅢ、TGF⁃β1水平有一定程度上升,见表5。
3 讨论
油酸型ALI模型是急性肺损伤研究中最常使用的模型之一且成模率高特点明显,本症是以渗出、炎症和纤维增殖阶段为特点,ALI早期即可出现肺纤维化。
本研究中大鼠注射油酸后出现肺充血水肿,肺泡壁增厚和炎细胞增多,肺损伤和纤维化增殖明显,这些变化较好地模拟了临床上急性肺损伤纤维化的病理变化,另外模型动物的氧合指数PaO2/FiO2≤300且肺指数和肺湿干比重明显高于正常对照组动物,表明动物造模成功,经丹参酮Ⅱ⁃A磺酸钠治疗后,肺水肿和支气管变形等现象明显减轻,炎症细胞明显减少,纤维化症状减轻,反映肺损伤病变程度的组织学半定量评分(IQA)分值降低,同时能提高动物血液中PaO2、PaO2/FiO2指数,丹参酮治疗组大鼠部分指标接近正常对照组水平,这提示丹参酮Ⅱ⁃A磺酸钠对大鼠油酸型ALI模型纤维化有一定治疗保护作用。文献[5]报道,丹参酮ⅡA磺酸钠联合吲哚布芬能明显改善疗心源性脑栓塞患者血液流变学效应,丹参酮ⅡA磺酸钠对小鼠接种人巨细胞病毒性肝炎有明确的治疗作用,机制与其活血化瘀、降低TGF⁃β1、抑制小鼠肝微粒体细胞色素(450)亚型酶酶活性,促进肝功能恢复有关[6]。
表5 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠血液IL⁃1、TNF⁃α、PCⅢ、TGF⁃β1水平的影响Tab.5 The effect of sulfotanshinone sodium on the IL⁃1、TNF⁃α、PCⅢ and TGF⁃β1 of ALI rats blood(n=12) ±s
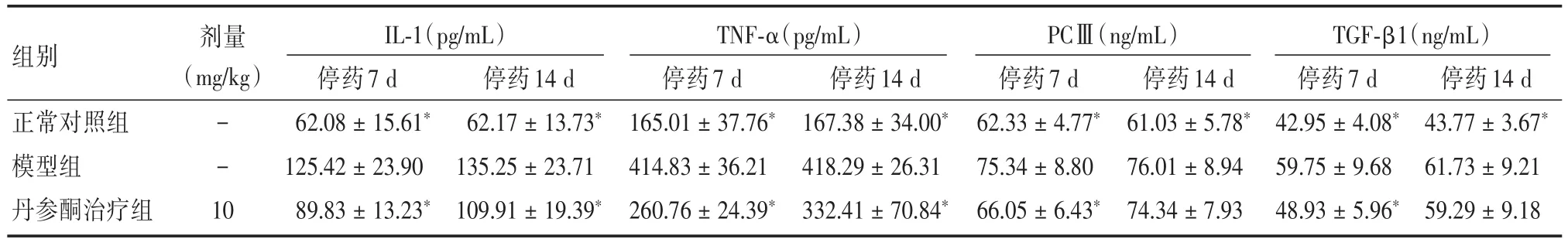
表5 丹参酮Ⅱ⁃A磺酸钠对ALI大鼠血液IL⁃1、TNF⁃α、PCⅢ、TGF⁃β1水平的影响Tab.5 The effect of sulfotanshinone sodium on the IL⁃1、TNF⁃α、PCⅢ and TGF⁃β1 of ALI rats blood(n=12) ±s
注:与模型组相比,*P<0.05
剂量(mg/kg)组别正常对照组模型组丹参酮治疗组- - 1 0 IL⁃1(pg/mL)停药7 d 62.08±15.61*125.42±23.90 89.83±13.23*停药14 d 62.17±13.73*135.25±23.71 109.91±19.39*TNF⁃α(pg/mL)停药7 d 165.01±37.76*414.83±36.21 260.76±24.39*停药14 d 167.38±34.00*418.29±26.31 332.41±70.84*PCⅢ(ng/mL)停药7 d 62.33±4.77*75.34±8.80 66.05±6.43*停药14 d 61.03±5.78*76.01±8.94 74.34±7.93 TGF⁃β1(ng/mL)停药7 d 42.95±4.08*59.75±9.68 48.93±5.96*停药14 d 43.77±3.67*61.73±9.21 59.29±9.18
炎症反应在ALI纤维化发生发展过程中具有重要意义,TL⁃1、TNF⁃α因子介导造成肺毛细血管内皮细胞及肺泡上皮细胞的损伤,从而导致肺纤维化的病理基础产生(肺毛细血管通透性增高、渗出大量富含蛋白质的肺泡液及透明膜形成等)。作为肺组织羟脯氨酸(HYP)主要的PCⅢ是机体胶原蛋白的主要成分之一,为胶原纤维所特有,是组织纤维化的标志物,其含量的变化可作为衡量胶原组织代谢的重要指标,可判断纤维化的程度。TGF⁃β1在肺纤维化发病机制中起重要作用的,它对成纤维细胞具有促进有丝分裂和促趋化作用,增加细胞外基质蛋白质的合成,抑制基质降解酶的生成,在正常修复过程中亚型TGF⁃β1的分泌是对纤维化强有力的效应剂,仅在它持续或过分表达时将会导致病理性的纤维增殖[7-9]。本实验发现在油酸诱导的ALI纤维化模型中 IL⁃1、TNF⁃α、PCⅢ和TGF⁃β1大量表达,这与其他文献的研究结果相吻合,经丹参酮Ⅱ⁃A磺酸钠治疗后其水平显著降低,其中PCⅢ、TGF⁃β1因子水平接近正常对照组水平,揭示丹参酮Ⅱ⁃A磺酸钠对ALI纤维化模型具有治疗保护作用,该治疗保护作用与调节上述4个因子水平的表达有关,并分别从3个方面进行保护调节:(1)直接减少细胞因子IL⁃1、TNF⁃α的产生;(2)通过降低PCⅢ减少细胞外基质的胶原蛋白沉积,从而达到防治急性肺损伤纤维化的作用;(3)可能通过抑制TGF⁃β1的持续或过分表达,导致病理性的纤维化减轻。但本研究尚不能说明在ALI模型纤维化发生发展中究竟涉及何种调节机制和信号通路,这有待在后期实验做进一步的研究。
综上所述,本研究表明丹参酮Ⅱ⁃A磺酸钠对大鼠油酸型ALI模型纤维化有一定治疗作用,其作用机制可能与丹参酮Ⅱ⁃A磺酸钠具有调节IL⁃1、TNF⁃α、PCⅢ和TGF⁃β1等细胞因子的表达水平有关。但其对因子水平调节机制和对信号通路的影响需做更进一步的研究。
[1]朱瑞芳,周敏,何建林,等.姜黄素对大鼠油酸型急性肺损伤的保护作用[J].中国中药杂志,2008,33(17):2141⁃2145.
[2]BULMUS F G,GÜRSU M F,MUZ M H,et al.Protective effects of alpha⁃lipoic Acid on oleic Acid⁃induced acute lung in⁃jury in rats[J].Balkan Med J,2013,30(3):309⁃314.
[3]INOUE H,NAKAGAWA Y,IKEMURA M,et al.Molecular⁃biological analysis of acute lung injury(ALI)induced by heat exposure and/or intravenous administration of oleic acid[J].Leg Med(Tokyo),2012 ,14(6):304⁃308.
[4]陆月明.油酸致急性肺损伤动物模型析评[J].中华急性医学杂志,2005,14(1):81⁃83.
[5]郑雪松,汪蓉,彭吉霞,等.丹参酮ⅡA磺酸钠联合吲哚布芬对心源性脑栓塞血液流变学的影响[J].实用药物与临床,2016,19(1):26⁃29.
[6]雷尚芳,白娜,鲍升娟,等.丹参酮ⅡA磺酸钠治疗先天性人巨细胞病毒性肝炎小鼠的实验研究[J].实用药物与临床,2016,19(1):10⁃13.
[7]ABD⁃ALLAH S H,SHALABY S M,ABD⁃ELBARY E,et al.Human peripheral blood CD34+cells attenuate oleic acid⁃in⁃duced acute lung injury in rats[J].Cytotherapy,2015,17(4):443⁃453.
[8]SALMAN A E,YETISIR F,KILIC M,et al.The impact of pre⁃treatment with bolus dose of enteral glutamine on acute lung in⁃jury induced by oleic acid in rats[J].J Anesthesia,2014,28(3):354⁃362.
[9]HUANG B,WANG D X,DENG W.Protective effects of dexa⁃methasone on early acute lung injury induced by oleic acid in rats[J].Int J Clin Exp Med,2014,7(12):4698⁃4709.

