直肠癌患者KRAS基因突变和临床因素对术后预后的影响
杨冬阳 马冬 刘婉薇 赖晓嵘 黎莹 孟凡 李子俊 徐飞
广东省人民医院,广东省医学科学院肿瘤中心1胃肠肿瘤内科,2消化内科(广州510080)
近年来大肠癌在我国的发病率与病死率呈快速上升趋势,其中直肠癌发病年龄中位数在45岁左右。青年人发病率有升高的趋势,需引起足够的重视[1],手术是主要的治疗手段,但多数患者发现时已为中晚期,且晚期患者预后不佳,需探寻术后预后的影响因素,进一步指导治疗、改善预后。
目前对直肠癌术后预后的影响因素仍在探索中。有研究报道,大肠癌的发病可能与表皮生长因子受体(EGFR)信号的激活有关。原癌基因KRAS作为EGFR下游信号通路中重要的分子[2],已有临床研究证实KRAS突变可以持续激活下游Raf/Erk/Map激酶和其他信号通路来促进肿瘤细胞的浸润和转移。但KRAS突变的方式对直肠癌患者预后进程的影响目前仅有有限的资料和数据[3-5]。故我院对130例行直肠肿瘤切除术后的直肠癌患者的KRAS基因突变与手术预后及其他病理学因素之间的关系进行5年随访的分析,为术后直肠癌患者的预后影响因素寻找依据。
1 对象与方法
1.1研究对象收集我院2010年1-12月确诊直肠腺癌进行开腹或腹腔镜下直肠肿瘤手术切除的直肠癌患者130例,患者需符合根据结直肠癌诊疗规范(2010年版)确诊为直肠癌的患者;肿瘤病灶可行KRAS检测;PS评分<2;年龄≥18岁;性别不限。除外合并其他系统肿瘤;恶液质;妊娠或哺乳期妇女、育龄妇女拒绝接受避孕措施者;患者依从性差;预计生存期<3个月。纳入的130例患者中位年龄63岁,男92例,女38例。KRAS基因型:野生型85例,突变型45例;EGFR表达级别:EGFR⁃&+104例,EGFR++&+++26例;P53表达级别:P53⁃&+66例,P53++&+++64例;分化程度:低分化21例,中-高分化109例;TNM分期:Ⅰ期23例,Ⅱ期34例,Ⅲ期52例,Ⅳ期21例;发生多发转移:多发转移8例,其他转移13例和未转移109例;发生肝转移:肝转移5例,其他转移16例和未转移109例;发生肺转移:肺转移4例,其他转移17例和未转移109例;淋巴结转移:淋巴结转移数≤3的104例,淋巴结转移数>3的26例;详细情况见表1。直肠癌分期标准采用2009年修改的国际抗癌联盟(UICC)和美国肿瘤联合会(AJCC)联合制定的TNM分期法。
1.2实验方法
1.2.1实验试剂与仪器DNA提取试剂;TE缓冲液;检测基因型试剂盒:包含PCR反应、SAP反应、延伸反应等试剂;光学显微照相系统;ABI Veriti梯度PCR仪;凝胶成像分析系统。
1.2.2标本采集及处理于肿瘤病灶上提取癌组织,癌组织在固定标本并脱水透明后,进一步浸蜡包埋及切片,制成组织切片进行苏木精-伊红染色(HE染色),组织学诊断由本院2位病理学专家完成。EGFR、P53免疫组化结果无阳性染色为阴性(-);阳性细胞数少于10%为弱阳性(+);10% ~50%为阳性(++);>50%为强阳性(+++)。
1.2.3DNA提取和扩增本研究采用Goelz氏DNA提取方法对石蜡包埋组织进行DNA提取模板DNA。KRAS基因突变的检测方法采用目前公认的直接测序法[6]进行。NCBI基因数据库作为引物的参照方,在设定好的PCR仪上进行扩增反应,PCR扩增产物电泳后,在凝胶成像仪下观察记录结果。
1.2.4基因测序将PCR扩增产物通过纯化后,使用焦磷酸测序技术进行测序。
1.3统计学方法用SPSS 20.0软件统计分析。Kaplan⁃Meier法对比直肠癌手术患者生存与临床病理学因素关系。Log⁃rank检验分析作为显著性检验,对影响直肠癌生存的各种要因进行探讨。卡方检验法评价突变的KRAS基因与手术后患者临床病理学因素之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1基因分型KRAS为点突变,90%的KRAS基因突变位于2号外显子的第12和13密码子位点。入选的130例直肠癌患者中,共45例发生KRAS基因突变,突变率为34.6%,12密码子和13密码子有共同突变的频率为0%。其中12密码子突变和13密码子突变的频率分别为93.4%和6.6%。
2.2KRAS基因突变和直肠癌手术患者临床病理学因素的关系KRAS基因突变与EGFR更强的阳性表达、肿瘤的多发转移显著相关(P<0.05);与手术患者的其他病理学因素如P53、TNM分期、肿瘤分化程度、性别、年龄、肝脏转移、肺转移和其他淋巴结转移等临床病理学因素差异均无统计学意义。见表1。
2.3直肠癌患者预后相关因素分析130例患者追踪随访发现,至2016年1月,共71例患者生存,总的平均生存期为56.2个月,5年生存率为54.8%(图1)。Kaplan⁃Meier法单因素分析结果(表2)显示,野生型的KRAS基因患者手术后平均生存时间为57.5个月,突变型的KRAS基因患者手术后平均生存时间为58.9个月,差异无统计学意义(P>0.05,图2)。
其他临床病理学因素与手术预后生存期关系如下:TNM分期与患者预后相关,Ⅰ期患者平均生存时间为65.0个月,Ⅱ期患者平均生存时间为59.7个月,Ⅲ期患者平均生存时间为56.4个月,Ⅳ期患者平均生存时间为49.0个月,差异具有统计学意义(P<0.05,图3)。同时我们发现,癌细胞的转移对直肠癌患者的手术预后具有显著影响,Kaplan⁃Meier法单因素分析显示多发转移(P<0.05,图4)、肝转移(P< 0.05,图5)、肺转移(P<0.05,图6)与直肠癌患者预后不良关系密切。
3 讨论
KRAS基因不仅是细胞内信号转导的因素,也在EGFR信号通路转导中起重要作用。KRAS基因的突变可以诱导肿瘤细胞增殖、血管形成,诱导肿瘤细胞局部侵袭、远处转移,使正常EGFR信号通路的调控无法进行,KRAS基因突变在肠癌突变率为20%~60%[6]。有研究者认为,肠癌恶性肿瘤的KRAS基因突变具有预测预后的价值[7-12],也有学者认为KRAS基因突变对肠癌预后并无影响[13-17]。
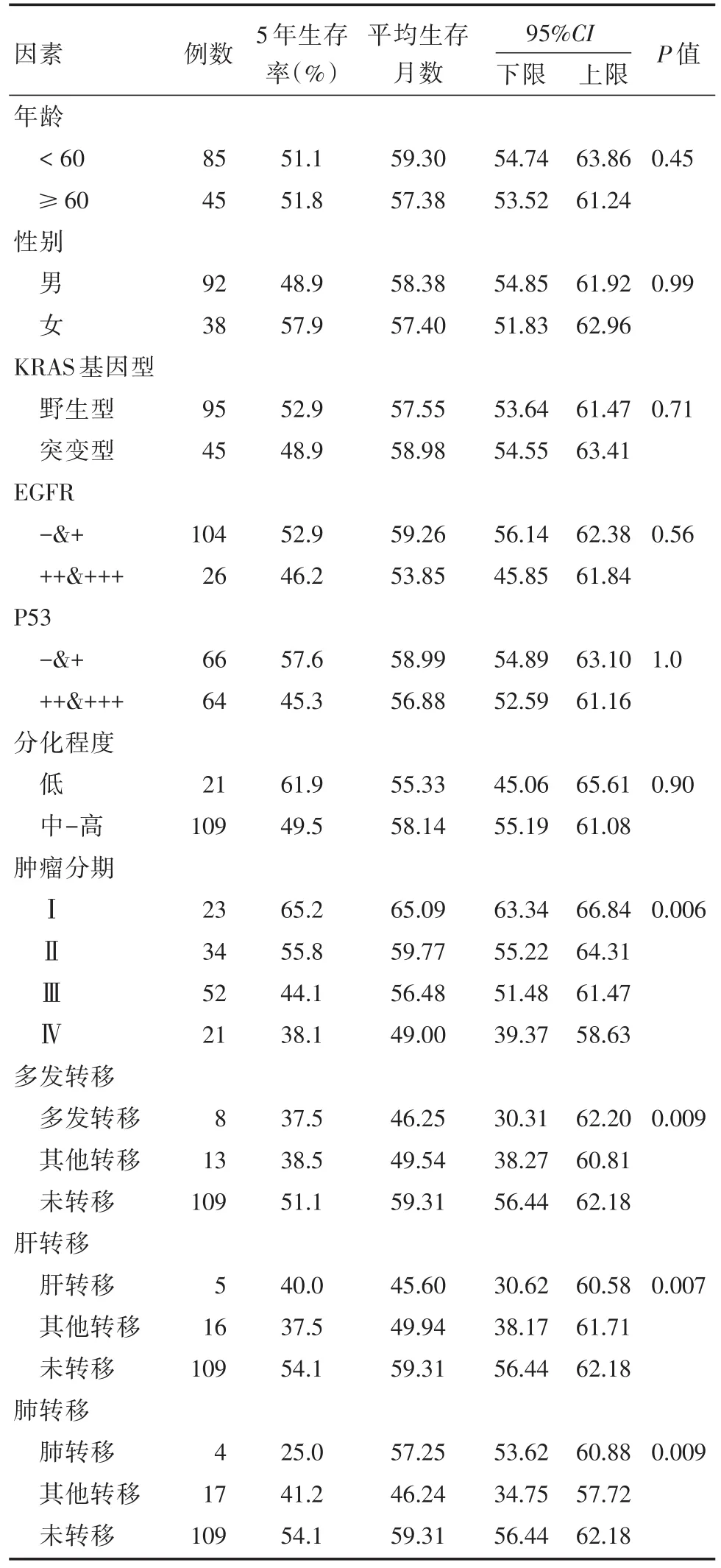
表2 直肠癌患者预后影响因素的Kaplan⁃Meier法单因素分析Tab.2 Kaplan⁃Meier analysis method of the single factor effect of patients with rectal cancer prognostic factors
本研究提示130例直肠癌术后患者KRAS突变率为34.6%,现阶段国际报道KRSA突变率为30% ~ 35%[8],较常见第12位密码子突变[18],提示中国直肠癌患者KRAS基因突变率和国际的类似。χ2检验提示KRAS基因突变与EGFR更强的阳性表达及直肠癌多发转移有关,发现直肠癌的多发转移和KRAS突变有关系,提示患者EGFR高表达和患者多发转移发生KRAS突变的几率更高。KRAS基因突变与其他病理学因素如P53表达、TNM分期、分化程度、淋巴结转移、性别、年龄等无相关。

图1 130例直肠癌患者的总体生存曲线 图2 KRAS不同基因型患者的总体生存曲线 图3 不同分期直肠癌患者总体生存曲线Fig.1 130 overall survival curves of with different genotypes Fig.2 The overall survival curves of KRAS patients patients with rectal cancer Fig.3 The overall survival curves of different Stages of colorectal cancer patients
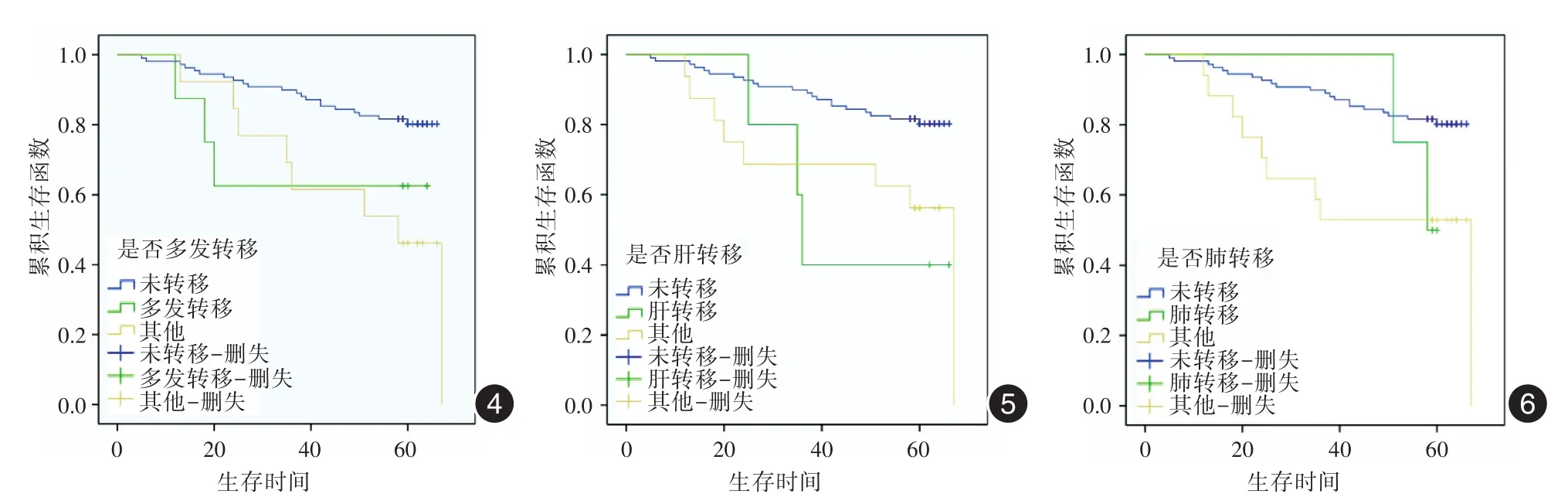
图4 是否有多发转移直肠癌患者的总体生存曲线 图5 是否有肝转移的直肠癌患者总体生存曲线 图6 是否有肺转移的直肠癌患者总体生存曲线Fig.4 The overall survival curve of patients with multiple metastatic colorectal cancer Fig.5 Whether patients with rectal cancer survival curve of liver metastasis Fig.6 Whether patients with rectal cancer survival curve of lung metastasis
进一步单变量统计分析提示野生型KRAS基因患者的预后对比突变型KRAS基因患者的预后,两者的总体生存无明显差异。一个肠癌的研究[13]中认为KRAS基因突变并不对肠癌患者预后有预测价值,其他KRAS基因突变的回顾性临床研究[14-17]也得出了相似的结论。但是目前的主流观点[7-12]仍然是KRAS基因突变对肠癌患者的预后存在一定的影响。
然而,目前学术界对上述两种不同的观点的争论存在另外一种看法,有学者认为,KRAS基因突变率的检测率易受到环境因素、检测方法的特异性和敏感性、样本量的多少等的影响[19],这些因素都会影响KRAS基因突变率的最终结果。本研究认为可能与以下原因有关:研究群体的异质性,如早期病例的研究人群较少;KRAS基因突变的检测方法的局限性,KRAS野生型患者用直接测序法进行检测易获得假阴性结果;KRAS突变的量(突变丰度)的不同对患者的预后产生影响[20],在低灵敏度的方法检测下,突变丰度低的患者被检测为野生型,导致结果的不准确。
另外,2013年的欧洲癌症大会上德国肿瘤医学协会合作调查小组认为,仅仅检测KRAS基因的突变是不足以用于进行肠癌患者的关键治疗策略的抉择的。目前,最新的进展认为,进行KRAS、BRAF、NRAS的全面检测,对判断治疗及对预后的影响分析是更有益的[21],受限于2010年的检测手段,当时检测选择仅限KRAS。
进一步分析发现我们的研究群体主要是行肿瘤切除手术后的患者,与既往大部分的研究有比较大的区别,该群体的身体状况、耐受性、可预期寿命可能更长,故患者的存活时间均比较长。尤其对于晚期患者,我们发现这类患者在进行直肠癌手术治疗后,总体的生存期得到较好的体现,提示晚期患者能进行直肠癌的手术治疗可能的获益及预后的判断,也有研究认为,在提高患者生存率及生存时间上,行肿瘤切除手术往往比单纯化疗更有效[9]。进一步分析患者的其他病理学因素与手术预后的关系发现,肿瘤TNM分期和肿瘤的转移部位多发转移、肝转移、肺转移与直肠癌患者预后不良关系密切。
综上所述,KRAS基因突变与EGFR更强的阳性表达和肿瘤的多发转移有关,TNM高分期,转移部位影响手术预后,Ⅳ期患者直肠癌手术切除后有提高生存趋势,KRAS基因突变对于直肠癌患者手术预后的关系尚不明确,我们须进一步扩大样本量,改进KRAS基因突变的检测方法,使用合适的方法进行全RAS的检测,进一步进行研究。
[1]LIU S Z,ZHENG R S,ZHANG M ,et al.Incidence and mortali⁃ty of colorectal cancer in China,2011[J].Chinese J Cancer Res,2015,27(1):22⁃28.
[2]SZEWCZYK N J,PETERSON B K,JACOBSON L A,et al.Activation of Ras and the mitogen⁃activated protein kinase path⁃way promotes protein degradation in muscle cells of Caenorhab⁃ditis elegans[J].Mol Cell Biol,2002,22(12):4181⁃4188.
[3]ENGEL F B,HAUCK L,BOEHM M,et al.p21(CIP1)Con⁃trols proliferating cell nuclear antigen level in adult cardiomyo⁃cytes[J].Mol Cell Biol,2003,23(2):555⁃565.
[4]CHANG F M,STEELM S,MCCUBREY J A,et al.Raf⁃induced cell cycle progression in human TF⁃1 hematopoietic cells[J].Cell Cycle,2002,1(3):220⁃226.
[5]STEFANO A D,CARLOMAGNO C.Beyond KRAS:Predictive factors of the efficacy of anti⁃EGFR monoclonal antibodies in the treatment of metastatic colorectal cancer[J].World J Gas⁃troenterol,2014,20(29):9732⁃9743.
[6]ZHAO Y,MIYASHITA K,ANDO T,et al.Exclusive KRAS mu⁃tation in microsatellite⁃unstable human rectal carcinomas with sequence alterations in the DNA mismatch repair gene,MLH1[J].Gene,2008,423(2):188⁃193.
[7]SHEN H,YUAN Y,HU H G,et al.Clinical significance of K⁃ras and BRAF mutations in Chinese colorectal cancer patients[J].World J Gastroenterol,2011 ,17(6):809⁃816.
[8]RIBEIRO K B,RIBEIRO K B,FERES O,et al.A Phase Clin⁃ical⁃Pathological Correlation of KRAS Mutation Status in Meta⁃static Colorectal Adenocarcinoma[J].World J Oncol,2013,4(4⁃5):179⁃187.
[9]JEMAL A,SIEGEL R,XU J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277⁃300.
[10]刘影,郑细闰,朱亚珍,等.252例结直肠癌组织中KRAS、NRAS、BRAF、PIK3CA的基因突变分析[J].临床与实验病理学杂志,2016,32(8):851⁃855.
[11]严俊,许惠利,陈跃宇,等.KRAS基因突变与结直肠癌转移模式相关性的研究[J].现代肿瘤医学,2014,22(1):142⁃144.
[12]孙毅,艾尼瓦尔·艾木都拉,古丽比也·沙比尔,等.结直肠癌患者肿瘤组织中KRAS、BRAF基因突变观察及分析[J].山东医药,2014(43):8⁃11.
[13]ROTH A D,TEJPAR S,DELORENZI M,et al.Prognostic Role of KRAS and BRAF in Stage II and III Resected Colon Cancer:Results of the Translational Study on the PETACC⁃3,EORTC 40993,SAKK 60⁃00 Trial[J].J Clin Oncol,2010,28(3):466⁃474.
[14]BOUZOURENE H,GERVAZ P,CEROTTINI J P,et al.p53 and Ki⁃ras as prognostic factors for Dukes′stage B colorectal cancer⁃European Journal of Cancer[J].Eur J Cancer,2000,36(8):1008⁃1015.
[15]GONZÁLEZAGUILERA J J,OLIART S,AZCOITA M M ,et al.Simultaneous mutations in K⁃ras and TP53 are indicative of poor prognosis in sporadi crectal cancer[J].Am J Clin Oncol,2004,27(27):39⁃45.
[16]郭桂芳,夏良平,徐瑞华,等.西妥昔单抗联合化疗治疗晚期结直肠癌的生存分析及KRAS对疗效的影响[J].中山大学学报(医学科学版),2011(5):637⁃643.
[17]AKMAN T ,OZTOP I,BASKIN Y ,et al.The association of clinicopathological features and survival in rectalcancer patients with kras mutation status[J].J Cancer Res Ther,2016,12(1):96⁃102.
[18]JADDA H,FAHIME E E,KETTANI F,et al.A simple meth⁃od for detection of KRAS and BRAF hotspots mutations in pa⁃tients with colorectal cancer[J].Int J Pharm Pract Phar,2014,6(2):448⁃452.
[19]BAZAN V,MIGLIAVACCA M ,ZANNA I,et al.Specific co⁃don 13 K⁃ras mutations are predictive of clinical outcome in rec⁃talcancer patients,whereas codon 12 K⁃ras mutations are asso⁃ciated with mucinous histotype[J].Ann Oncol,2002,13(9):1438⁃1446.
[20]XU M,RHEE S Y.Becoming data⁃savvy in a big⁃data world[J].Trends Plant,2014,19(10):619⁃622.
[21]张科平,许洁,颜黎栩,等.结直肠癌患者KRAS、NRAS及BRAF基因突变检测分析[J].中华病理学杂志,2015(4):254⁃257.

