异丙酚影响基质金属蛋白酶对肺腺癌细胞株增殖侵袭能力的作用
张永强 刘俊 陈胜阳 刘国泽 田建民 岳修勤
新乡医学院第一附属医院麻醉科(河南新乡 453100)
目前,临床上针对肺癌的常规治疗包括手术、药物及放化疗等手段,虽有一定效果,但由于肺癌细胞株增殖快,易侵袭转移等原因效果不甚理想[1-2],治疗方向最终要回归到早期药物阻断,以尽可能减缓病情进展。因此,寻求一种安全有效的肺癌治疗方案用以降低肺癌患者发病率和病死率已经成为目前临床亟需解决的难题。早先叶慧瑾等[3]提出异丙酚确有抑制肺癌细胞侵袭的能力,主要通过下调水通道蛋白3及基质金属蛋白酶(matrix metalloproteinases,MMPs)得以实现;最新研究显示MMP⁃2亦参与了异丙酚影响肺癌细胞株的调控过程[4-6],但研究尚未深入。剂量反应关系值的进一步分析,反应机制的探讨极有必要。因此,笔者通过分析不同浓度异丙酚通过影响基质金属蛋白酶进而抑制肺癌细胞株增殖侵袭能力的差异,探究异丙酚与肺癌细胞株增殖侵袭能力的剂量效应关系及其作用机制,为下一步异丙酚广泛应用于肺癌的辅助治疗提供依据。
1 材料与方法
1.1实验材料及仪器肺癌细胞株A549购于武汉大学生命科学院培养物保藏中心;RPMI1640培养基、胎牛血清为美国Hyclone公司产品;胰蛋白酶、异丙酚(批号:1001741585)及DMSO(批号:D2711)购于Sigma公司;Transwell小室及细胞计数试剂盒(CCK⁃8)购于美国Santa Cruz公司;兔抗人基质金属蛋白酶9(MMP⁃2)单克隆抗体、辣根过氧化物酶标记羊抗兔二抗购于杭州瑞晶有限公司;逆转录试剂盒及总RNA提取试剂盒购于上海碧云天生物技术研究所;Multiskan Spectrum全波长酶标仪、蛋白印迹系列仪器以及荧光定量PCR仪为美国RioRad公司产品。
1.2细胞培养将肺癌细胞株A549接种于RP⁃MI1640培养基(100 μg/mL青霉素和链霉素+10%胎牛血清)中,并置于恒温密闭培养箱进行培养,密切观察细胞株状态,80%细胞贴壁融合时,采用0.25%胰蛋白酶对细胞进行消化传代,并取处于对数生长期的细胞施行后续实验操作。
1.3细胞处理及分组配制异丙酚溶液:母液采用DMSO溶解异丙酚配制,浓度为120 μmol/L,经预实验筛选后,实验选取浓度为:60、100、120 μmol/L。以0 μmol/L异丙酚、相同体积浓度DMSO的肺癌细胞作为对照组,根据浓度高低分为L组、M组、H组。
1.4细胞后续处理细胞后续处理转染MMP⁃2沉默腺病毒载体,MMP⁃2沉默的腺病毒载体构建由晨光生物科技有限公司完成;siRNA干扰MMP⁃2腺病毒序列设计为 5′⁃CCGGGCTGAAGGACACAC⁃TAAAGAACTCGAGTTCTTTAGTGTGTCCTTCAGCT⁃TTTTG⁃3′;感染24 h后加药筛选稳转细胞,置于细胞培养箱中继续培养。
1.5CCK⁃8检测肺癌细胞株增殖状况取处于对数生长期的上述四组细胞置于96孔板中,每孔配置约100 μL细胞悬液置于培养箱内,加入CCK⁃8溶液,分别培养24、48、72 h,于450 nm处采用全波长酶标仪测定个组在不同异丙酚浓度下的观密度(OD)值。根据我们前期证实的MMP⁃2沉默的腺病毒载体转染最佳浓度和时间,将50 nmol/mL siRNA干扰MMP⁃2腺病毒和siRNA空病毒载体分别转染肺癌细胞,继续培养48 h再次以CCK⁃8法测定各处理组细胞的OD值。实验重复3次,取8孔计算平均值,以浓度为横坐标,各组OD值为纵坐标绘制曲线,再次观察四组细胞增殖情况。细胞活力(%)=[A(加药)-A(空白)]/[A(未加药)-A(空白)]×100。
1.6Transwell实验当各组细胞融合至80%左右时,将细胞置于无血清培养基中,饥饿处理12 h,而后继续培养。将0.05 g/L的Mataigel基质胶按1∶8的比例稀释,稀释后的matrigel胶均匀铺在Transwell小室膜上;小室的下室中RPMI 1640培养基。取出Transwell上室,用棉签擦去PVPF膜靠近小室内面的细胞后,无水甲醇常温固定30 min,0.1%结晶紫染色20 min,于400倍显微镜下随机记数5个视野的细胞数,计算细胞侵袭抑制率,计算公式为:(1⁃侵袭组细胞数/对照组细胞数)×100%。此后,siRNA干扰MMP⁃2,步骤同上,转染后24 h,再次检测各组细胞侵袭抑制率。
1.7实时荧光定量PCR法检测不同处理浓度下各组mRNA含量Trizol试剂裂解细胞,将裂解液转移至离心管后加入氯仿。提取上层的RNA,加入等体积异丙醇,混匀后离心10 min。收集沉淀,经逆转录合成cDNA。内参基因为GAPDH,反应条件为98℃ 3 min;98℃ 30 s,60℃ 30 s,72℃ 1 min(35个循环);72℃10 min。分别检测内参基因和各组目的基因的Ct值,采用公式2-△△CT计算目的基因的相对表达量,实验重复3次。本实验中,内参基因及目的基因引物序列如表1。
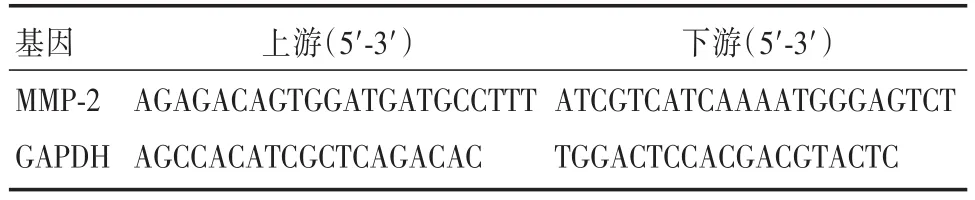
表1 目标基因引物序列Tab.1 Prime sequence of real time fluorescent quantitative PCR
1.8Western blot检测各组MMP⁃2蛋白含量取对数生长期肺癌细胞株,RIPA蛋白裂解液提取细胞总蛋白,加入上样缓冲液(1∶4)后煮沸5 min,冷却至室温后装入EP管冷冻保存;SDS⁃PAGE凝胶电泳后转膜,封闭1 h;加入一抗稀释液(1∶1 000),4 ℃过夜孵育;次日洗膜,加入二抗,于37℃恒温孵育1.5 h。以GAPDH蛋白为对照,化学发光法(ECL)检测条带,试验重复3次。
1.9统计学方法采用SPSS 20.0统计软件进行统计学分析,采用重复测量方差分析比较不同药物浓度组的细胞增殖活性以及沉默MMP⁃2基因后各组的细胞活性差异;单因素方差分析各组细胞侵袭抑制率的差异以及沉默MMP⁃2基因后的变化,两组间差异比较采用SNK⁃q检验;分析各组癌细胞中MMP⁃2蛋白及mRNA的表达水平,探究异丙酚浓度与MMP⁃2基因表达产物的关系。
2 结果
2.1异丙酚对肺癌细胞株增殖的影响CCK⁃8法检测结果显示,细胞培养第24、48及72 h后,与实验对照组相比,M组和H组增殖活性显著降低,差异有统计学意义(P<0.05),其中H组在上述各时间节点下的增值活性最低(P<0.05);组间比较可知,H组增殖活性低于M组(FM⁃H=9.382,PM⁃H=0.000),而 M 组则低于 L 组(FM⁃L=7.468,PM⁃L=0.000),见表2。
2.2沉默MMP⁃2后,各组肺癌细胞增殖活性比较沉默MMP⁃2基因,培养40 h后,以转染了siRNA空白载体的4组作为对照,再次推算其细胞活性大小,结果显示:siRNA干扰MMP⁃2细胞表达后,各组细胞活性值均较MMP⁃2未沉默组明显下降(P<0.05),此时异丙酚抑制肺癌细胞增殖的作用明显加强,见图1。
表2 不同时间点下各组细胞增殖活性的比较Tab.2 Comparison of four groups of proliferation activity at different times ±s
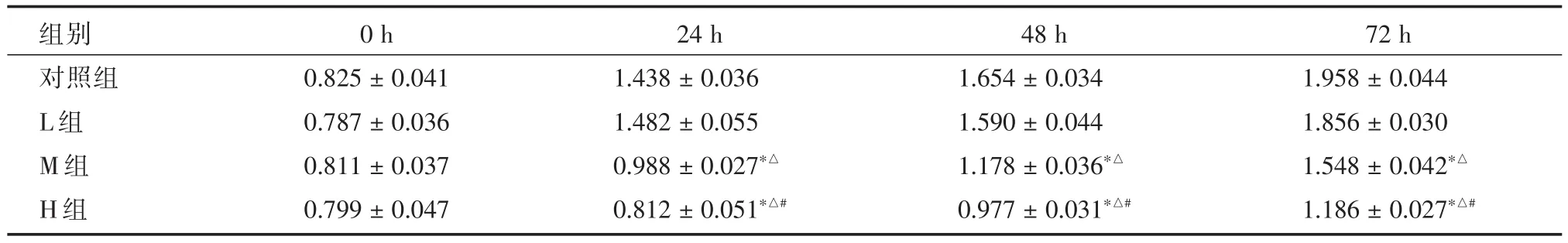
表2 不同时间点下各组细胞增殖活性的比较Tab.2 Comparison of four groups of proliferation activity at different times ±s
注:FM-L=7.468,PM-L=0.000;FM-H=9.382,PM-H=0.000;与对照组相比,*P < 0.05;与L组相比,ΔP <0.05;与M组相比,#P < 0.05
组别对照组L组M组H组0 h 0.825±0.041 0.787±0.036 0.811±0.037 0.799±0.047 24 h 1.438±0.036 1.482±0.055 0.988±0.027*△0.812 ± 0.051*△#48 h 1.654±0.034 1.590±0.044 1.178±0.036*△0.977 ± 0.031*△#72 h 1.958±0.044 1.856±0.030 1.548±0.042*△1.186 ± 0.027*△#
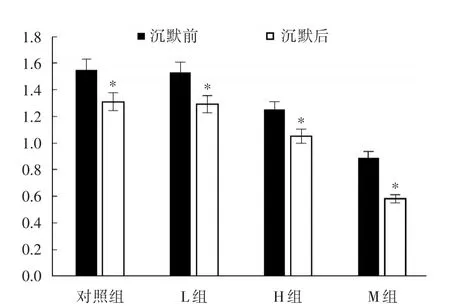
图1 沉默MMP⁃2后各组肺癌细胞增殖活性的比较Fig.1 Comparison of proliferation activity of lung cancer cells in each group after silencing MMP⁃2
2.3不同浓度异丙酚对肺癌细胞株侵袭抑制率的影响Transwell侵袭实验结果如下:相比于对照组细胞侵袭抑制率,H组侵袭抑制率为39.8%(t=12.189,P=0.000),M组为18.5%(t=9.563,P=0.000),L组为3.2%(t=4.052,P=0.003),差异均具有统计学意义;L、M、H组相比,L组低于M组、H组,差异均具有统计学意义(P<0.05);而对照组和L组的细胞侵袭抑制率相比,差异无统计学意义(t=0.940,P=0.357),见图2。沉默MMP⁃2基因后,Transwell侵袭实验结果如下:相比于转染空病毒载体的各浓度组,沉默后每组的侵袭抑制率均明显上升,其中,对照组的侵袭抑制率为3.6%(t=4.175,P=0.022)、H 组为 63.2%(t=8.533,P=0.000),M 组为 31.9%(t=5.026,P=0.003)、L组为6.8%(t=3.541,P=0.032),差异均具有统计学意义,见图3。
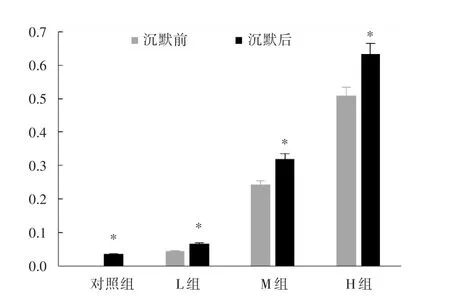
图3 沉默MMP⁃2后各组肺癌细胞侵袭抑制率的差异Fig.3 Comparison of invasive inhibitory rate of lung cancer cells in each group after silencing MMP⁃2
2.4不同浓度异丙酚对癌细胞MMP⁃2表达产物的影响PCR及Western blot试验结果提示:M组(t=4.386,P=0.017)、H组(t=6.947,P=0.000)癌细胞的MMP⁃2表达产物含量均低于对照组,差异具有统计学意义;对比L、M和H三组细胞MMP⁃2表达产物的变化可知,L组癌细胞的MMP⁃2表达产物含量最高,而H组相对最低,见图4。
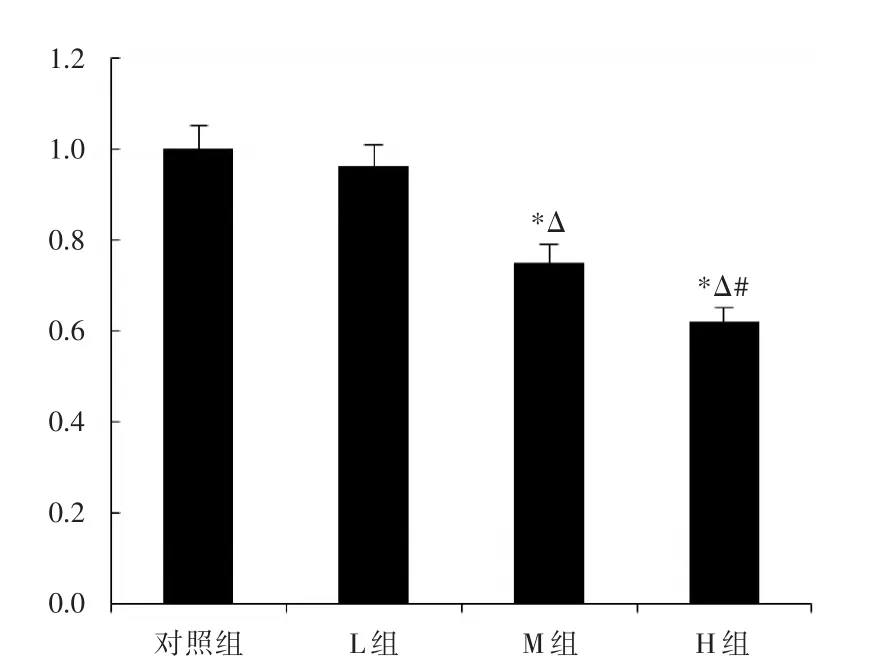
图4 异丙酚浓度对肺癌细胞MMP⁃2相对mRNA含量的影响Fig.4 MMP⁃2 mRNA expression level in different concentration group(compared with control group)
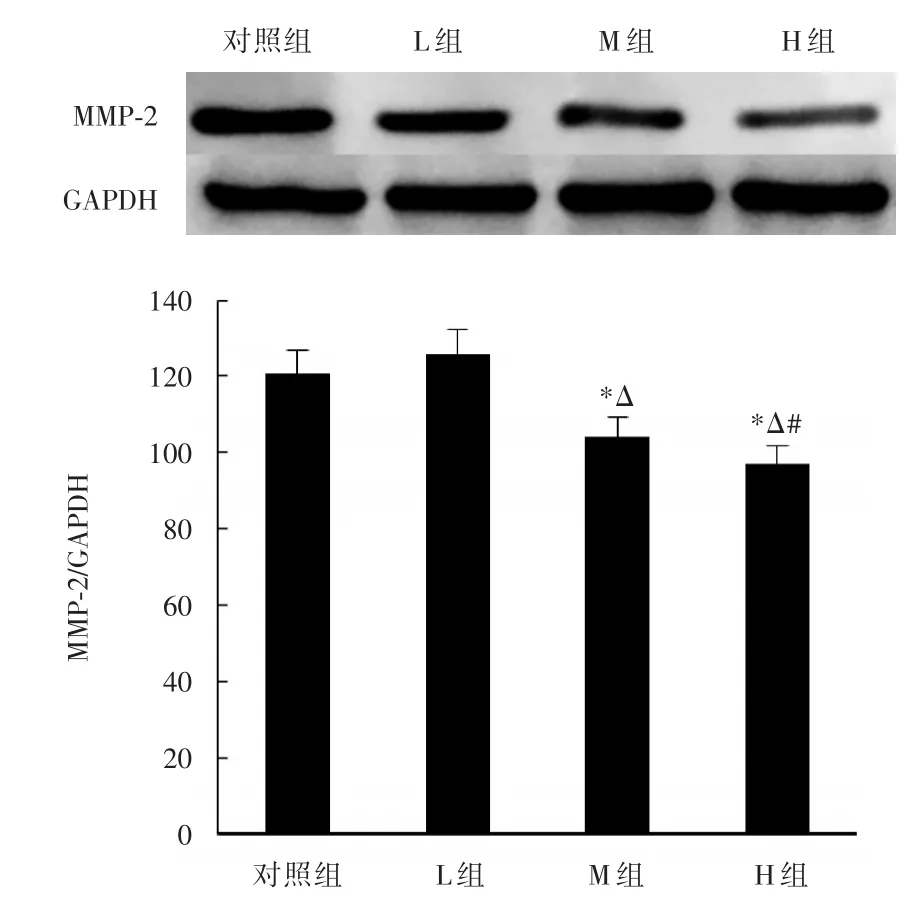
图5 异丙酚浓度对肺癌细胞MMP⁃2蛋白含量的影响Fig.5 MMP⁃2 protein expression level in different concentration group
3 讨论
多项研究表明,异丙酚具有调节PI3k/Akt信号通路进而下调MMP⁃2减弱癌细胞的增殖转移能力[7],MMP⁃2 是目前 MMPs中研究较多的两个成员,其能降解ECM的蛋白成分,在抑制肿瘤侵袭转移中起关键性作用,其转录表达产物与肿瘤进展存在一定关联[8-9],故异丙酚可能具有抑制肿瘤的作用且此作用与MMP⁃2相关。而目前对于肺癌肿瘤的抑制效果研究甚少,尚未达成广泛共识。因此,笔者研究了不同浓度异丙酚对肺癌细胞株增殖的影响,并分析了该作用机制与MMP⁃2的关联,以进一步探究异丙酚用于治疗肺癌患者的临床价值。
肺癌细胞由于其独特的病理特征和生物学行为,使得细胞增殖速度快,且恶性程度较高[10-11]。在基础实验研究中,通常采用光密度值来反映细胞增殖活性。本次研究中,运用了CCK⁃8法检测不同浓度异丙酚作用下,肺癌细胞增殖活性以及组间差异。结果如下:异丙酚处理后各浓度组癌细胞光密度值均有所下降,提示异丙酚对于肺癌细胞的增殖存在一定的抑制作用。进一步比较不同浓度异丙酚作用下肺癌细胞光密度的差异,笔者发现肺癌细胞的活力与异丙酚浓度存在一定联系,H组的细胞活性显著低于L组和M组,而M组的细胞活性同样显著低于L组,这一结果提示,异丙酚对于肺癌细胞增殖作用可能与其浓度相关,两者间可能存在剂量依赖关系[12-13]。笔者进一步探究后发现,MMP⁃2基因表达下调后,与转染空白载体的各组相比,沉默基因后各组细胞增殖活性均明显下降,且浓度越高,下降越显著;此现象提示MMP⁃2基因可能参与了异丙酚抑制肺癌细胞增殖的过程。国外学者CHETTY等[14]在研究中提示MMP⁃2通过下调VEGF抑制肺腺癌细胞的增殖,此作用受经典信号通路PI3k/Akt的影响。同时,学者张静等[15]人亦发现,异丙酚能促进人肺癌细胞凋亡,在此过程中,Caspase⁃3表达上调,MMP⁃2表达下调。二者结论均与本研究一致,异丙酚调控肺腺癌细胞株增殖活性的能力与MMP⁃2基因息息相关。
本实验采用Transwell侵袭实验研究不同浓度异丙酚在沉默MMP⁃2基因后对于肺癌细胞侵袭抑制率影响的差异,结果如下:在沉默MMP⁃2基因前后,相比于实验对照组,M组和H组的肺癌细胞侵袭抑制率均明显上升,而L组与实验对照组相比,侵袭抑制率均变化并不明显,这一结果提示异丙酚可能减弱了肺癌细胞的侵袭能力。分析在沉默MMP⁃2基因前后不同异丙酚浓度组的侵袭抑制率可得知,H组侵袭抑制率均最高,而L组均最低,且沉默MMP⁃2基因后L、M及H组的侵袭抑制率均高于空白载体各组,这一结果提示,异丙酚对于肺癌细胞的侵袭抑制作用的大小可能与其浓度相关,并且此关联可能通过下调MMP⁃2基因的表达所致。同时,PCR及Western blot试验结果如下:经异丙酚处理并培养后,肺癌细胞MMP⁃2蛋白及mRNA相对含量均降低,且H组低于M组、L组,提示异丙酚可能影响MMP⁃2的表达,其抑制肺癌细胞的增殖效应可能是通过MMP⁃2产生。
综上,本次实验证实了异丙酚对于肺癌细胞的增殖以及侵袭能力的抑制作用,同时,此作用极有可能与MMP⁃2基因的下调有关。异丙酚作为抑制肺癌细胞增值侵袭的研究目标之一,具有潜在的临床治疗价值。
[1]陆晓,冼磊.TCF21基因对人肺癌A549细胞裸鼠成瘤的影响[J].实用医学杂志,2016,32(8):1226⁃1229.
[2]HERBST R S,BAAS P,KIM D W,et al.Pembrolizumab ver⁃sus docetaxel for previously treated,PD⁃L1⁃positive,advanced non⁃small⁃cell lung cancer(KEYNOTE⁃010):a randomised controlled trial[J].Lancet,2016,387(10027):1540.
[3]叶慧瑾,白建杰,郭培培,等.丙泊酚下调水通道蛋白3和基质金属蛋白酶⁃9表达抑制人肺癌A549细胞的侵袭力[J].南方医科大学学报,2016,36(9):1286⁃1290.
[4]DING L,LI Q J,YOU K Y,et al.The use of apatinib in treat⁃ing nonsmall⁃cell lung cancer:case report and review of litera⁃ture[J].Medicine,2016,95(20):e3598.
[5]WANG Q,WANG Q,WANG S F,et al.Oral Chinese herbal medicine as maintenance treatment after chemotherapy for ad⁃vanced non⁃small⁃cell lung cancer:a systematic review and me⁃ta⁃analysis[J].Curr Oncol,2017,24(4):e269.
[6]RECK M,RODRIGUEZ⁃ABREU D,ROBINSON A G,et al.Pembrolizumab versus Chemotherapy for PD⁃L1⁃Positive Non⁃Small⁃Cell Lung Cancer[J].N Engl J Med,2016,375(19):1823⁃1833.
[7]BARLESI F,MAZIERES J,MERLIO J P,et al.Routine mo⁃lecular profiling of patients with advanced non⁃small⁃cell lung cancer:results of a 1⁃year nationwide programme of the French Cooperative Thoracic Intergroup(IFCT)[J].Lancet,2016,387(10026):1415⁃1426.
[8]SHAW A T,GANDHI L,GADGEEL S,et al.Alectinib in ALK⁃positive,crizotinib⁃resistant,non⁃small⁃cell lung cancer:a single⁃group,multicentre,phase 2 trial[J].Lancet Oncol,2016,17(2):234⁃242.
[9]YANG N,LIANG Y,YANG P,et al.Propofol suppresses LPS⁃induced nuclear accumulation of HIF⁃1?± and tumor aggres⁃siveness in non⁃small cell lung cancer[J].Oncol Rep,2017,37(5):2611⁃2619.
[10]NIE W,GE H J,YANG X Q,et al.LncRNA⁃UCA1,exerts oncogenic functions in non⁃small cell lung cancer by targeting miR⁃193a⁃3p[J].Cancer Lett,2016,371(1):99⁃106.
[11]PARK K,TAN E H,O'BYRNE K,et al.Afatinib versus gefi⁃tinib as first⁃line treatment of patients with EGFR,mutation⁃positive non⁃small⁃cell lung cancer(LUX⁃Lung 7):a phase 2B,open⁃label,randomised controlled trial[J].Lancet Oncol,2016,17(5):577.
[12]WANG S,SHUNDONG C,LIU D.Third⁃generation inhibitors targetingEGFRT790M mutation in advanced non⁃small cell lung cancer[J].J Hematol Oncol,2016,9(1):34.
[13]LIN X,YANG Z,ZHANG P,et al.miR⁃154 inhibits migra⁃tion and invasion of human non⁃small cell lung cancer by target⁃ing ZEB2[J].Oncol Lett,2016,12(1):301⁃306.
[14]CHETTY C,LAKKA S S,BHOOPATHI P,et al.MMP⁃2 alters VEGF expression via αVβ3 integrin⁃mediated PI3K/AKT sig⁃naling in A549 lung cancer cells[J].Int J Cancer,2010,127(5):1081⁃1095.
[15]张静,申彦杰,梅虹霞,等.异丙酚对人肺癌A549细胞凋亡及侵袭力的影响[J].中华麻醉学杂志,2014,34(9):1079⁃1081.

