AKT抑制剂对结直肠癌肝转移患者肿瘤浸润T淋巴细胞生物学活性的影响
徐本玲 周进学 袁龙 陈广玉 韩露 秦鹏 高全立
郑州大学附属肿瘤医院1生物免疫治疗中心,2肝胆科,3普外科(郑州450008)
结直肠癌(colorectal cancer,CRC)是人类常见的恶性肿瘤,全球范围内肿瘤相关的病死率中结直肠癌处于第3位[1]。由于生活方式的转变,近年我国结直肠癌总体发病率呈上升趋势。虽然,CRC的诊断和治疗均取得了较快的发展,CRC的治疗仍然以外科手术为主,然而许多患者因早期症状不明显,就诊时已属中晚期,预后较差。研究表明,炎症相关的肿瘤微环境与CRC患者较好的预后相关,因此对于CRC患者来说,免疫治疗可能成为一种有效的新的治疗方法。肿瘤浸润淋巴细胞(TIL)具有特异性杀伤肿瘤细胞的功能。ROSENBERG等[2]利用TIL联合全身放化疗治疗恶性黑色素瘤,将其临床反应率提高到70%,明显延长了患者的生存期,获得了令人振奋的结果。研究[2-4]表明,恶性黑色素瘤患者对TIL的临床反应率与TIL细胞中记忆细胞的表达,及TIL在回输后能够在体内存在的时间长短有关。AKT抑制剂能够增加恶性黑素瘤患者TIL中记忆细胞的数量及在实验动物体内的持久性[5],但AKT抑制剂对TIL培养过程中免疫因素的影响尚无相关报道。
鉴于上述原因,本研究通过流式细胞学检测AKT抑制剂对CRC肝转移患者TIL增殖,分化及功能的影响,旨在探讨一种有效增强TIL细胞功能及延长其在体内存在的培养体系,从而为肝癌临床治疗提供新的思路及方法。
1 资料与方法
1.1一般资料选取2016年1月至2016年12月入住郑州大学附属肿瘤医院普外科行手术的结直肠癌肝转移患者的组织标本。本研究经郑州大学附属肿瘤医院医学伦理委员会批准实施,标本采集均征得患者本人同意并签署知情同意书。
1.2方法
1.2.1试剂重组人IL⁃2为山东泉港药业有限公司产品,RetroNectin,GT⁃T551无血清培养基(人淋巴细胞培养基),CD3MAb均为北京宝日医生物技术有限公司产品,抗 PD⁃1⁃FITC,抗 CD4⁃PerCP⁃cy5.5,抗CD4⁃FITC,抗Tim⁃3⁃PE,抗CD3⁃PEcy7,抗CD8⁃PerCP⁃cy5.5,抗 CD45RA⁃FITC,抗 CCR7⁃PEcy7,抗 CD25⁃APC,抗 FOXP3⁃PE,抗 Ki⁃67⁃PE,购自美国BIOLENG公司,抗IFN⁃γ⁃APC为eBiosci⁃ence产品。Elisa试剂盒(IFN⁃γ,IL⁃10,TNF⁃α)购自达科为生物技术有限公司。
1.2.2肿瘤组织的收集患者签署知情同意书后,于手术当中将切下的肿瘤组织放到事先准备好的含有庆大霉素(900 IU/mL),青霉素(500 IU/mL)和链霉素(500 μg/mL)的GTT⁃551无血清培养基中,立即送往实验室进行下一步的实验检测。
1.2.3TIL及肿瘤单细胞悬液的分离将肿瘤组织剪切成1~2 mm3的组织碎块,放入事先配好的胰蛋白酶混合液中(含胶原酶Ⅰ1 μg/mL,胶原酶Ⅳ1 μg/mL,DNase 25 μg/mL,含2%的胎牛血清),然后将细胞放入自动旋转仪上,置于37℃培养箱中,每30 min观察1次,根据组织的消化情况,终止反应(加入胎牛血清,其终浓度为5%)。采用不同percoll密度进行梯度离心,收集40%percoll表面的肿瘤细胞,放入事先准备好的冻存液中(含80%的DMSO和10%人AB血浆和10%1640培养液),立即放入-80℃低温冰箱备用。取40%和70%percoll中间白膜层的肿瘤浸润淋巴细胞,分成IL⁃2组(6 000 IU/mL)和AKT组(培养过程中加入1 μmol/mL 的AKT抑制剂和6 000 IU/mL的IL⁃2)进行培养。根据细胞培养情况,进行传代并计数。细胞培养至第10天,两组均加入抗CD3抗体,继续原培养液培养20 d。
1.2.4细胞增殖活性的测定每3天抽取培养孔中的TIL细胞1 mL,混匀,用胎盘蓝计数细胞总数,实验重复5次,计算平均值,根据细胞增殖倍数绘制生长曲线。
1.2.5细胞表型测定流式细胞学方法检测AKT抑制剂对TIL的数量、组成和比例的影响。每5天每组取2×106的细胞进行流式检测。分别吸取相应的荧光标记的特异性抗体各5 μL加入流式管,混合均匀,置于冰上避光孵育20 min。同时设各荧光减一同型对照管做对照。加2 mL FACS(含5%牛血清白蛋白和0.09%叠氮钠的磷酸盐缓冲液)洗涤,离心弃上清后,300 μL的FACS重悬细胞,涡旋混匀,避光待上机分析。细胞中IFN⁃γ(anti⁃IFN⁃γ⁃APC,eBioscience),Foxp3,Ki⁃67 的检测按照胞内染色说明书进行。应用FlowJo软件进行数据分析,记录阳性细胞比例。
1.2.6细胞因子的测定在培养过程中的第5、10、15、20、25、30天分别取培养两组的TIL细胞3 mL,以1 × 106/孔接种24孔板,培养24 h,收集上清检测细胞因子的分泌情况。操作严格按Elisa试剂盒说明书进行。
1.2.7细胞毒性T淋巴细胞分泌IFN⁃γ能力的检测取培养第25天的TIL和经射线辐照过的自体肿瘤细胞共培养6 h,加入自体肿瘤细胞后2 h加入BFA,继续培养4 h,胞内染色法比较两组分泌IFN⁃γ细胞的差异。
1.3统计学方法应用SPSS 19.0统计软件进行数据处理。计量资料采用平均数±标准差进行描述。组间比较采用t检验。所有实验均重复5次,所有检验均为双侧检验,P<0.05被认为差异具有统计学意义。
2 结果
2.1TIL细胞的增殖活性从结直肠癌肝转移患者的肿瘤组织中能够成功培养出TIL细胞。笔者首先分析了AKT抑制剂对TIL细胞增殖的影响。结果显示:IL⁃2组与AKT抑制剂组(AKTi组)相比,抗CD3抗体刺激前(第5、10天)和刺激后(第15、20、25、30天)各时间点细胞计数均无明显差异,见图1A。
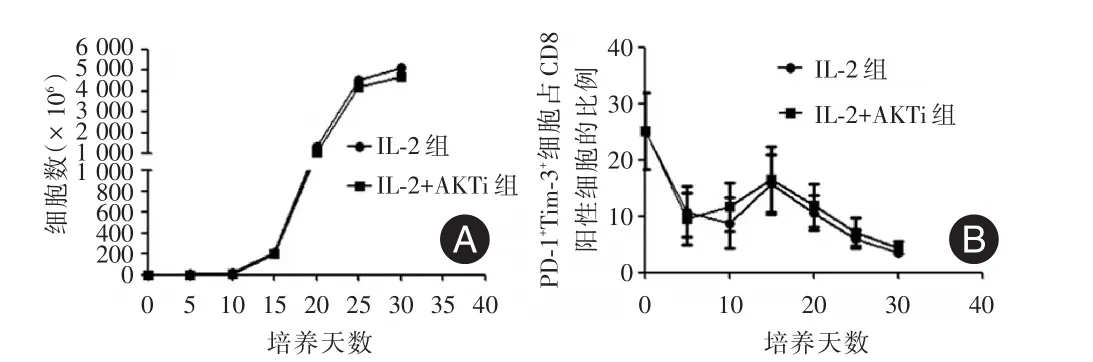
图1 IL⁃2组与AKTi组细胞生长曲线与PD⁃1+Tim⁃3+细胞的比较Fig.1 The growth curve and the expression of PD⁃1+Tim⁃3+on CD8+T cells in group IL⁃2 and AKTi
2.2TIL细胞的免疫表型PD⁃1及Tim⁃3共表达是T细胞耗竭的标志。动态检测AKT抑制剂对TIL的免疫表型结果显示:PD⁃1+Tim⁃3+的细胞占CD8+T细胞的比例在培养过程中先降低,在抗CD3抗体刺激后出现短暂上升,进而逐渐降低,但两组间比较并无明显差异。笔者的结果提示在培养过程中加入AKT抑制剂并没有增加PD⁃1+Tim⁃3+细胞占CD8+T细胞的比例见图1B。统计分析两组调节T细胞CD4+CD25+Foxp3+占CD3+T细胞的比例,结果亦无明显差异。
从培养的第5天起,AKT抑制剂组CD8+T细胞上中心记忆T细胞(Tcm,CCR7+CD45RA-)的比例明显增高(13.98%vs.9.14%,P<0.05),这种趋势一直持续到抗CD3抗体刺激后。培养至第25天(抗CD3抗体刺激后第15天)时,AKT抑制剂组CD8+T细胞上中心记忆T细胞(Tcm)的比例最高,见图2。
2.3TIL细胞上清中细胞因子的含量分别取各组培养第5、10、15、20、25和30天的培养上清,用Elisa细胞因子检测试剂盒进行 IFN⁃γ,TNF⁃α和IL⁃10的检测。结果显示,IFN⁃γ和TNF⁃α随着培养时间的延长,分泌量逐渐升高,且AKT抑制剂组IFN⁃γ的分泌量明显高于IL⁃2组。IL⁃10的分泌量虽亦逐渐增加,但两组比较无明显差异,见图3。
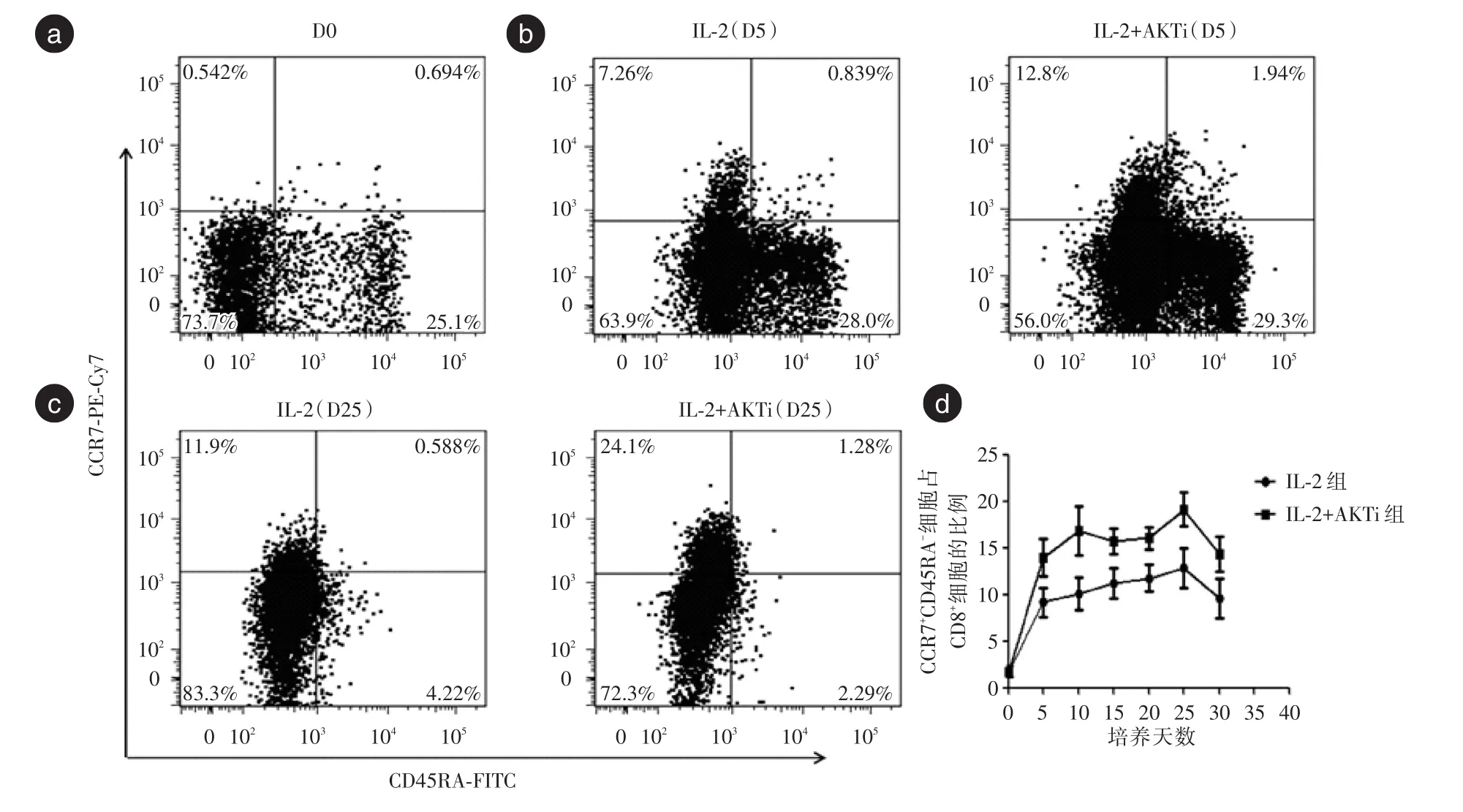
图2 IL⁃2组与AKTi组细胞Tcm的比较Fig.2 The expression of Tcm on CD8+T cells in group IL⁃2 and AKTi
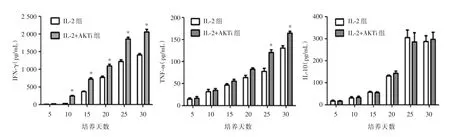
图3 IL⁃2组与AKTi组不同时间点IFN⁃γ,TNF⁃α及IL⁃10的分泌情况Fig.3 The secretion profile of IFN⁃γ,TNF⁃α and IL⁃10 on CD8+T cells at different time point in group IL⁃2 and AKTi
2.4细胞毒性T淋巴细胞分泌IFN⁃γ能力的检测因为培养第25天时,细胞的数量及Tcm的含量均较高,进而我们取培养第25天的TIL细胞用自体肿瘤细胞检测了TIL中细胞毒性T淋巴细胞分泌IFN⁃γ能力的差异。结果显示:AKT抑制剂组分泌IFN⁃γ的细胞的比例明显高于IL⁃2组(P< 0.05),代表性的流式图见图4。
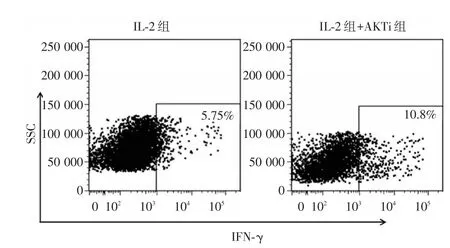
图4 自体肿瘤细胞刺激两组TIL中细胞毒性T淋巴细胞分泌IFN⁃γ能力的代表性的流式图Fig.4 A representative flow diagram of IFN⁃gamma stimulated by auto⁃tumor cells in cytotoxic T lymphocyte of TIL in group IL⁃2 and AKTi
3 讨论
TIL治疗的临床反应率与TIL细胞中记忆细胞的表达,及其回输后在体内存在的时间长短有关。越来越多的研究结果提示如果回输的TIL中含有较多的记忆细胞,会延长TIL回输后在体内的存活率,进而提高其治疗效率[6]。这一观点进一步在小鼠动物模型中得到证实,随着TIL细胞逐渐分化成终末分化的T细胞,其抗肿瘤功能及在体内持续存在的能力均减低[7]。因此,如果能够提高TIL中免疫记忆细胞的数量,可能会增强TIL的抗肿瘤免疫效能,成为进展期肿瘤的有效治疗手段。
PI3K/Akt/mTOR信号通路在CD8+T细胞分化及记忆形成中发挥重要作用。AKT信号的丢失或减弱不会影响T细胞的增殖及活性,但会导致已分化的细胞毒性T淋巴细胞的转录重排,使效应细胞转化成记忆细胞[8]。本研究结果也表明从结直肠癌肝转移的肿瘤组织中分离的浸润的T淋巴细胞,在培养过程中加入AKT抑制剂,无论是在抗CD3抗体刺激前还是在抗CD3抗体刺激后,CD8+T淋巴细胞上的Tcm均高于IL⁃2组。由于过继细胞免疫治疗的效果,不仅取决于回输的细胞的质量,而且回输的细胞的数量也非常重要。因此,本研究还对AKT抑制剂对TIL的增殖能力的影响进行了检测,结果显示,两组TIL的增殖能力并无明显差异。这一结果与文献报道的AKT抑制剂在增加恶性黑色素瘤浸润的T淋巴细胞中记忆细胞的扩增而并不影响其增殖能力的结果一致[5]。
PD⁃1不仅是细胞活化的标志,还是细胞免疫因子,当PD⁃1和Tim⁃3共表达时,往往提示细胞的功能障碍[10]。笔者进一步分析了AKT抑制剂对TIL细胞免疫表型的影响,结果显示:PD⁃1+Tim⁃3+细胞的比例在抗CD3抗体刺激前逐渐降低,刺激后短暂升高,继而又逐渐减低,但两组比较并无明显差异。这可能是因为肿瘤组织中CD8+T细胞的PD⁃1+Tim⁃3+表达较高,但由于体外培养过程中脱离了肿瘤的微环境,比例逐渐下降,但在抗CD3抗体刺激后出现短暂升高继而下降的趋势,这与文献报道的细胞因子诱导的杀伤细胞在体外培养过程的趋势一致[9]。调节T细胞的结果显示,AKT抑制剂的加入并未增加抑制性调节T细胞的数量。对比两组培养上清中细胞因子的分泌结果显示:随着时间的延长,IFN⁃γ的分泌量逐渐升高,且AKT抑制剂组明显高于IL⁃2组。IL⁃10最初被认为是具有免疫抑制作用的抗炎分子,近年来的研究发现IL⁃10还具有免疫活化作用,可以通过对T细胞的免疫活化作用促进肿瘤特异性免疫监视并减少致病性炎症反应的发生[11]。本研究结果显示IL⁃10及TNF⁃α随着培养时间的延长逐渐升高,这与MESIANO等[12]最近报道的动态监测CIK细胞上清中细胞因子的变化一致。进而笔者用自体肿瘤细胞刺激检测TIL中分泌IFN⁃γ的细胞,结果显示AKT抑制剂组分泌IFN⁃γ的细胞明显高于IL⁃2组,这与上清中检测到的结果一致。
综上所述,在传统培养TIL的体系中加入AKT抑制剂,能够增加其中心记忆T淋巴细胞的数量,增强其分泌IFN⁃γ的能力,且并不影响TIL的增殖,并未增加免疫抑制因子的数量,为TIL细胞的临床安全应用提供了很好的借鉴。
[1]ZHOU G,SPRENGERS D,BOOR P P C,et al.Antibodies against immune checkpoint molecules restore functions of tumor⁃infiltrating T cells in hepatocellular carcinomas[J].Gastroenter⁃ology,2017,153(4):1107-1119.
[2]ROSENBERG S A,YANG J C,SHERRY R M,et al.Durable complete responses in heavily pretreated patients with metastat⁃ic melanoma using T⁃cell transfer immunotherapy[J].Clin Can⁃cer Res,2011,17(13):4550⁃4557.
[3]RADVANYI L G,BERNATCHEZ C,ZHANG M,et al.Specif⁃ic lymphocyte subsets predict response to adoptive cell therapy using expanded autologous tumor⁃infiltrating lymphocytes in metastatic melanoma patients[J].Clin Cancer Res,2012,18(24):6758⁃6770.
[4]CHANDRAN S S,SOMERVILLE R P T,YANG J C,et al.Treatment of metastatic uveal melanoma with adoptive transfer of tumour⁃infiltrating lymphocytes:a single⁃centre,two⁃stage,single⁃arm,phase 2 study[J].Lancet Oncol,2017,18(6):792⁃802.
[5]CROMPTON J G,SUKUMAR M,ROYCHOUDHURI R,et al.Akt inhibition enhances expansion of potent tumor⁃specific lym⁃phocytes with memory cell characteristics[J].Cancer Res,2015,75(2):296⁃305.
[6]KLEBANOFF C A,GATTINONI L,PALMER D C,et al.De⁃terminants of successful CD8+T⁃cell adoptive immunotherapy for large established tumors in mice[J].Clin Cancer Res,2011,17(16):5343⁃5352.
[7]BAITSCH L,BAUMGAERTNER P,DEVEVRE E,et al.Ex⁃haustion of tumor⁃specific CD8 T cells in metastases from mela⁃noma patients[J].J Clin Invest,2011,121(6):2350⁃2360.
[8]MACINTYRE A N,FINLAY D,PRESTON G,et al.Protein kinase B controls transcriptional programs that direct cytotoxic T cell fate but is dispensable for T cell metabolism[J].Immu⁃nity,2011,34(2):224⁃236.
[9]ZHANG L,WANG J,WEI F,et al.Profling the dynamic ex⁃pression of checkpoint molecules on cytokine⁃induced killer cells from non⁃small⁃cell lung cancer patients[J].Oncotar⁃get,2016,7(28):43604⁃43615.
[10]XU B L,YUAN L,GAO Q L,et al.Circulating and tumor⁃in⁃filtrating tim ⁃3 in patients with colorectal cancer[J].Oncotar⁃get,2015,6(24):20592⁃20603.
[11]王佳丽,刘丽华.IL⁃10对肿瘤免疫双向调节的研究进展[J].中国肿瘤生物治疗杂志,2016,23(1):130⁃134.
[12]MESIANO G,ZINI R,MONTAGNER G,et al.Analytic and Dynamic secretory Profile of Patient⁃Derived Cytokine⁃induced Killer Cells[J].Mol Med,2017,23:235⁃246.

