大蒜素对大鼠冠状动脉微栓塞后心肌凋亡的影响
梁家宝 李浪 贺文慨
广西医科大学第一附属医院心脏病研究所(南宁 530021)
冠脉微栓塞(coronary microembolization,CME)是由于粥样斑块的损伤或破裂引起的一种病理现象,常常出现于急性冠脉综合征的患者中,也是经皮静脉支架术(percutaneous coronary intervention,PCI)的常见的并发症[1-2]。有研究[3]已经证明,CME能引发心功能障碍、恶性心律失常和心梗。同时现有的研究[4]表明,CME致心肌损伤使心肌凋亡增加。因此,抗凋亡被认为是减轻CME致心肌损伤的重要治疗手段。大蒜素主要来自于大蒜中,其主要成分为一种有机化合物——二烯丙基三硫化物(DATS)[5]。公认DATS可以用来预防和治疗多种疾病,目前多个研究[6]证实了其在抗肿瘤、抗动脉粥样硬化、抗糖尿病及抗氧化等方面的作用。但是DATS是否能够减轻CME所致的心肌凋亡以及相关机制仍未阐明。在本次研究中,首次发现大蒜素预处理能够减轻大鼠CME后的心肌细胞凋亡,并首次探讨了大蒜素预防CME致心肌凋亡的可能分子机制。
1 材料与方法
1.1材料
1.1.1主要试剂42 μm微栓塞球冻干粉(2×107个/g)(挪威Dynal公司);DATS(深圳Minn Bolin Biotechnology有限责任公司);兔抗鼠Akt、兔抗鼠Caspase⁃3单克隆抗体、兔抗鼠GAPDH单克隆抗体以及荧光山羊抗兔二抗(CST公司);Trizol、逆转录试剂盒与实时定量PCR试剂盒(日本Takara公司);cTnI ELISA试剂盒(上海科华生物工程股份有限公司)。
1.2方法
1.2.1实验动物分组及模型建立本研究于2016年12月开始,至2017年3月结束。首先取体重量200~250 g的成年SPF级SD大鼠共30只,雌雄不拘,随机分为单纯栓塞组(CME组)、大蒜素预处理组(DATS组)和假手术组(Sham组),每组各10只大鼠,购自广西医科大学实验动物中心。动物模型的建立参考自以往文献[7],简而言之,首先腹腔注射(10%水合氯醛2.5 mL/kg)麻醉大鼠,经口迅速插入气管导管,将气管导管连接动物呼吸机,观察大鼠胸廓起伏,确保气管导管已正确插入气管。然后逐层开胸暴露心脏及大血管,血管钳夹紧主动脉根部,经注射器由心尖部迅速注射微球0.1 mL(3× 104个/mL)至左心室,同时夹闭主动脉10 s,呼吸、心率正常后逐层关胸,待恢复自主呼吸后拔脱导管。另以等量生理盐水替代微球行左室注射的10只大鼠为假手术组(Sham组)。DATS组术前连续 7 d 给予 DATS 40 mg/(kg·d)腹腔注射。术后所有动物常规注射青霉素预防感染,术后6 h超声检查结束后处死大鼠并取材。各组实验动物的体重和心率比较,差异无统计学意义(P> 0.05)。
1.2.2大鼠心功能的检测分别于术后6 h检测大鼠心功能(LVEF、CO、FS和LVEDd),使用S12探头,探头频率为12 MHz每只大鼠重复测量3次,取其平均值。所有超声检查均由同一位经验丰富的心脏超声科医生完成。
1.2.3切片制备检测心功能后,经腹腔注入5 mL 10%水合氯醛麻醉大鼠,立即开胸取出心脏,去除心耳、心房,将心室分为左室心肌部和右室心肌部。左室心肌部用液氮速冻后转入-80℃冰箱保存,用于实时定量PCR与Western blot;右室心肌部用4%多聚甲醛固定,固定12 h后再予石蜡包埋,而后切片。采用光学显微镜观察HE染色后CME后心肌细胞状态,并予TUNEL染色检测心肌细胞凋亡。
1.2.4实时定量PCR定量测定Akt和Caspase⁃3的mRNA表达取左心室心肌组织200 mg,按照Trizol试剂盒操作说明书指示操作,提取总RNA,用Nanodrop测量其浓度,再按照Takara逆转录试剂盒操作说明,将RNA逆转录为cDNA;用SYB⁃RGREENI法检测PCR扩增产物。本实验的特异性引物均由日本Takara公司合成:Caspase⁃3:上游:5′⁃GCAGCAGCCTCAAATTGTTGAC⁃3′,下游:5′⁃TGCTCCGGCTCAAACCATC⁃3′;Akt:上游:5′⁃TC ATTGAGCGCACCTTCCAT ⁃3′,下游5′⁃TTCTGCAG⁃GACACGGTTCTC⁃3′;GAPDH:上游:5′⁃GAGATTA CTGCCCTGGCTCCTA⁃3′,下游:5′⁃CATCGTA⁃CT CCTGCTTGCTGAT-3′。反应条件:94 ℃变性45 s,56℃退火45 s,72℃延伸45 s,循环40次。
1.2.5TUNEL染色染色检测心肌细胞凋亡按试剂盒说明书操作,在荧光显微镜下观察,凋亡细胞核发出绿色荧光,则为TUNEL阳性。随机选取共10个非重叠的200高倍镜视野,计算凋亡心肌细胞数和心肌细胞总数,使用凋亡率计算公式:心肌细胞凋亡率=调亡心肌细胞数/心肌细胞总数×100%算得心肌细胞凋亡率。
1.2.6Western blot检测Akt和 Caspase⁃3 表达取心室肌组织500 mg,放置于液氮中研磨,移至EP管中,加入蛋白裂解液与蛋白酶抑制剂的混合液,4℃下12 000 r/min离心15 min,取上清液用BCA发检测蛋白浓度,将不同样本的蛋白浓度调至统一浓度5 μg/μL。配置10%分离胶和5%浓缩胶,每孔加样10 μL,聚丙烯酰胺凝胶电泳,恒流半干法转膜,用5%脱脂奶粉TBST缓冲液封闭1 h,分别置于Akt、Caspase⁃3的1∶1 000一抗4 ℃孵育过夜,TBST洗膜后用相应的1∶10 000荧光二抗孵育1 h;Odyssey荧光扫膜仪扫膜;最后,用ImageJ v1.36测量条带灰度值。
1.2.7ELISA检测cTnI水平取术后6 h大鼠的血清,静置30 min后5 000 r/min离心15 min,取其上清液并移至EP管中4℃保存,按照ELISA试剂盒说明书检测大鼠的cTnI水平。
1.3统计学处理采用SPSS 17.0处理实验数据,计数资料采用均数±标准差表示,多组比较采用单因素方差分析(ANOVA),组间两两比较采用LSD⁃t,P<0.05认为差异有统计学意义。
2 结果
2.1DATS对大鼠冠状动脉微栓塞心功能的影响与Sham组比较,CME组与DATS组LVEF、CO和FS显著下降,LVEDd显著上升,差异有统计学意义(P<0.05);与CME组比较,DATS组LVEF、CO和FS显著上升,LVEDd显著下降,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠心功能比较Tab.1 Comparison of cardiac function of rats in each group±s

表1 各组大鼠心功能比较Tab.1 Comparison of cardiac function of rats in each group±s
注:与Sham比较,aP <0.05;与CME组比较,bP <0.05;LVEF:左心射血分数;FS:左心室短轴缩短分数;LVEDd:左室舒张末期内径;CO:心排出量
组别Sham组CME组DATS组LVEF(%)85.21±2.52 52.43±1.77a 71.44±3.20ab FS(%)40.32±2.56 35.25±3.20a 41.64±1.57ab LVEDd(mm)5.10±2.33 6.05±1.12a 5.18±1.87ab CO(L/min)0.164±0.005 0.102±0.003a 0.157±0.009ab
2.2HE染色结果HE染色显示微球周围心肌细胞核溶解或消失,周边细胞水肿、变性,周围炎性细胞浸润和红细胞渗出。见图1。

图1 CME组局部心肌微梗死灶(HE,×200),箭头示微球Fig.1 CME group of local myocardial micro⁃infarction(HE,× 200)and the arrow shows microspheres
2.3心肌细胞凋亡情况凋亡心肌细胞TUNEL染色细胞核发绿色荧光(TUNEL阳性),正常细胞核不发绿色荧光。Sham组、CME组及DATS组心肌细胞凋亡率分别为(0.36± 0.10)%、(8.77±2.03)%及(3.85±1.17)%。与Sham组相比,CME组与DATS组心肌细胞凋亡率明显增高(P<0.05);与CME组相比,DATS组心肌细胞凋亡率显著减小(P<0.05)。见图2。

图2 各组大鼠心肌细胞凋亡(TUNEL)Fig.2 Apoptosis of rat cardiomyocytes(TUNEL)
2.4各组大鼠心肌Akt和Caspase⁃3 mRNA表达水平比较与Sham组比较,CME组与DATS组Akt mRNA表达水降低,Caspase⁃3 mRNA表达水平升高,差异有统计学意义(P<0.05);与CME组比较,DATS组Akt mRNA表达水平升高,Caspase⁃3 mRNA表达水平降低,差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠心肌Akt、Caspase⁃3 mRNA表达水平比较Tab.2 Comparison of expression levels of Akt and Caspase⁃3 mRNA in myocardium of rats in each group ±s

表2 各组大鼠心肌Akt、Caspase⁃3 mRNA表达水平比较Tab.2 Comparison of expression levels of Akt and Caspase⁃3 mRNA in myocardium of rats in each group ±s
注:与Sham组比较,aP<0.05;与CME组比较,bP<0.05
组别Sham组CME组DATS组只数10 10 10 Akt 0.79±0.07 0.24±0.03a 0.51±0.12ab Caspase⁃3 0.03±0.01 0.89±0.21a 0.60±0.08ab
2.5各组大鼠心肌Akt和Caspase⁃3蛋白表达水平比较与Sham组比较,CME组与DATS组Akt蛋白表达水降低,Caspase⁃3蛋白表达水平升高,差异有统计学意义(P<0.05);与CME组比较,DATS组Akt蛋白表达水平升高,Caspase⁃3蛋白表达水平降低,差异有统计学意义(P<0.05)。见图3、4。
2.6各组大鼠血清cTnI表达水平比较与Sham组比较,CME组与DATS组血清cTnI[(0.30 ± 0.015)μg/Lvs.(0.06± 0.002)μg/L]表达水平均升高,差异有统计学意义(P<0.05);与CME组比较,DATS组血清cTnI(0.20 ± 0.012 μg/L)表达水平下降,差异有统计学意义(P<0.05)。
3 讨论
CME可见于急性冠脉综合征的患者中,也是PCI过程中常见的并发症。研究[8]表明,CME可引起短暂的“慢血流”或“无血流”,并可伴随着反应性充血和心肌收缩功能障碍的发生。CME被认为是急性心肌梗死患者远期预后不良和病死率的独立预测因素。
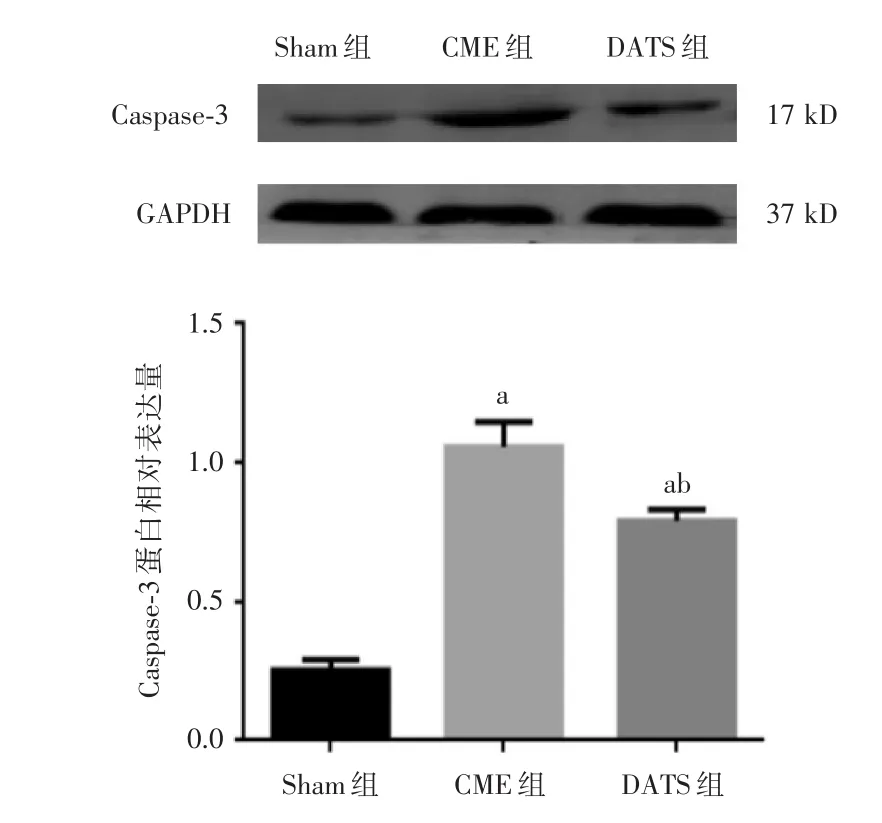
图3 各组大鼠心肌Caspase⁃3蛋白表达水平比较Fig.3 Comparison of expression of Caspase⁃3 protein in myocardium of rats in each group
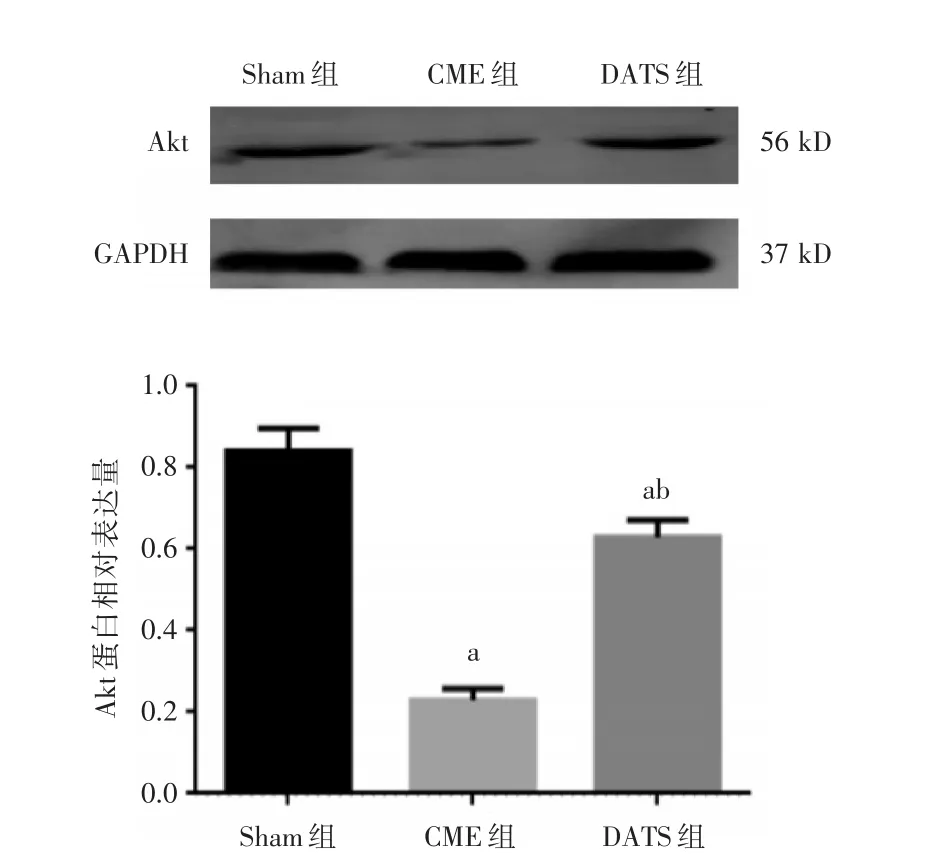
图4 各组大鼠心肌Akt蛋白表达水平比较Fig.4 Comparison of Akt protein expression in myocardium of rats in each group
CME发生后,局部心肌会出现微梗死灶,心肌细胞会出现坏死和凋亡,心功能呈进行性下降[9]。已有研究[10]证明,凋亡是CME致心肌损伤中重要的病理过程,而抗凋亡治疗能够明显地改善大鼠心功能。在笔者的前期实验中,在6 h内CME后心肌凋亡达到高峰[11]。因此,本研究观察时间点选取为CME后6 h。
大蒜素是一种具有多种生物活性的二烯丙基三硫化物,是从大蒜中提取出来的复合物,已经用于治疗细菌感染、糖尿病和心血管疾病多年[12]。CHEN等[13]的研究发现,大蒜素能够保护乙醇所致的氧化应激,并且可以通过抑制凋亡因子Bax和上调抗凋亡因子Bcl2从而减轻硫化氢介导的凋亡。XU等[14]发现大蒜素能够清除神经细胞的氧自由基,并且通过激活Nrf2/HO⁃1通路抑制神经细胞的凋亡。在缺血再灌注方面,有研究发现大蒜素能够激活沉默信号调节因子1,从而减轻糖尿病小鼠的心肌缺血再灌注损伤[15]。本研究证实,与Sham组相比,CME 6 h后心肌细胞出现凋亡,心功能下降,与之相反的是,腹腔注射大蒜素则可显著改善心功能,同时减轻CME所致心肌细胞凋亡。因此,抑制心肌细胞凋亡,减轻心肌损伤,这可能是大蒜素改善CME预后的重要机制之一。
Akt在抑制细胞凋亡中发挥着重要的作用[16]。磷酸化的Akt不仅能使糖原合成酶激酶-3β磷酸化而失活,而丧失诱导细胞凋亡的作用;而且还能够抑制促凋亡相关蛋白Caspases的合成,进而发挥抑制细胞凋亡的作用[17]。Caspases家族的激活是凋亡过程中的不可或缺的重要步骤[18]。Caspases家族中的Caspase⁃3则是细胞凋亡蛋白酶级联的反应的必经步骤,同时是细胞凋亡的最重要的蛋白酶[19]。其中,Caspase⁃9 也是内质网应激所致凋亡途径中的关键蛋白,当内质网受到应激时,上游Caspase⁃9发生蛋白酶水解反应,激活下游Caspase⁃3,最终引起细胞的凋亡[20-21]。笔者在早期研究中发现,CME后Caspase⁃9介导的内质网凋亡途径显著激活,并参与CME后的心肌损伤[9]。大量研究证实,Caspase⁃3与心肌梗死密切相关,抑制Caspase⁃3的表达可以明显降低缺血所致的心肌凋亡和显著地改善心功能。本研究结果显示,与CME组比较,DATS组可显著抑制CME后内质网凋亡的激活,其主要的表现是激活Akt的磷酸化活性,减少Caspase⁃3蛋白的活化,心脏超声参数FS、CO、LVEF和LVEDd和心肌酶cTnI相比于CME组得到明显改善。提示大蒜素能够减少CME后的心肌细胞凋亡,改善心功能的作用,与Akt的激活有关。当然大蒜素减轻CME致心肌凋亡的更多的信号通路仍需要进一步实验研究完善。
综上所述,大蒜素预处理可明显减少CME后心肌细胞凋亡并改善心功能,其机制可能是通过激活Akt从而阻断心肌细胞Caspase⁃3介导的死亡受体凋亡途径的激活。PCI术前预防性应用大蒜素,可能可以改善患者预后。
[1]HEUSCH G,KLEINBONGARD P,BOSE D,et al.Coronary microembolization:from bedside to bench and back to bedside[J].Circulation,2009,120(18):1822⁃1836.
[2]OTTO S,SEEBER M,FUJITA B,et al.Microembolization and myonecrosis during elective percutaneous coronary interven⁃tions in diabetic patients:an intracoronary doppler ultrasound study with 2 ⁃year clinical follow ⁃up[J].Basic Res Cardiol,2012,107(5):289.
[3]MORISHIMA I,SONE T,OKUMURA K,et al.Angiographic no⁃reflow phenomenon as a predictor of adverse long⁃term out⁃come in patients treated with percutaneous transluminal coro⁃nary angioplasty for first acute myocardial infarction[J].J Am Coll Cardiol,2000,36(4):1202⁃1209.
[4]ZHANG Q Y,GE J B,CHEN J Z,et al.Mast cell contributes to cardiomyocyte apoptosis after coronary microembolization[J].J Histochem Cytochem ,2006 ,54(5):515⁃523.
[5]SHI Z,FU F,YU L,et al.Vasonatrin peptide attenuates myo⁃cardial ischemia⁃reperfusion injury in diabetic rats and underly⁃ing mechanisms[J].Am J Physiol Heart Circ Physiol,2015,308(4):281⁃290.
[6]ARIGA T,SEKI T.Antithrombotic and anticancer effects of garlic⁃derived sulfur compounds:a review[J].Bio Factors,2006,26(2):93⁃103.
[7]LI L,SU Q,WANG Y,et al.Effect of atorvastatin(Lipitor)on myocardial apoptosis and caspase⁃8 activation following coro⁃nary microembolization[J].Cell Biochem Biophys,2011,61(2):399⁃406.
[8]SKYSCHALLY A,WALTER B,HEUSCH G.Coronary micro⁃embolization during early reperfusion:Infarct extension,but protection by ischaemicpostconditioning[J].Eur Heart J,2013,34(42):3314⁃3321.
[9]SU Q,LI L,LIU Y C,et al.Effect of metoprolol on myocardi⁃al apoptosis and caspase⁃9 activation after coronary microembo⁃lization in rats[J].ExpClinCardiol,2013,18(2):161.
[10]LI L,SU Q,WANG Y,et al.Effect of atorvastatin(Lipitor)on myocardial apoptosis and caspase⁃8 activation following coro⁃nary microembolization[J].Cell Biochem Biophys,2011,61(2):399⁃406.
[11]苏强,李浪,陆永光,等.阿托伐他汀对大鼠冠状动脉微栓塞后心肌细胞凋亡及caspase⁃12活化的影响及意义[J].中华老年心脑血管病杂志,2013,15(7):748⁃752.
[12]TRIO P Z,YOU S,HE X,et al.Chemopreventive functions and molecular mechanisms of garlic organosulfurcompounds[J].Food Funct,2014,5(5):833⁃844.
[13]CHEN L Y,CHEN Q,ZHU X J,et al.Diallyl trisulfide pro⁃tects against ethanol⁃induced oxidative stress and apoptosis via a hydrogen sulfide⁃mediated mechanism[J].Int Immunophar⁃macol,2016,36:23⁃30.
[14]XU X H,LI G L,WANG B A,et al.Diallyl trisufide protects against oxygen glucose deprivation⁃induced apoptosis by scav⁃enging free radicals via the PI3K/Akt⁃mediated Nrf2/HO⁃1 sig⁃naling pathway in B35 neural cells[J].Brain Res,2015,1614:38⁃50.
[15]YU L,LI S,TANG X ,et al.Diallyl trisulfide ameliorates myo⁃cardial ischemia⁃reperfusion injury by reducing oxidative stress and endoplasmic reticulum stress⁃mediated apoptosis in type 1 diabetic rats:role of SIRT1 activation[J].Apoptosis,2017,2:32⁃33.
[16]张慧,姜咏梅,尹琳.PI3K/AKT/GSK⁃3B信号在脑缺血预处理中的作用及对海马细胞凋亡的影响[J].华中科技大学学报(医学版),2011,40(4):408⁃412.
[17]鞠莉,贾振宇,蒋兆强,等.PI3K/Akt通路在大鼠矽肺纤维化中的作用研究[J].中国工业医学杂志,2011,24(4):282⁃284.
[18]GAMBERT S,VERGELY C,FILOMENKO R,et al.Adverse effects of free fatty acid associated with increased oxidative stress in postischemic isolated rat hearts[J].Mol Cell Biochem,2006,283(1):147⁃152.
[19]MAHESHWARI A,MISRO M M,AGGARWAL A,et al.Path⁃ways involved in testicular germ cell apoptosis induced by H2O2in vitro[J].FEBS J,2009,276(3):870⁃881.
[20]TAKATANI T,TAKAHASHI K,UOZUMI Y,et al.Taurine inhibits apoptosis by preventing formation of the Apaf⁃1/caspase⁃9 apoptosome[J].Am J Physiol Cell Physiol,2004,287(4):C949⁃C953.
[21]BALSAM L B,KOFIDIS T,ROBBINS R C.Caspase⁃3 inhibi⁃tion preserves myocardial geometry and long⁃term function after infarction[J].J Surg Res,2005,124(2):194⁃200.

