湖泊微拟球藻高含油突变株的构建及筛选
张玲香 陈怡雯 胡晗华
(1. 中国科学院水生生物研究所藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
微拟球藻(Nannochloropsis)是一类属于真眼点藻纲(Eustigmatophyceae)、球形或近似球形的单细胞真核生物, 该属有7个已定种(N. gaditana、N. salina、N. oculata、N. oceanica、N. australis、N.granulata和N. limnetica)[1,2], 其中仅有1个种类为淡水类型[3]。与该属中的海洋种类相似, 淡水的湖泊微拟球藻(N. limnetica)也具有较高的光合作用效率、生物量和油脂含量, 并富含二十碳五烯酸(EPA)[4—6]。作为最有潜力的工业产油的模式研究类群[7], 迄今该属多个海洋种类的全基因组序列已经公布[8—10], 它们的遗传转化体系也已建立[8,9,11]。
当前, 由于生物燃料生产的成本远高于化石燃料, 且微藻培养过程中消耗的仅与产出的能量相当,使得生物燃料包括微藻生物质仅在替代减排上具有一定的优势[12]。将微藻生物质生产与污水处理相结合, 可在减少碳排放的同时增加经济效益, 由此使得利用微藻作为生产生物质的原料变得经济可行。因而, 从污水处理角度考虑, 研究利用淡水种类作为生物质原料具有更大的优势。由于湖泊微拟球藻的全基因组序列没有公布, 无法有效通过对靶基因的操作改良藻细胞的产油性状。本文利用电击转化的方法, 将zeocin抗性基因随机插入湖泊微拟球藻的基因组, 构建突变体库, 通过筛选得到油含量及生长显著增加的突变株, 为快速获取优良目的性状的高产油突变株提供了一种有效途径。
1 材料与方法
1.1 藻株和培养
湖泊微拟球藻(Nannochloropsis limnetica KR 1998/3)由德国淡水生态和内陆渔业研究所(Institute of Freshwater Ecology and Inland Fisheries, Neuglobsow) Lothar Krienitz教授提供, 经稀释涂平板纯化后得到无菌藻落。常规培养使用BG11培养基,在温度为22℃、光强约为50 μmol photons/(m2·s)、光暗周期L∶D为16∶8的条件下进行。固体培养基加1.2%的琼脂, 转化子在加1 μg/mL zeocin的平板上筛选。从平板上挑取转化子接种至48孔板(每孔含添加了0.5 μg zeocin的1 mL液体培养基)中培养15d后用于鉴定。经鉴定的阳性转化子接入盛120 mL BG11培养基(将NaNO3浓度减少到882 μmol/L)的250 mL三角瓶中静置培养, 用于三酰基甘油相对含量及生物量(OD730)的分析。用于总脂、三酰基甘油及其脂肪酸组成分析的藻细胞在通空气的条件下培养。
1.2 质粒构建
以湖泊微拟球藻基因组DNA为模板, 用引物tub-fw (5′-atgcTCCGGAATCATATCGTGCCACA GCAGATTGG-3′, 下划线为Aor13H I酶切位点)和tub-rv (5′-agctTGGCCATGGTTGAGACTAGTTG GAGGGAGG-3′, 下划线为Bal I酶切位点)进行PCR扩增得到β-tubulin启动子区域(约570 bp)[11]。PCR产物经测序验证后纯化回收, 用Aor13H I和Bal I酶切, 与经同样双酶切后回收的pPha-T1载体大片段相连, 以替换其中的fcpB启动子片段(位于抗性基因sh ble上游), 得到质粒pPha-T1-TUB。
1.3 电击转化方法
通过电击转化野生型湖泊微拟球藻的方法参照文献[11]进行, 略有修改。简述如下: 生长至对数期藻细胞收集后用375 mmol/L山梨醇溶液洗涤3次并重悬, 加入3—5 μg用Sca I线性化的pPha-T1-TUB质粒DNA, 最终悬浮液体积为200 μL, 转至2 mm电击杯中。电击参数及电击后藻细胞处理与已报道的对海洋微拟球藻种类的转化流程相同[8,9,11]。
1.4 PCR扩增
用CTAB法提取基因组DNA。以野生型为阴性对照, 质粒pPha-T1-TUB为阳性对照, 分别以tubfw和FcpAt_rv (5′-TCGAGAAAACTCATCCTGT GC-3′)为配对引物, 通过PCR的方法检测转化子。50 μL PCR反应体系含有25 μL 2×PCR Mix(擎科生物)、引物各100 pmol和50 ng DNA模板。PCR反应程序为: 94℃变性5min, 接下来是34个循环反应(94℃变性30s, 60℃复性30s, 72℃延伸1min), 最后是72℃延伸10min。
1.5 突变株生长及含油量分析
相对生物量通过测定培养液的OD730值获得。分别在培养的第10和第12天收集相同量的藻细胞,按照Bligh和Dyer[13]的方法提取总脂。总脂在薄层层析(TLC)板上展层后分析三酰基甘油的相对含量[14]。薄层层析板的型号是Silica gel 60 F254 (Merk KgaA Darmstadt, Germany), 展层剂体系为正己烷∶乙醚∶乙酸(70∶30∶1, v/v/v)。展层结束后层析板置于含有适量颗粒碘的烧杯中显色5—10min[15]。标准品三油酸甘油酯(Glyceryl trioleate)购自Sigma公司。采用称重法确定总脂和用薄层层析板回收的三酰基甘油的绝对含量。
1.6 脂肪酸组成分析
总脂和三酰基甘油甲酯化后用正己烷萃取3次,合并有机相, 取1 μL用Ultra Trace气相色谱分析仪(Thermo Scientific, United States)进行脂肪酸组成分析。用面积归一法计算各脂肪酸组分的相对百分比。
2 结果与讨论
2.1 湖泊微拟球藻突变体库的构建
自2011年Killian等[16]利用电击的方法在海洋微拟球藻(N. oceanica)中建立起高效的遗传转化体系以来, 该属中另外4个海洋种类的遗传转化方法也已被陆续报道[8,11]。南方微拟球藻(N. australis)是最近才被鉴定的一个新种, 与海洋微拟球藻有非常近的亲缘关系, 因而两者的转化程序应该相同。我们采用同样的转化策略, 构建带有zeocin抗性基因的质粒, 由湖泊微拟球藻β-tubulin基因的启动子驱动表达, 转化后可筛选得到阳性转化子。初步计算转化效率仅为海洋种类的约1%, 因而转化方法尚待进一步优化。微拟球藻属的种类具有厚的细胞壁, 电转化需要很高的电场强度(通常为11000—12000 V/cm)[16], 而对淡水种类而言, 由于渗透压等因素的不同, 可能需要对电场强度等电击参数进行优化。
从平板上挑取的转化子接入zeocin浓度为0.5 μg/mL的BG11培养基中培养, 以便进一步筛选。连续传代6个月后, 我们共获得了约300个可在含有抗性的液体培养基中生长的转化子, 将这些作为突变子库, 用于筛选具有优良产油性状的突变株。从中随机选取30个突变株, 以其基因组DNA为模板, 以tub-fw和FcpAt_rv为引物进行PCR扩增检查zeocin抗性基因及终止子序列片段(共约1.2 kb)。结果表明, 所有30个抗性藻落均可扩增出目的片段, 得到了可稳定遗传的转化子。
2.2 高含油突变株的筛选
由于BG11培养基中的氮浓度高达17.6 mmol/L,培养早期收获检测到的湖泊微拟球藻仅含很低的三酰基甘油[17]。将起始硝酸盐的浓度降低至882 μmol/L (与海水培养基f/2中的氮浓度一致), 培养湖泊微拟球藻, 淡水的微拟球藻三酰基甘油含量与海洋的微拟球藻相当[18]。对上述随机挑选的30个突变株与野生型在氮浓度为882 μmol/L的条件下培养, 利用薄层层析比较三酰基甘油含量, 培养10d的结果显示共有16个突变株的三酰基甘油含量高于野生型, 培养12d共有14个突变株的三酰基甘油含量高于野生型, 10d和12d检测的油含量均高于野生型的突变株有11株, 占比为37%。其中突变株G5的油含量在12 d比野生型增加超过50% (图 1)。
大量的研究显示藻细胞油脂积累与生长之间不具有同步性[19]。各种胁迫(尤其是氮限制)可导致TAG积累, 但严重阻碍藻的生长。利用基因工程手段提高细胞油脂含量通常也会导致细胞生长受到影响。为获得生长不受影响的高含油突变株, 我们进一步比较了野生型与突变株的生长情况。如图 2所示, 9个突变株的相对生物量高于野生型, 其余21株的生长均受到不同程度抑制, 其中K36的生物量仅为野生型的约40%。
综合油含量及生长的结果, 9个生长优于野生型的突变株中, K14、K24、K26、K29和G5等5株的油含量也高于野生型, 占所有分析突变株的约17%。K26和G5两个突变株的相对生物量分别比野生型增加约5%—10%和3%—6%。
2.3 两个高含油突变株的产油特性
将上述2个生长及油含量优于野生型的突变株K26和G5在通空气的条件下培养7d, 收获藻细胞用于分析总脂、三酰基甘油含量及其脂肪酸组成。表 1显示, 在本研究条件下培养的湖泊微拟球藻总脂的含量为22%—26%, 略低于海洋微拟球藻的总脂含量[18]。2个突变株的三酰基甘油均高于野生型,含量占总脂的一半左右。湖泊微拟球藻总脂中的脂肪酸以C16∶0 、C16∶1和C20∶5为主, 三者之和占总脂肪酸的70%以上。另外2种含量较高的脂肪酸为C14∶0和C18∶1, 尤其是在三酰基甘油中所占的比例较高。与野生型比, 突变株总脂的C20∶5较低, 特别是突变株G5中C20∶5的含量仅为野生型的约40%, 相应地C18∶1的含量增加了一倍多。突变株中丰富的短链脂肪酸组成特性符合作为生物柴油原料的标准。
通过生理胁迫或对相应靶基因的遗传操作均可促进微藻细胞油脂的积累。然而, 前者严重抑制细胞的生长, 后者通常也会影响藻细胞的生长。由于生长和油脂积累的不同步性, 在不影响或是增加细胞生长的同时提高细胞油脂积累可能涉及多个基因的协同作用。因而, 有目的地通过基因工程手段对产油性状进行改良不但需要长时间的多次尝试, 也可能需要多个抗性筛选标记。通过随机插入突变, 从大量突变子库中筛选生长和油含量均显著增加的方法是切实可行的有效手段[20,21]。由于外源基因多拷贝的随机插入, 尽管不易确定影响性状的目的基因, 但至少可以获得对目标性状显著改良的突变株。通过本研究建立的突变株筛选方法, 可以快速获得具有优良产油性状的藻株。进一步, 通过对插入位点的深入分析还可以确定影响生长及油脂合成的相关基因, 阐明藻细胞的油脂代谢机理,为更有效地改造湖泊微拟球藻产油性状提供理论支撑。
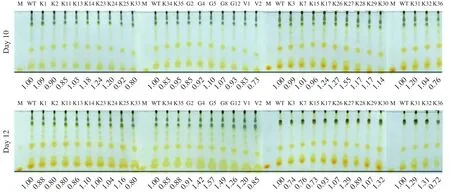
图 1 野生型和突变株培养10d(上)和12d(下)后提取总脂的硅胶板薄层层析图Fig. 1 Lipid composition and content in mutants and wild type (WT) of Nannochloropsis limnetica at day 10 and 12
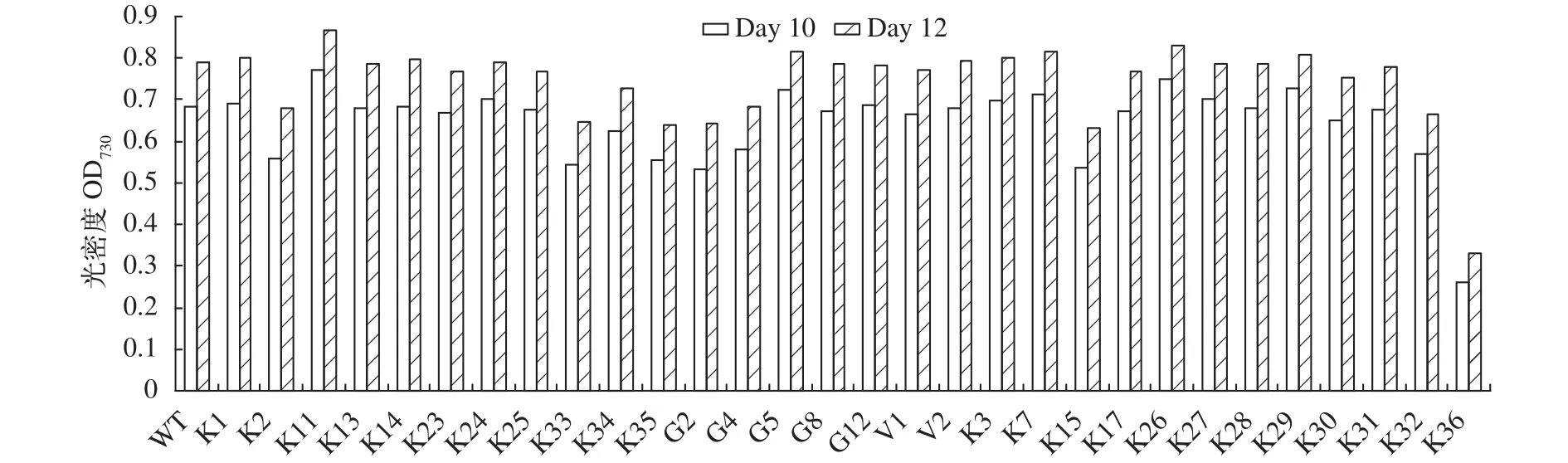
图 2 野生型和突变株培养10d和12d后相对生物量(OD730)的比较Fig. 2 The relative biomass (OD730) in mutants and wild type (WT) of Nannochloropsis limnetica at day 10 and 12
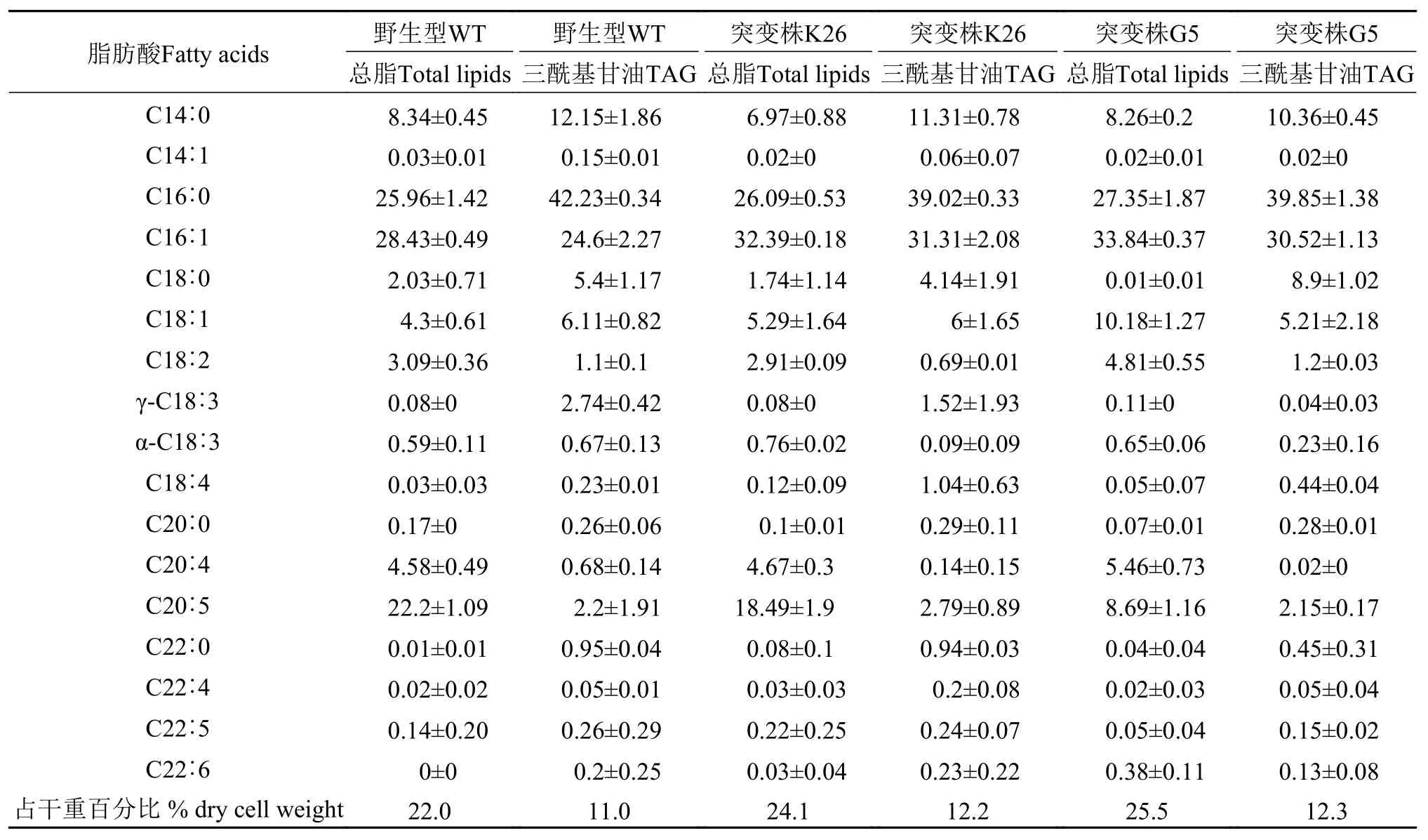
表 1 野生型湖泊微拟球藻与富油突变株K26和G5的总脂与三酰基甘油脂肪酸组成及含量Tab. 1 Fatty acid composition (mol %) in total lipids and triacylglycerol (TAG) of mutants (strains K26 and G5) and wild type (WT) of Nannochloropsis limnetica
参考文献:
[1]Andersen R A, Brett R W, Potter D, et al. Phylogeny of the Eustigmatophyceae based upon 18S rDNA, with emphasis on Nannochloropsis [J]. Protist, 1998, 149(1):61—74
[2]Fawley M W, Jameson I, Fawley K P. The phylogeny of the genus Nannochloropsis (Monodopsidaceae, Eustigmatophyceae), with descriptions of N. australis sp. nov. and Microchloropsis gen. nov [J]. Phycologia, 2015, 54(5):545—552
[3]Krienitz L, Hepperle D, Stich H B, et al. Nannochloropsis limnetica (Eustigmatophyceae), a new species of picoplankton from freshwater [J]. Phycologia, 2000, 39(3):219—227
[4]Krienitz L, Wirth M. The high content of polyunsaturated fatty acids in Nannochloropsis limnetica (Eustigmatophyceae) and its implication for food web interactions,freshwater aquaculture and biotechnology [J]. Limnologica, 2006, 36(3): 204—210
[5]Li F J, Wan X, Fang X T, et al. Effects of nitrogen sources and CO2levels on the growth and oil accumulation in Nannochloropsis limnetica [J]. Acta Hydrobiologica Sinica, 2015, 39(2): 436—440 [李凤娟, 万秀, 方仙桃, 等. 不同氮源及CO2浓度下湖泊微拟球藻的生长及产油特性分析. 水生生物学报, 2015, 39(2): 436—440]
[6]Freire I, Cortina-Burgueño A, Grille P, et al. Nannochloropsis limnetica: A freshwater microalga for marine aquaculture [J]. Aquaculture, 2016, 459: 124—130
[7]Jinkerson R E, Radakovits R, Posewitz M C. Genomic insights from the oleaginous model alga Nannochloropsis gaditana [J]. Bioengineered, 2013, 4(1): 37—43
[8]Radakovits R, Jinkerson R E, Fuerstenberg S I, et al.Draft genome sequence and genetic transformation of the oleaginous alga Nannochloropsis gaditana [J]. Nature Communications, 2012, 3: 686
[9]Vieler A, Wu G, Tsai C H, et al. Genome, functional gene annotation, and nuclear transformation of the Heterokont oleaginous alga Nannochloropsis oceanica CCMP1779[J]. PLoS Genetics, 2012, 8: e1003064
[10]Wang D, Ning K, Li J, et al. Nannochloropsis genomes reveal evolution of microalgal oleaginous traits [J]. PLoS Genetics, 2014, 10: e1004094
[11]Li F, Gao D, Hu H. High-efficiency nuclear transformation of the oleaginous marine Nannochloropsis species using PCR product [J]. Bioscience, Biotechnology, and Biochemistry, 2014, 78(5): 812—817
[12]Chisti Y. Biodiesel from microalgae [J]. Biotechnology Advances, 2007, 25(3): 294—306
[13]Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911—917
[14]Reiser S, Somerville C. Isolation of mutants of Acinetobacter calcoaceticus deficient in wax ester synthesis and complementation of one mutation with a gene encoding a fatty acyl-coenzyme A reductase [J]. Journal of Bacteriology, 1997, 179(9): 2969—2975
[15]Yu E T, Zendejas F J, Lane D P, et al. Triacylglycerol accumulation and profiling in the model diatoms Thalassiosira pseudonana and Phaeodactylum tricornutum (Baccilariophyceae) during starvation [J]. Journal of Applied Phycology, 2009, 21(6): 669—681
[16]Kilian O, Benemann C S E, Niyogi K K, et al. High-efficiency homologous recombination in the oil-producing alga Nannochloropsis sp [J]. Proceedings of the National Academy of Sciences of the United States of America,2011, 108(52): 21265—21269
[17]Li X B, Xu X D, Kong R Q. Studies on the production of oil and polyunsaturated fatty acids in five species of Nannochloropsis [J]. Acta Hydrobiologica Sinica, 2010,34(5): 893—897 [李秀波, 徐旭东, 孔任秋. 五种微绿球藻产油和产多不饱和脂肪酸的研究. 水生生物学报,2010, 34(5): 893—897]
[18]Huang W C, Hu H H. Study on the salinity tolerance and oil accumulation in Nannochloropsis [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 383—387 [黄伟超, 胡晗华.微拟球藻属对盐度的耐受及其产油特性分析. 水生生物学报, 2013, 37(2): 383—387]
[19]Tsai C H, Warakanont J, Takeuchi T, et al. The protein Compromised Hydrolysis of Triacylglycerols 7 (CHT7)acts as a repressor of cellular quiescence in Chlamydomonas [J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(44):15833—15838
[20]Liu F F, Li X B, Fang X T, et al. Selection of oil-content mutants in Phaeodactylum tricornutum [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 799—802 [刘飞飞, 李秀波,方仙桃, 等. 三角褐指藻产油突变株的筛选. 水生生物学报, 2013, 37(4): 799—802]
[21]Li X, Zhang R, Patena W, et al. An indexed, mapped mutant library enables reverse genetics studies of biological processes in Chlamydomonas reinhardtii [J]. The Plant Cell, 2016, 28(2): 367—387

