不同运动强度对黑鲷生长、血清和肝脏抗氧化指标的影响
虞顺年 魏小岚, 韦芳三 肖雅元 李纯厚
(1. 中国水产科学研究院南海水产研究所, 农业部南海渔业资源开发利用重点实验室, 广东省渔业生态环境重点实验室,广州 510300; 2. 上海海洋大学水产与生命学院, 上海 201306; 3. 贵州省水产研究所, 贵阳 550025)
黑鲷(Sparus macrocephalus)属鲈形目、鲷科、鲷属, 俗称有海鲋、黑立、乌格等, 为近岸暖水性鱼类, 广泛分布于我国沿海, 其营养丰富, 肉质鲜美, 是大亚湾主要优质经济鱼类之一。因其具有适温、适盐性强, 食性广, 生长迅速, 移动范围小等特点, 成为沿海增殖放流的优良品种, 对生态修复和增加资源量都有重要作用[1,2]。
目前, 大量增殖放流实践表明除了少数成功案例, 绝大多数渔业生物资源的增殖放流并没有达到预期的效果[3], 造成这样收效甚微的因素包括许多方面, 其中放流后鱼种的存活率低是主要因素之一。游泳运动是鱼类生存和繁殖决定性因素, 是其摄食、逃避敌害等行为的主要方式[4]。养殖生产繁育的苗种在集约化养殖条件下, 活动空间受到了限制, 游泳活动强度减少, 造成鱼体脂肪累积、抗应激能力和免疫力下降[5,6]等, 导致鱼种在放流后无法快速适应外界环境胁迫, 从而影响放流效果。因此, 如何增强放流生物的机体免疫机能对提高放流生物放流后在自然环境的生存能力具有重要意义。大量研究表明, 放流前对鱼种进行适度的游泳运动训练能有效地改善鱼体的生理机能, 增强免疫能力, 提高野外存活率[7—9]。中华倒刺鲃在1.0 bl/s流速下训练8周后, 免疫参数得到提高, 免疫细胞的数量及抗体含量均增加, 氧化应激水平和炎症水平则显著降低, 从而增强鱼体抗病毒感染的能力[10]。宋波澜[11]在对红鳍银鲫的研究中发现一定强度的运动训练对SOD的活性有显著提升作用, 说明适当运动锻炼有助于其抗氧化机能的提升。因此, 本研究以黑鲷为研究对象, 在不同水流强度下诱导其游泳运动, 探讨游泳运动强度对其生长、存活率、血清生化指标和肝脏抗氧化机能的影响, 以期为提高渔业资源增殖养护效果提供科学依据。
1 材料与方法
1.1 实验鱼种
黑鲷来源于深圳南澳鱼苗繁育基地同一批次孵化鱼苗, 正式训练实验开始前在室内循环水养殖系统暂养两周。养殖水温控制在(26±0.5)℃, 溶氧水平大于6 mg/L, 光照周期为12L∶12D。暂养期间每天在静水中过量投喂人工饲料2次(9:00和17:00)(海水鱼配合饲料, 广东越群海洋生物研究开发有限公司), 饲料营养成分: 粗蛋白≥45%、粗脂肪≥6%、粗纤维≤5%、粗灰分≤18%、钙≥2.5%、总磷≥1.2%、水分≤12%、赖氨酸≥2.2%。
1.2 实验装置
采用自行设计的循环水运动训练装置(图1)。训练装置分为上下两层, 上层为环形鱼类运动训练区域, 下层为动力区域。动力由潜水泵提供, 运动训练区域有底部有两条平分环形训练区域的反向喷水管, 水泵带动水流从喷水管流出, 产生稳定环形水流, 实验中通过调控水阀控制水泵出水量来控制装置内水流速度, 流速大小用LS300-A型便携式流速仪测定。
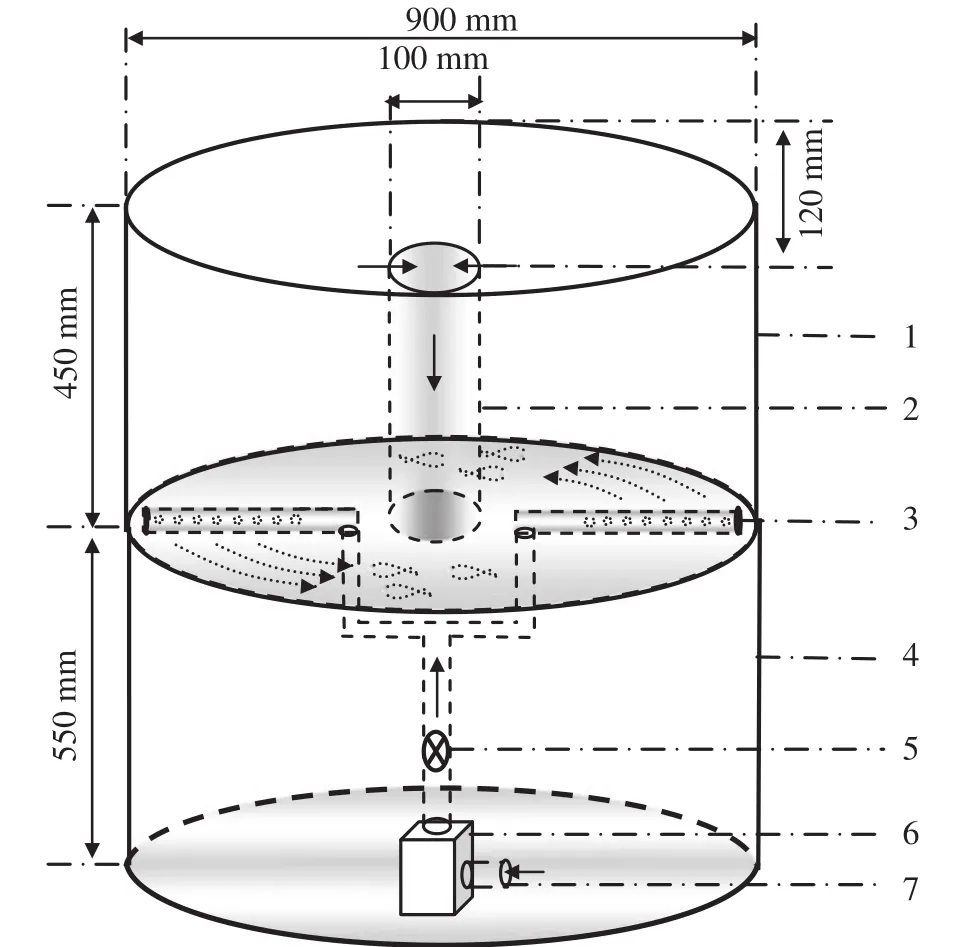
图1 实验装置示意图Fig. 1 Schematic Diagram of the Experiment Set-up
1.3 实验方法
挑选健康及大小相当的黑鲷[体长(6.75±0.03) cm,体重(11.56±0.15) g]分别置于水流速度为0.0、1.0、2.0和4.0 bl/s(体长/秒)4个实验组中, 每组3个平行,每个平行30尾鱼, 所有平行一起开始为期2周的实验。为了减少生理胁迫, 正式训练前逐步提高水流强度, 直至达到正式训练所需的游泳条件, 每天训练12h(8:00—20:00)。训练期间每天过量饲喂2次(9:00、17:00), 饲喂期间各组的水流环境保持静水状态, 饲喂后1h清理训练区域内的残饵粪便, 然后各训练组训练区域水流速度恢复至对应强度, 除水流强度不一致外, 其他条件保持一致。实验期间, 训练装置日换水量约为驯化水体的15%, 实验水体水温为(26±0.5)℃, pH为8.32±0.02, 溶氧为(6.4±0.3) mg/L。训练结束后, 对所有实验鱼禁食1d, 每个平行组随机选取4尾鱼, 进行体长和体重测量, 然后用2.5 mL无菌注射器从尾静脉抽血。血样在4℃冰箱中静置2h后, 以4℃ 3000 r/min离心10min, 吸取上层血清,-80℃保存。抽血后将鱼置于冰上迅速解剖取其肝脏, 先在预冷的生理盐水中洗净血液, 并用滤纸吸干水分, 置于-80℃超低温冰箱中保存。
1.4 生长性能指标测定
每天观察并记录鱼的死亡数量。实验开始和结束时测定各实验组鱼的体质量, 分别按下式计算成活率(Survival rate)、特定生长率(Specific growth rate)、增重率(Weight gain rate)、肝体比(Hepato somatic index)、脏体比(Viscero somatic index)、肥满度(Conditlon factor):
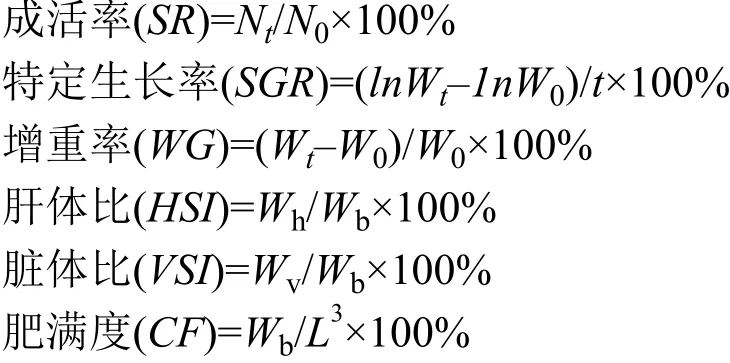
式中, N0为初鱼尾数; Nt为末鱼尾数; W0(g)为初体均重; Wt(g)为末体均重; t (d)为训练天数; Wb(g)为每尾鱼末体重; L (cm)为每尾鱼末体长; Wh(g)为每尾鱼末肝脏重; Wv(g)为每尾鱼末内脏重。
1.5 血液生化指标测定
测定前取出在-80℃保存的血清在4℃条件下融化, 血糖(GLU)、总胆固醇(TCHO)、甘油三酯(TG)、低密度脂蛋白(LDL)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)采用全自动生化分析仪(7600型号, 日本日立公司)测定。
总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)、蛋白质羰基、抑制羟自由基能力、溶菌酶(LZM)、过氧化氢(H2O2)采用试剂盒测定, 上述指标试剂盒购自南京建成生物工程研究所。
1.6 肝脏生化指标测定
取出在-80℃保存的肝脏组织块与4℃自然解冻, 按1∶9 (g∶mL)的质量体积比加入0.86%的预冷生理盐水, 冰浴匀浆后于4℃以3000 r/min离心10min,取上清用于总抗氧化能力(T-AOC)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)、丙二醛(MDA)的测定。上述指标均使用南京建成生物工程研究所试剂盒测定。
1.7 统计分析
实验数据用SPSS 19.0 软件进行单因素方差分析(One-way ANOVA), 若组间存在显著差异则再进行LSD多重比较, 统计值用平均值±标准误(mean±SE)表示, 显著水平定为P<0.05。
2 结果
2.1 游泳运动强度对黑鲷生长及存活率的影响
如表1所示, 黑鲷的初体均重为(11.56±0.15) g,在2周游泳运动训练结束后, 对照组的体质量、特定生长率(SGR)和增重率(WGR)都显著大于其余3组(P<0.05), 而各训练组间并无显著性差异。不同的游泳运动强度对肝体比(HSI)、脏体比(VSI)和肥满度(CF)并没有显著性影响。训练期间, 除4 bl/s训练组外其余3组并未出现黑鲷死亡现象, 4 bl/s训练组的成活率仅为93.3%(P<0.05)。
2.2 游泳运动强度对黑鲷血清生化指标的影响
经过2周实验后, 黑鲷的血糖(GLU)、总胆固醇(TCHO)、甘油三酯(TG)、低密度脂蛋白(LDL)均表现出相似的应答模式, 总体呈现为随运动强度的增加先下降后上升的趋势, 在2 bl/s组达到最小值,各组间差异均存在显著性 (P<0.05)。不同运动强度对总蛋白(TP)、白蛋白(ALB)和球蛋白(GLB)的含量具有显著性影响(P<0.05), 1 bl/s组和2 bl/s组均显著高于对照组, 而4 bl/s组则显著低于对照组。谷丙转氨酶(GPT)和谷草转氨酶(GOT)对运动训练的反应趋势一致, 均为先降低后升高, 各组差异性水平显著(P<0.05)。与GPT和GOT相反, 酸性磷酸酶(ACP)和碱性磷酸酶(AKP)则先升高后降低, 2 bl/s组最高, 4 bl/s最低, 与对照组有显著性差异(P<0.05)(表2)。
2.3 游泳运动强度对黑鲷血清抗氧化指标的影响
游泳运动训练对黑鲷血清总抗氧化能力(TAOC)有较为明显的提升作用, 训练组T-AOC均高于对照组, 2.0 bl/s组与对照组具有显著性差异(P<0.05, 图2A)。相比对照组, 3个训练组的超氧化物歧化酶(SOD)活性均出现不同程度的下降, 其中1 bl/s组显著降低(P<0.05), 训练组间没有显著性差异(图2B)。随运动强度的增加, 过氧化氢酶(CAT)的活性也随之上升, 较对照组分别提升了28.1%、34.5%和45.2%, 但差异并没有达到显著水平(图2C)。谷胱甘肽过氧化物酶(GSH-PX)活性和还原型谷胱甘肽(GSH)含量总体呈先上升后下降趋势, GSH-PX活性在2.0和4.0 bl/s组显著高于其余两组(P<0.05, 图2D), GSH含量在2.0 bl/s组最高, 显著高于0 bl/s组和4.0 bl/s组(P<0.05, 图2E)。丙二醛(MDA)含量在 2.0 bl/s组最低, 各组间并没有显著性差异(图2F)。
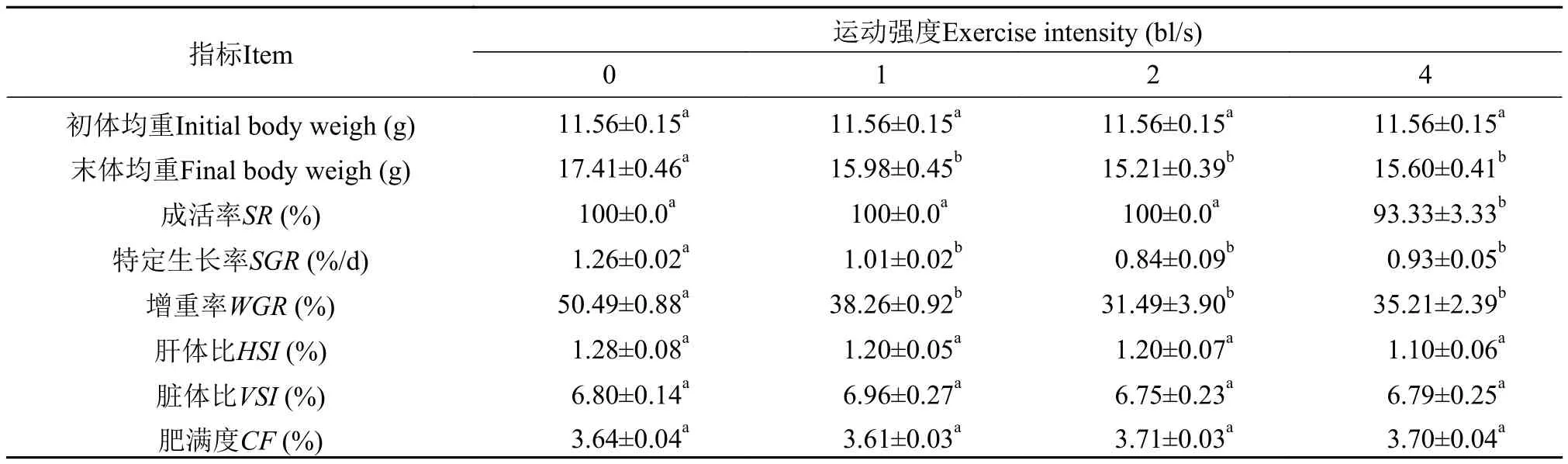
表1 游泳运动强度对黑鲷生长及存活率的影响Tab. 1 The effect of swimming exercise intensity on growth and survival rate of Sparus macrocephalus
过氧化氢(H2O2)含量在训练组均出现上升, 在4.0 bl/s组显著高于对照组(P<0.05, 图3A)。溶菌酶(LZM)活性的变化趋势是先上升后下降, 在1.0 bl/s组活性最高, 训练组LZM活性均高于对照组, 但是差异不具有显著性(图3B)。2周运动训练显著提高了黑鲷血清抑制羟自由基能力, 3个训练组的抑制羟自由基能力显著高于对照组(P<0.05, 图3C)。蛋白质羰基含量在训练组均低于对照组, 各组间没有显著性差异(图3D)。
2.4 游泳运动强度对黑鲷肝脏免疫指标的影响
黑鲷肝脏总抗氧化能力(T-AOC)在各处理组间无显著性差异, 但训练组均高于对照组(图4A)。还原型谷胱甘肽(GSH)含量在 4.0 bl/s组最高(P<0.05),1.0 bl/s组和2.0 bl/s组均高于对照组, 但差异未达到显著水平(图4B)。碱性磷酸酶(AKP)和酸性磷酸酶(ACP)变化趋势基本一致, 都是运动强度增加活性增强, AKP活性在4.0 bl/s组显著高于其余三组(P<0.05, 图4C), ACP活性在2.0 bl/s组和4.0 bl/s组显著高于其余两组(P<0.05, 图4D)。CAT活性随运动强度增加呈上升趋势, 在4.0 bl/s组显著高于对照组(P<0.05, 图4E)。训练组MDA含量均高于对照组, 但差异未达到显著性水平(图4F)。

表2 游泳运动强度对黑鲷血清生化指标的影响Tab. 2 The effect of swimming exercise intensity on serum biochemical indices of Sparus macrocephalus

图2 游泳运动强度对黑鲷血清抗氧化指标的影响Fig. 2 The effect of swimming exercise intensity on the serum antioxidant indices of Sparus macrocephalus
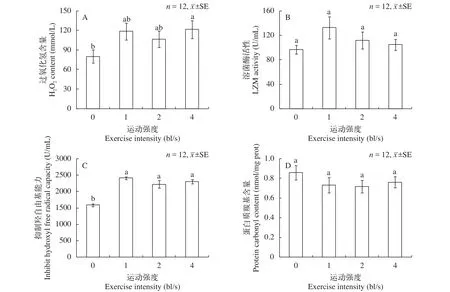
图3 游泳运动强度对黑鲷血清抗氧化指标及溶菌酶活性的影响Fig. 3 The effect of swimming exercise intensity on the serum antioxidant indices and lysozyme activity of Sparus macrocephalus

图4 游泳运动强度对黑鲷肝脏抗氧化指标的影响Fig. 4 The effect of swimming exercise intensity on the hepatic antioxidant indices of Sparus macrocephalus
3 讨论
3.1 不同运动强度对黑鲷生长及存活率的影响
鱼类游泳运动是其生活史的重要组成部分, 大量研究表明适度的游泳运动训练对鱼类的生长具有积极的作用, 如缺帘鱼(Brycon cephalus)[8]、金头鲷(Sparus aurata)[12]、黄尾(Seriola lalandi)[13]、西伯利亚鲟(Acipenser baeri)[14]等在适宜强度训练下生长率有了明显提升。但是, 亦有研究表明运动训练会抑制某些鱼类的生长, 如真鲷(Pagrosomus major)[15]、剑尾鱼(Xiphophorus montezumae)[16]、金带篮子鱼(Siganus rivulatus)[17]等, 本研究结果也表明运动训练并不能促进黑鲷的生长, 反而产生了抑制。推测鱼类自身游泳能力与训练对其生长的影响密切相关, 黑鲷、真鲷和篮子鱼属于中下层鱼类, 自身不太活跃活动范围较窄, 训练迫使其将大量能量消耗在游泳运动中, 用于生长的能量分配减少, 从而生长率低于对照组。自然界中黑鲷喜在岩礁和沙泥底质避流生活, 本研究结果原因可能实验设计的训练强度过高, 若降低训练强度或许会有利于其生长; 此外, 训练设施、训练方式和训练时间等都与鱼类生长有密切关系, 以现有数据无法对其作出准确解释, 因此具体原因有待进一步研究。研究表明, 过高的训练强度会使游泳成为不可持续和应激性活动, 导致体内能量过量消耗, 产生的有害物质无法及时清除, 对鱼体造成损伤, 最终导致鱼死亡。Bengtso等[18]发现犬齿牙鲆(Paralichthys dentatus)在30—40 cm/s水流强度下的存活率显著下降; Bagatto等[19]发现在5 bl/s强度下训练的斑马鱼仔鱼(Danio rerio)存活率显著降低, 本研究4.0 bl/s组结果与此一致, 表明4.0 bl/s的强度已经超出黑鲷的承受范围。
3.2 不同运动强度对黑鲷血清生化指标的影响
血清生化指标能反映鱼类生理代谢状态, GLU、TCHO、TG和LDL含量对监测鱼类生理健康状况具有重要意义。已有研究表明, 适度有氧运动能调节GLU水平、降低TCHO、TG和LDL含量[20—22], 本研究结果也证实了适度的运动训练(2.0 bl/s)具有调节血糖水平和降低血脂的作用。原因可能是在适宜的运动刺激下鱼类的代谢加强, 能促进机体对血糖的利用和血脂的转运; 而当运动强度(4.0 bl/s)超过鱼体的负荷, 则会对机体造成损伤, 导致血糖和脂质代谢功能紊乱, 从而血糖和血脂指标上升, 影响鱼类健康。血清蛋白浓度对机体免疫机能有十分重要作用, 可反映机体蛋白质代谢水平和抵抗力等[23], 本研究表明在2.0 bl/s水流强度下训练能显著提高黑鲷血清蛋白浓度, 从而增强机体免疫机能。GPT和GOT主要存在于肝脏中, 只有当肝脏受到损伤才会大量释放到血液中, 因此其在血液中的活性升高则可能说明肝脏受到了损伤[24]。已有研究表明, 中度有氧训练可以有效降低非酒精性脂肪性肝炎患者的血清GPT和GOT含量, 使其恢复正常水平[25]。在本研究中, 2.0 bl/s组GPT和GOT活性均显著下降, 表明在该强度下运动训练能保护肝脏, 增强肝脏的机能。AKP和ACP的活性高低对机体代谢和免疫有重要影响, 在适宜范围内活性升高表明代谢机能加强, 本研究表明2.0 bl/s运动强度能显著提高AKP和ACP活性, 有助于增强机体代谢和免疫机能。
3.3 不同运动强度对黑鲷血清免疫指标的影响
T-AOC、SOD、CAT、GSH-PX、GSH、MDA等可以作为衡量机体免疫机能的重要指标[26]。适度的有氧运动训练可以显著提高机体的T-AOC, 增强机体自由基代谢, 提高免疫机能[27], 这与本研究2.0 bl/s组的结果一致。研究表明, 运动训练对SOD活性具有显著增强作用[28], 本研究结果却表明运动训练对黑鲷血清SOD活性没有增强作用, 反而产生了抑制。原因可能是不同鱼类对运动的响应机制不一样, 黑鲷在运动刺激下主要通过激活其他氧自由基清除途径来达到清除氧自由基的目的。MDA和蛋白质羰基作为脂质过氧化和蛋白质过氧化的敏感指标, 其含量能客观反映机体氧化损伤的程度[29,30], 本研究结果表明中低强度的训练对MDA和蛋白质羰基有降低作用。CAT和GSHPX对H2O2的清除具有重要作用, H2O2在体内积累过多会对机体产生毒害, 本研究中训练组H2O2含量均出现了不同程度的上升, 但MDA和蛋白质羰基含量表明H2O2并未对机体造成氧化损伤, 说明运动中产生的大量H2O2被活性增强的CAT和GSH-Px快速清除, 从而保护机体不受损伤。GSH作为主要非酶性抗氧化剂, 可以清除机体内自发或酶促反应产生的活性中间物质, 对机体免疫机能起重要保护作用。在2.0 bl/s强度下GSH含量显著上升, 表明该强度下的训练能有效提高黑鲷抗氧化能力。于丽娟等[31]研究表明运动对中华倒刺鲃GSH含量并无显著影响, 关于运动后GSH含量的变化可能与鱼的种类、习性等有关。LZM在鱼类免疫防御系统中占有重要位置, LZM活性水平高低是评价环境对鱼类非特异性免疫影响的有效参数。研究者发现红鳍银鲫LZM活性随运动强度的增加显著增强[11], 本研究中训练组LZM活性均有上升, 但差异不显著, 原因可能是实验设计的强度还不足以引起LZM活性变化。羟自由基是对机体组织细胞毒性最强的自由基, 可以直接损伤细胞膜。研究发现, 长期运动训练可以有效降低羟自由基含量[32], 本研究同样表明适度的运动可以显著提高黑鲷机体抑制羟自由基能力, 从而显著降低羟自由基含量, 减少肝脏组织细胞氧化损伤。
3.4 不同运动强度对黑鲷肝脏免疫指标的影响
肝脏是鱼体物质代谢和氧化反应的中心, 其功能的正常维持是机体健康的保证[33]。研究表明,有氧运动训练能显著增强肝脏代谢水平和免疫机能[34,35]。研究认为, 当机体自由基含量增加时, 机体自身的抗氧化能力也会随之提升, 以此来抵御氧化损伤。于丽娟[10]的研究结果也支持该结论, 经过运动训练后中华倒刺鲃肝脏T-AOC的含量均有了不同程度的提升, 但各组间差异并不显著。在本研究中, 运动训练对黑鲷肝脏T-AOC并没有显著性影响, 表明黑鲷肝脏总抗氧化能力处于相对稳定的状态。GSH含量、AKP、ACP和CAT活性均随运动强度的增加呈现上升的趋势, GSH对羟自由基、过氧化氢和单线态氧的直接清除作用对保护肝脏生物大分子有重要意义, 肝脏GSH含量的增加表明运动可以增强黑鲷肝脏对自由基的清除能力。在4.0 bl/s流速下肝脏AKP、ACP和CAT活性显著高于对照组, 原因可能是在该强度下训练能促进黑鲷肝脏相关酶的合成或分泌, 从而有利于肝脏代谢机能和抗氧化机能的提升。肝脏MDA含量同样随运动强度升高而增加, 各组间无显著性差异, 表明实验设计的运动强度尚未对黑鲷肝脏造成明显的氧化损伤。
对比分析发现, 运动训练对部分血清和肝脏抗氧化指标均有显著性影响, 血清抗氧化指标在中等强度(2.0 bl/s)已经出现明显变化, 而肝脏抗氧化指标则在高强度(4.0 bl/s)才出现显著变化, 表明不同组织对运动刺激的响应阈值不同, 血清相比肝脏对运动刺激敏感性更强。综合考虑, 在水流强度为2.0 bl/s时, 能显著增加鱼体的血清蛋白含量, 降低血脂水平, 增强机体抗氧化能力。当水流强度为4.0 bl/s时, 运动组实验鱼出现死亡, 虽然机体抗氧化机能有所增强, 但是血糖、血脂水平、GOT和GPT显著上升, 表明在高流速下机体的代谢机能已经受到干扰。结果表明, 在放流前对黑鲷进行适度运动训练(运动强度2.0 bl/s), 有利于增强鱼体健康和抗氧化机能, 提高抵抗力, 从而达到提高增殖放流效果的目的。
参考文献:
[1]Lin J B, Chen T, Chen L, et al. The techniques of Sparus macrocephalus stagged and release in Daya Bay [J].Journal of Fisheries of China, 2001, 25(1): 79—83 [林金錶, 陈涛, 陈琳, 等. 大亚湾黑鲷标志放流技术. 水产学报, 2001, 25(1): 79—83]
[2]Long Z Q. The physiological responses to ammonia stress and vitamin C requirement of juvenile black seabream(Acanthopagrus schlegeli) [D]. Thesis for Master of Science. East China Normal University, Shanghai, 2008 [龙章强. 黑鲷幼鱼对氨氮胁迫的生理响应及其维生素C的营养需求研究. 硕士学位论文, 华东师范大学, 上海.2008]
[3]Cheng J H, Jiang Y Z. Marine stock enhancement: review and prospect [J]. Journal of Fishery Sciences of China, 2010, 17(3): 610—617 [程家骅, 姜亚洲. 海洋生物资源增殖放流回顾与展望. 中国水产科学, 2010,17(3): 610—617]
[4]Li X M. The effect and mechanism of exercise training on growth performance in juvenile Spinibarbus sinensis [D].Thesis for Doctor of Science. Southwest University,Chongqing. 2013 [李秀明. 运动训练对中华倒刺鲃幼鱼生长的影响及其机理研究. 博士学位论文, 西南大学,重庆. 2013]
[5]Cheng H L, Xia D Q, Wu T T. Fatty liver and regulation of lipids metabolism in fish [J]. Chinese Journal of Animal Nutrition, 2006, 18(4): 294—298 [程汉良, 夏德全,吴婷婷. 鱼类脂类代谢调控与脂肪肝. 动物营养学报,2006, 18(4): 294—298]
[6]Huang C H, Xiao T Y, Hu Y, et al. Analysis on research status of fatty liver disease in aquaculture fish [J].Chinese Journal of Animal Nutrition, 2014, 26(7):1715—1722 [黄春红, 肖调义, 胡毅, 等. 养殖鱼类脂肪肝研究现状分析. 动物营养学报, 2014, 26(7):1715—1722]
[7]Anttila K, Jarvilehto M, Manttari S. The swimming performance of brown trout and whitefish: the effects of exercise on Ca2+handling and oxidative capacity of swimming muscles [J]. Journal of Comparative Physiology B,2008, 178(4): 465—475
[8]Hackbarth A, Moraes G. Biochemical responses of matrinxã Brycon cephalus (Günther, 1869) after sustained swimming [J]. Aquaculture Research, 2006, 37(11):1070—1078
[9]Castro V, Grisdale-Helland B, Helland S J, et al. Aerobic training stimulates growth and promotes disease resistance in Atlantic salmon (Salmo salar) [J]. Comparative Biochemistry and Physiology, 2011, 160(2): 278—290
[10]Yu L J. The effects of exercise training on growth, antioxidative ability and immune function in juvenile Spinibarbus sinensis [D]. Thesis for Master of Science, Southwest University, Chongqing. 2014 [于丽娟. 运动训练对中华倒刺鲃幼鱼生长、抗氧化及免疫机能的影响. 重庆, 西南大学. 2014]
[11]Song B L. Effect of water current on swimming activity,growth and ecophysiological aspect of young Barbodes schwanenfeldi [D]. Thesis for Doctor of Science. Jinan University, Guangzhou. 2008 [宋波澜. 水流因子对红鳍银鲫(Barbodes schwanenfeldi)游泳行为、生长和生理生态影响的研究. 博士学位论文, 暨南大学, 广州. 2008]
[12]Ibarz A, Felip O, Fernandez-Borras J, et al. Sustained swimming improves muscle growth and cellularity in githead sea bream [J]. Journal of Comparative Physiology B, 2011, 181(2): 209—217
[13]Brown E J, Bruce M, Pether S, et al. Do swimming fish always grow fast? Investigating the magnitude and physiological basis of exercise-induced growth in juvenile New Zealand yellowtail kingfish, Seriola lalandi [J].Fish Physiology and Biochemistry, 2011, 37(2): 327—336
[14]Huang N Y, Cheng Q Q, Gao L J, et al. Effect of water current and temperature on growth of juvenile Acipenser baeri [J]. Journal of Fisheries of China, 2007, 31(1):31—38
[15]Forster I P, Ogata H. Growth and whole-body lipid content of juvenile red sea bream reared under different condition of exercise training and dietary lipid [J]. Fisheries Science, 1996, 62(3): 404—409
[16]Alcaraz G, Urrutia V. Growth in response to sustained swimming in young montezumae swordtails, Xiphophorus montezumae [J]. Marine and Freshwater Behaviour and Physiology, 2008, 41(1): 65—72
[17]Ghanawi J, Mohanna C, Saoud I P. Effect of continuous water movement on growth and body composition of juvenile Rabbifish, Siganus rivulatus [J]. Journal of The World Aquaculture Society, 2010, 41(5): 834—839
[18]Bengtson D, Willye S, McCaffrey E, et al. Effects of water velocity on conditioning of summer flounder, Paralichthys dentatus, for net pens [J]. Journal of Applied Aquaculture, 2004, 14(3-4): 133—142
[19]Bagatto B, Pelster B, Burggren W W. Growth and metabolism of larval zebrafish: effects of swim training [J].Journal of Experimental Biology, 2001, 204(24):4335—4343
[20]Tan N, Morimoto K, Sugiura T, et al. Effects of running training on the blood glucose and lactate in rats during rest and swimming [J]. Physiology & Behavior, 1992,51(5): 927—931
[21]Zhang L G. On the effects of aerobic-exercise (swimming) on blood glucose, blood lipid and coagulative system in rats [J]. Journal of Beijing Sport University, 2009,32(7): 66—68 [章罗庚. 有氧运动对大鼠血糖、血脂和血液凝固功能的影响. 北京体育大学学报, 2009, 32(7):66—68]
[22]Guo Y, Chen P J, Chen W H. Effect of weight reduction on the somatometric measurements, blood lipid and blood insulin of obese children and adolescents through diet and exercise [J]. Chinese Journal of Sports Medicine, 2011,30(5): 426—431 [郭吟, 陈佩杰, 陈文鹤. 4周有氧运动对肥胖儿童青少年身体形态、血脂和血胰岛素的影响.中国运动医学杂志, 2011, 30(5): 426—431]
[23]Zhao S Y, Lin H Z, Huang Z, et al. Effect of small peptide supplementation at different protein levels on growth performance, digestive enzymes activities, serum biochemical indices and antioxidant abilities of grouper (Epinephelus akaara) [J]. South China Fisheries Science,2016, 12(3): 15—23 [赵书燕, 林黑着, 黄忠, 等. 不同蛋白质水平下添加小肽对石斑鱼生长、消化酶、血清生化和抗氧化能力的影响. 南方水产科学, 2016, 12(3):15—23]
[24]Wang X Y, Wang J Y, Ma J J, et al. Effects of dietary vitamin E and L-carnosine on growth performance, antioxidant status, non-specific immunity and serum biochemical indices in juvenile turbot (Scophthalmus maximus) [J].Acta Hydrobiologica Sinica, 2017, 41(1): 86—96 [王晓艳, 王际英, 马晶晶, 等. VE和L-肌肽对大菱鲆幼鱼生长、抗氧化、非特异性免疫及血清生化指标的影响.水生生物学报, 2017, 41(1): 86—96]
[25]Baba C S, Alexander G, Kalyani B, et al. Effect of exercise and dietary modification on serum aminotransferase levels in patients with nonalcoholic steatohepatitis [J].Journal of Gastroenterology and Hepatology, 2006,21(1): 191—198
[26]Wu K, Huang X S, Jin J N, et al. Effects of feeding with faba bean (vicia faba) on the antioxidant capability and immune functions of grass carp (Ctenopharyngodon idellu) [J]. Acta Hydrobiologica Sinica, 2015, 39(2):250—258 [吴康, 黄晓声, 金洁南, 等. 饲喂蚕豆对草鱼抗氧化能力及免疫机能的影响. 水生生物学报, 2015,39(2): 250—258]
[27]Azizbeigi K, Stannard S R, Atashak S, et al. Antioxidant enzymes and oxidative stress adaptation to exercise training: comparison of endurance, resistance, and concurrent training in untrained males [J]. Journal of Exercise Science & Fitness, 2014, 12(1): 1—6
[28]Shin Y A, Lee J H, Song W, et al. Exercise training improves the antioxidant enzyme activity with no changes of telomere length [J]. Mechanisms of Ageing and Development, 2008, 129(5): 254—260
[29]Baghaieea B, Botelho Teixeirab A M, Tartibianc B. Moderate aerobic exercise increases SOD-2gene expression and decreases leptin and malondialdehyde in middle-aged men [J]. Science and Sports, 2016, 31(3): 55—63
[30]Bioomer R J, Davis P G, Consitt L A, et al. Plasma pro-tein carbonyl response to increasing exercise duration in aerobically trained men and women [J]. International Journal of Sports Medicine, 2007, 28(1): 21—25
[31]Yu L J, Li X M, Yi J H, et al. Effects of different water velocities on the free radical metabolism of juvenile Spinibarbus sinensis [J]. Journal of Fishery Sciences of China,2014, 21(1): 101—107 [于丽娟, 李秀明, 易建华, 等. 不同水流速度对中华倒刺鲃幼鱼自由基代谢的影响. 中国水产科学, 2014, 21(1): 101—107]
[32]Farhata F, Dupasa J, Ameranda A, et al. Effect of exercise training on oxidative stress and mitochondrial function in rat heart and gastrocnemius muscle [J]. Redox Report, 2015, 20(2): 60—68
[33]He J J, Wang P, Feng J, et al. Effects of replacing fish meal with corn gluten meal on the growth, serum biochemical indices and liver histology of large yellow croaker Larimichthys crocea [J]. Acta Hydrobiologica Sinica, 2017, 41(3): 506—515 [何娇娇, 王萍, 冯建, 等.玉米蛋白粉替代鱼粉对大黄鱼生长、血清生化指标及肝脏组织学的影响. 水生生物学报, 2017, 41(3): 506—515]
[34]Tung B T, Rodriguez-Bies E, Thanh H N, et al. Organ and tissue-dependent effect of resveratrol and exercise on antioxidant defenses of old mice [J]. Aging Clinical and Experimental Research, 2015, 27(6): 775—783
[35]Radak Z, Chung H Y, Goto S. Systemic adaptation to oxidative challenge induced by regular exercise [J]. Free Radical Biology and Medicine, 2008, 44(2): 153—159

