胆碱能通路损伤在脑白质病变后认知障碍中的作用
王诗男,贾伟丽,冯丽,陈红燕,石庆丽,李越秀,张玉梅
1.首都医科大学附属北京天坛医院神经内科,北京市100050;2.河北燕达医院神经内科,河北廊坊市065201
脑白质病变(cerebral white matter lesions,WML)多见于中老年人,被认为是血管性认知障碍(vascular cognitive impairment,VCI)的主要影像学表现之一[1]。脑内胆碱能通路(cholinergic pathway,CP)是参与学习、记忆、情感等认知活动的重要结构基础[2-3],从Meynert底核发出的胆碱能神经元,经过外囊、放射冠、半卵圆中心,广泛投射到杏仁核、海马、皮层,这些部位最易受WML影响[4]。脑白质改变(white matter change,WMC)与年龄相关,脑白质高信号(white matter hyperintensities,WMH)在老年人脑MRI的质子像和T2加权像中常见,被认为与认知障碍、步态障碍和抑郁症状等相关[5]。一些学者提出基于影像学检查的评测量表,以评价白质疏松程度和范围。胆碱能通路高信号量表[6](cholinergic pathways hyperintensities scale,CHIPS)是经典的半定量评估MRI中CP损伤的方法,可以反映颅内CP结构损伤程度。
当前对WML发病机制的研究集中在慢性低灌注、脑小血管自动调节能力障碍、血脑屏障通透性增高血浆蛋白渗漏等方面,CP破坏也被认为与WML所致的认知下降有关[7]。WML往往造成不同认知领域受损[7];CP中不同部位WML造成的认知损伤类型也不尽相同,其特点是记忆力相对保留,出现注意力和执行功能障碍[8-9]。WML可能是通过破坏脑内CP造成认知下降。但CP损伤与认知受损程度之间的关系,尤其是与某些特定认知领域受损的关系,值得进一步探讨。
1 资料与方法
1.1 一般资料
2016年3月至2017年12月在北京天坛医院门诊就诊及住院患者115例。
纳入标准:①年龄50~80岁;②小学及以上文化程度;③无心脏起搏器、神经刺激器、人工金属心脏瓣膜、体内顺磁性金属异物、严重幽闭恐怖症、重度高热等MRI禁忌症;④汉密尔顿抑郁量表(Hamilton Depression Scale,HAMD)<8分、汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)评分≤7分;⑤签署知情同意书。
排除标准:①伴影响神经心理检查疾病,如听力、视力严重障碍,失语,优势侧偏瘫等;②先天精神发育迟缓或严重焦虑抑郁状态及其他精神疾病史;③并发严重心、肝、肾等重要器官功能衰竭;④孤立关键部位的大面积梗死,阿尔茨海默病、帕金森病、额颞叶痴呆或亨廷顿病等神经系统变性病引起的认知功能障碍;⑤其他病因导致的认知功能障碍,如中枢神经系统创伤、肿瘤、感染、代谢性疾病,正常压力脑积水,叶酸、维生素B12缺乏,甲状腺功能低下等;⑥癫痫或特殊药物服用史,或过去6个月内确定为酒精或药物依赖。
脱落标准:①MRI扫描未完成或头动大于3 mm,影响图像效果;②研究过程中出现病情变化,或未完成认知功能量表评分。
本研究涉及的患者研究内容经北京天坛医院伦理委员会审查,符合国际赫尔辛基宣言和国家《涉及人的生物医学研究伦理审查办法》的要求。
1.2 方法
符合条件的患者行MRI,影像资料由专业神经影像科医生判读是否存在WML。诊断WML的标准[5]为T2加权像或液体衰减翻转恢复序列(fluid-attenuated inversion-recovery,FLAIR)检测到脑白质信号增强区域或CT扫描显示的低密度区域,多集中分布于脑室周围(紧邻脑室系统)和深部WMH(位于皮质下区域且不与脑室相邻)。
1.2.1 基本临床数据采集
所有入组患者均在入组当日收集基本临床资料,包括年龄、性别、既往病史(糖尿病、高血压病、脂蛋白代谢紊乱、脑血管病、房颤)、吸烟、饮酒、运动、体质量指数(body mass index,BMI)等。
1.2.2 认知行为评估
由经过专业培训的神经内科医生对患者进行评估。
采用HAMD和HAMA除外焦虑、抑郁状态引起假性认知障碍。
采用Hachinski缺血量表(Hachinski Ischemic Scale,HIS)排除神经系统变性病引起的认知障碍,选择血管性认知障碍者。
采用蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)进行认知功能筛查;对有认知障碍的患者采用临床痴呆评定(Clinical Dementia Rating,CDR)量表进行认知障碍严重程度分类。
使用Stroop色词干扰测验(Stroop Color-Word Test,SCWT)、数字连线测验(Trail Making Test,TMT)、数字符号模式测验(Symbol Digital Modalities Test,SDMT)、言语流畅性测验(Verbal Fluency Test,VFT)进行执行功能测评。
参照美国国立神经病与卒中研究所/瑞士神经科学研究国际协会(National Institute of Neurological Disorders and Stroke-Association International pour Ia Recherche et I'Enseignement en Neurosciences,NINDS-AIREN)的血管性痴呆诊断标准,诊断非痴呆型血管性认知障碍(vascular cognitive impairment of none dementia,VCIND)和血管性痴呆(vascular dementia,VaD)。
根据以上评估结果,将患者分为4组:无WML且认知正常对照(normal control,NC)组35例,WML认知正常(cognitve normal,CN)组41例、VCIND组21例、VaD组18例。NC组及CN组CDR均为0分,VCIND组CDR评分0.5分,VaD组CDR评分1分。
1.2.3 影像学评估
脑MRI资料采集和结果判读由两名影像科专业人员共同完成。所有入组患者于就诊1周内完成脑MRI检查,包括T1加权像、T2加权像、FLAIR序列。采用CHIPS在FLAIR序列上进行CP中白质病变程度的评分。
T1加权像参数:TR 5.9 ms,TE 2.7 ms,反转角8°,矩阵 256×256,视野 256×256×190,层厚1 mm,层间隔0 mm,体素1×1×1 mm,各向同性。
T2加权像-FLAIR参数:TR 4800 ms,TE 280 ms,翻转时间 2800 ms,矩阵256×256,视野256×256×190,层厚1 mm,层间隔0 mm,体素大小1×1×1 mm,各向同性。
CHIPS以人脑CP免疫组化标记为基础,采用MRI重叠分析技术,在第三脑室和侧脑室层面4个横切面像(外囊下部、外囊上部、放射冠、半卵圆中心),将内侧通路(扣带回白质)和外侧通路(外囊和半卵圆中心)被分为10个区域。根据白质病变程度分为3级,正常0分,累及1个区域一半以下者1分,累及1个区域一半以上者计分。
由于胆碱能纤维由下向上投射,并在白质内逐渐分散,予各区域不同的加权系数:外囊下部平面,前部×4,后部×4;外囊上部平面,扣带回×4,前部×3,后部×3;放射冠平面,前部×2,后部×2,扣带回×1;半卵圆中心平面,前部×1,后部×1。左右半球分别积分,各部分评分乘以各自权重后求和得CHIPS总分,4个层面最高100分。
1.3 统计学分析
采用SPSS 22.0统计软件进行数据处理。基本信息中,计量资料经正态性检验,符合正态分布,以(xˉ±s)表示,组间比较采用单因素方差分析;计数资料采用χ2检验;对诸如既往病史等频数小的资料,采用Fisher精确概率法比较两组间差异。显著性水平α=0.05。
多组间MoCA、各项执行功能测验结果、CHIPS评分比较采用两因素方差分析。显著性水平α=0.05。采用多元线性回归排除可能影响MoCA和CHIPS评分的因素,对MoCA及各项执行功能量表评分与CHIPS评分之间的关系行Spearman相关分析。显著性水平α=0.05。
2 结果
2.1 一般资料
各组间年龄、性别、受教育年限、BMI、高血压病、糖尿病、脂代谢紊乱、吸烟、饮酒、脑卒中史、冠心病、房颤方面无显著性差异(P>0.05)。见表1。
2.2 认知行为学
2.2.1 MoCA
4组间MoCA总分有非常高度显著性差异(p<0.001);CN组与 NC组无 显著 性 差异(P>0.05),VCIND组和VaD组MoCA总分显著低于NC组(p<0.001)。见表2。
2.2.2 执行功能
VCIND组和VaD组SCWT、TMT、SDMT、VFT评分均较NC组差(p<0.05)。见表3。
2.3 CHIPS评分与执行功能评分的相关性
WML三组间CHIPS评分有非常高度显著性差异(p<0.001),VCIND组和VaD组CHIPS评分均显著低于CN组(p<0.001)。见表4。
全脑CHIPS评分与各项执行功能量表评分呈负相关(p<0.05);左侧CHIPS评分与各项执行功能量表评分呈负相关(p<0.05),右侧CHIPS评分与部分TMT、VFT评分呈负相关(p<0.05)。见表5。

表1 各组间一般资料比较

表2 各组MoCA总分比较

表3 WML各组执行功能评分比较

表4 各WML组CHIPS评分比较
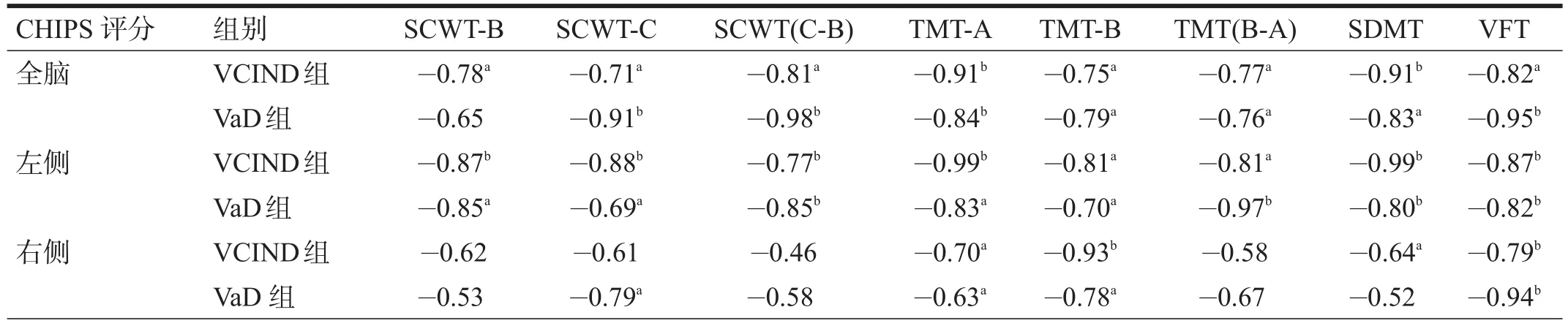
表5 WML认知障碍各组执行功能与CHIPS评分的相关性(r)
3 讨论
本研究将WML患者按认知障碍程度进行分组,对各组的CP及执行功能的特点进行比较,提示WML后造成的执行功能障碍与CP损伤关系密切。
CP是公认与认知功能关系最为密切的神经环路之一[10]。该通路从Meynert基底核神经元发出,内侧通路沿胼胝体周围及深部白质到达扣带回,外侧通路经侧脑室外侧及尾状核、外囊内侧部分到达皮质[11]。CHIPS根据胆碱能纤维在不同部位的分布特点设定权重,评定CP损伤程度有较高特异性[12]。本研究发现,并发认知损伤的WML患者,CHIPS评分较认知正常WML患者增高,提示只有当WML造成胆碱能纤维相当程度损伤时,才会出现认知功能下降。
由WML造成的认知下降属于VCI范畴[13]。VCI早期常有感知觉、执行功能、视空间注意、记忆等初级认知领域损伤[14-15]。也有研究发现[16-17],AD并发脑白质损伤时,CP损伤程度与认知障碍严重程度具有相关性。已有研究发现[18],VCI额叶环路损伤引起的执行功能障碍、动作迟缓、反应迟钝,可伴有或不伴有记忆损伤,且记忆力损伤特点以提取障碍为主。本研究显示,WML并发不同程度认知损伤患者的执行功能均较认知正常患者下降。
VCI患者早期特定认知领域的受损与CP损伤的研究较缺乏[19-20]。WML导致的认知功能下降与皮质-皮质、额叶-皮质下的联络纤维破坏有关[1,21],导致前额叶从上到下的执行功能受损。执行功能属于前额叶皮层的主要功能之一,这种高级认知过程的实现涉及CP中的基底节区、杏仁核、扣带前回、前额叶、边缘系统等多个部位[22-23]。本研究显示,全脑及左侧大脑半球CP损伤与执行功能下降有明确相关性,而右侧大脑半球CHIPS评分仅与部分测验有相关性。提示左侧CP损伤在执行功能障碍中可能起主要作用,这可能与左侧大脑半球为优势半球有关。
由此我们推断,WML可能因为破坏了CP上与执行功能密切相关的一些关键部位,从而导致执行功能下降。
本研究仍存在一定局限性,因病例不足,难以对各组间更多认知领域受损情况展开研究;研究为横断面研究,仍应对患者进行长期临床随访、认知和影像学评估。今后仍需进一步扩大样本数量,对更多认知领域损伤与CP的关系展开研究;对WML并发认知障碍患者的双侧大脑半球CP进行组织结构学改变的研究,有助于深入认识该疾病本质。
[1]Dey AK,Stamenova V,Turner G,et al.Pathoconnectomics of cognitive impairment in small vessel disease:a systematic review[J].Alzheimers Dement,2016,12(7):831-845.
[2]Kim SH,Kang HS,Kim HJ,et al.The effect of ischemic cholinergic damage on cognition in patients with subcortical vascular cognitive impairment[J].J Geriatr Psychiatry Neurol,2012,25(2):122-127.
[3]Kim HJ,Moon WJ,Han SH.Differential cholinergic pathway involvement in Alzheimer's disease and subcortical ischemic vascular dementia[J].JAlzheimers Dis,2013,35(1):129-136.
[4]Park HE,Park IS,Oh YS,et al.Subcortical whiter matter hyperintensities within the cholinergic pathways of patients with dementia and parkinsonism[J].J Neurol Sci,2015,353(1-2):44-48.
[5]Bioti C,Swartz RH,Gao FQ,et al.A new visual rating scale to assess strategic white matter hyperintensities within cholinergic pathway in dementia[J].Stroke,2005,36:2126-2131.
[6]Jang YK,Kwon H,Kim YJ,et al.Early-vs late-onset subcortical vascular cognitive impairment[J].Neurology,2016,86(6):527-534.
[7]何欣.脑白质疏松症伴轻度认知障碍患者的认知障碍特点分析[J].航空航天医学杂志,2016,27(4):441-443.
[8]Wardlaw JM,Smith EE,Biessels GJ,et al.Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J].Lancet Neurol,2013,12(8):822-838.
[9]Knopman DS,Griswold ME,Lirette ST,et al.Vascular imaging abnormalities and cognition:mediation by cortical volume in nondemented individuals:atherosclerosis risk in communities-neurocognitive study[J].Stroke,2015,46(2):433-440.
[10]Kaffashian S,Dugravot A,Elbaz A,et al.Predicting cognitive decline:a dementia risk score vs.the Framingham vascular risk scores[J].Neurology,2013,80(14):1300-1306.
[11]Chubykin AA,Roach EB,Bear MF,et al.A cholinergic mechanism for reward timing within primary visual cortex[J].Neuron,2013,77(4):723-735.
[12]Kimura Y,Sato N,Ota M,et al.A structural MRI study of cholinergic pathways and cognition in multiple sclerosis[J].eNeurologicalSci,2017,8:11-16.
[13]Foster-Dingley JC,Hafkemeijer A,van den Berg-Huysmans AA,et al.Structural covariance networks and their association with age,features of cerebral small-vessel disease,and cognitive functioning in older persons[J].Brain Connect,2016,6(9):681-690.
[14]Jiang H,Wei Y,Shi Y,et al.Altered macular microvasculature in mild cognitive impairment and alzheimer disease[J].J Neuroophthalmol,2017.doi:10.1097/WNO.0000000000000580.[Epub ahead of print].
[15]Li R,Lai Y,Zhang Y,et al.Classification of cognitive level of patients with leukoaraiosis on the basis of linear and non-linear functional connectivity[J].Front Neurol,2017,8:2.
[16]胡蓉,潘小平,杨淞然,等.急性缺血性卒中抑郁-执行功能障碍综合征与胆碱能通路白质病变的关系研究[J].中国卒中杂志,2015,10(9):735-739.
[17]Chen Y,Yan H,Han ZZ,et al.Functional activity connectivity diefferences of five resting-state networks in patients with Alzheimers or mild cognitive impairment[J].CurrAlzheimer Res,2016,13:234-242.
[18]Zhang T,Chen L,Wang Y,et al.Impaired theory of mind in Chinese children and adolescents with idiopathic generalized epilepsy:Association with behavioral manifestations of executive dysfunction[J].Epilepsy Behav,2018,79:205-212.
[19]Richter N,Beckers N,Onur OA,et al.Effect of cholinergic treatment depends on cholinergic integrity in early Alzheimer's disease[J].Brain,2018.doi:10.1093/brain/awx356.[Epub ahead of print].
[20]Mito R,Raffelt D,Dhollander T,et al.Fibre-specific white matter reductions in Alzheimer's disease and mild cognitive impairment[J].Brain,2018.doi:10.1093/brain/awx355.[Epub ahead of print].
[21]Ten Harmsen BL,van Rumund A,Aerts MB,et al.Clinical correlates of cerebral white matter abnormalities in patients with Parkinson's disease[J].Parkinsonism Relat Disord,2017.doi:10.1016/j.parkreldis.2017.12.029.[Epub ahead of print].
[22]Della-Morte D,Dong C,Markert MS,et al.Carotid intima-media thickness is associated with white matter hyperintensities:the Northern Manhattan Study[J].Stroke,2018,49(2):304-311.
[23]Hirsiger S,Koppelmans V,Mérillat S,et al.Executive functions in healthy older adults are differentially related to macro-and microstructural white matter characteristics of the cerebral lobes[J].Front Aging Neurosci,2017,9:373.

