两种体系下诱导多潜能干细胞定向分化为运动神经元前体细胞的差异
李哲,方明珠,陈红,郭钢花,范家宏,毛志娟
1.郑州大学第五附属医院,河南郑州市450052;2.华中科技大学同济医院,湖北武汉市430030
人诱导多潜能干细胞(human-induced pluripotent stem cells,iPSCs)是将特定的多能遗传基因导入体细胞获得的一种类似胚胎干细胞的多能干细胞。相比于胚胎干细胞,iPSCs来源充足,并具有疾病特异性,在多种疾病,如心血管疾病[1]、脊髓损伤[2]、脑卒中[3-4]、神经退行性疾病[5-6]等的研究和治疗中,具有广泛潜能。
运动神经元病是一种选择性侵犯大脑皮层、脑干和脊髓运动神经元的神经退行性疾病,病因不明,目前尚无有效治疗手段。肌萎缩侧索硬化症为最常见的神经退行性疾病,针对该病的细胞疗法已进入临床前期实验,如利用患者体内间充质干细胞(NCT:02917681、02290886、01609283、02881489)和神经干细胞(NCT:02943850、01730716)的移植,利用患者来源iPSCs建立疾病特异性细胞库(NCT:00801333、02574390、00874783)以进行机制研究。在实验室研究中,利用iPSCs分化为特定类型的神经细胞,建立体外细胞[5]或动物模型[7-8]为目前研究热点。
培养iPSCs关键在于维持其未分化及无限增殖的特性,主要为有饲养层培养和无饲养层培养两种方法。有饲养层培养将iPSCs与饲养层细胞共培养,通过饲养层细胞产生的多种因子,维持iPSCs的增殖,且保持其核型正常。但有饲养层培养需频繁制备饲养层细胞以支持iPSCs生长,增加了体外培养的工作量,且饲养层细胞本身可能携带及分泌异源性物质,所培养的干细胞可引发人体免疫排斥,不适于临床应用[9-10],因此无饲养层培养方法逐渐兴起。
无饲养层培养使用细胞外基质促进细胞贴壁,用添加细胞因子的限定性培养基维持干细胞生长。无饲养层培养的最大特点是能够减少或消除饲养层细胞所带来的干扰。
两种培养方法均可维持干细胞体外长期增殖[11-12]。但关于不同培养方法干细胞神经分化特性的研究仍较少,而诱导iPSCs获得高纯度神经细胞是临床及基础研究中的关键步骤。本实验利用有饲养层及无饲养层培养方法,结合Du等[13]的脊髓运动神经元分化方案,利用不同小分子组合,经诱导iPSCs 12 d,定向分化为特定类型的神经前体细胞——脊髓运动神经元前体细胞(motor neuron precursor cells,MNP),并在比较两种体系中的分化效率,为后期优化分化方案提供依据。
1 材料与方法
1.1 材料
iPSCs株由健康成年人外周血通过仙台病毒重编程获得。孕13.5 d CF1小鼠购自上海斯莱克公司。
DMEM/F12、Neurobasal、Knockout血清替代物(Knockout serum substitute,KSR)、N2添加剂、B27添加剂、GlutaMAX、胎牛血清(fetal bovine serum,FBS)、非必需氨基酸(nonessential amino acids,NEAA)、L-谷氨酰胺、胰酶:GIBCO公司。mTeSR1培养基:STEMMCELL公司。DMEM高糖:HYCLONE公司。β-巯基乙醇、抗坏血酸(ascorbic acid,AA)、Dispase、明胶、兔来源HOXA3多克隆抗体:SIGMA公司。重组人碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF):PEPROTECH公司。山羊来源SOX1、SOX2多克隆抗体:RNDSYSTEMS公司。兔来源OLIG2多克隆抗体:MILLIPORE公司。兔来源OCT4抗体:CELL SIGNALING TECHNOLOGY公司。兔来源PAX6抗体:BIOLEGEND公司。二抗均为INVITROGEN公司产品。CHIR99021(CHIR)、DMH1:TORCRIS 公 司 。SB431542(SB)、视 黄 酸 (retinoic acid,RA)、 Purmorphamine(Pur):STEMGENT公司。荧光显微镜:NIKON公司。
1.2 饲养层细胞的制备
取出孕鼠宫内胎鼠,分离全层皮肤组织,用鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)培养基制成单细胞悬液,接种至培养瓶中作为P0细胞。细胞长至80%左右汇合时,1∶3传代。收集对数生长期P6~P10细胞,送辐照中心行γ射线照射。具体制备方法见参考文献[14]。饲养层细胞以3.5×105/孔密度接种至体积分数0.1%明胶溶液包被的6孔板中,培养24 h后接种iPSCs。
1.3 iPSCs在有饲养层体系中的培养
有饲养层体系组成如下。①饲养层细胞:γ射线处理后的MEF。②无血清培养基,成分为78%DMEM/F12+10%KSR+1%NEAA+1 mmol/L Gluta-MAX+0.1 mmol/L β-巯基乙醇,使用时加入20 ng/ml bFGF。iPSCs于37℃、5%CO2培养箱内培养,每天换液。根据细胞生长情况,每5~6天用1 mg/ml Dispase消化传代1次。iPSCs传代时,需用枪头刮去分化严重克隆,保证iPSCs状态良好。
1.4 iPSCs在无饲养层体系中的培养
无饲养层体系组成如下:①细胞外基质matrigel;②限定性培养基mTeSR1培养基。传代前用Matrigel 37℃包被6孔板1 h。选取饲养层上待传代且状态良好的iPSCs克隆,机械切割后接种于6孔板中,换为mTeSR1培养基,37℃、5%CO2培养箱内培养,每天换液。每4~5天用1 mg/ml Dispase消化传代1次。
1.5 MNP细胞的诱导分化
分化过程主要经过以下过程:①iPSCs向神经上皮前体细胞(neuroepithelial progenitors,NEP)分化;②NEP向MNP分化。iPSCs传代第2天记为分化第0天,加入含有小分子化合物CHIR、DMH1、SB的NEP培养基,诱导细胞向神经化尾侧化分化,第6天获得NEP细胞,表达尾侧化神经上皮细胞标记物SOX1、HOXA3;倒置显微镜下观察细胞形态。第6天给予含RA及SHH激动剂Pur的MNP培养基,诱导神经上皮细胞尾侧化和腹侧化,分化第12天获得MNP细胞,表达pMN区标记物OLIG2;倒置显微镜下观察细胞形态变化。
分化基础培养基为47%DMEM/F12+48%Neurobasal+0.5%N2+1%B27+1 mmol/L L-谷氨酰胺+0.1 mmol/L AA;NEP培养基为分化基础培养基+3 μmol/L CHIR+2 μmol/L SB+2 μmol/L DMH1;MNP 培养基为分化基础培养基+1 μmol/L CHIR+2 μmol/L SB+2 μmol/L DMH1+0.1 μmol/L RA+0.5 μmol/L Pur。
1.6 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)
收集分化第6天和第12天细胞,Trizol法提取总RNA并测量浓度,定量5 μg进行逆转录合成cDNA,并稀释10倍。以GAPDH为内参,采用SYBR Green Master Mix荧光染料法行RT-qPCR,检测SOX1、HOXA、PAX6、OLIG2、SOX2、OCT4基因水平。反应条件为95℃预变性10 min,95℃变性30 s,60℃退火 30 s,循环 40 次。所用引物序列见表 1。2-ΔΔCt计算目的基因相对表达量。重复3次,取均值。

表1 RT-qPCR引物序列
1.7 免疫荧光染色及细胞计数
iPSCs在体外培养5代后,行多能性标记物OCT4、SOX2染色;诱导第6天,行SOX1、HOXA3荧光染色;诱导第12天,行OLIG2、OCT4、PAX6荧光染色。
4%多聚甲醛室温固定20 min,0.1%Triton-X-100破膜10 min,驴血清室温封闭1 h,加入适当比例稀释的一抗:SOX1 1∶500、SOX2 1∶40、HOXA3 1∶1000、 OLIG2 1∶ 500、 OCT4 1∶ 500、 PAX6 1∶1000。湿盒中4℃过夜。12 h后弃一抗,加入适当比例稀释的二抗:Alexa Fluor 488标记驴抗山羊lgG 1∶1000、驴抗兔lgG 1∶1000;Alexa Fluor 594标记驴抗山羊lgG 1∶1000、驴抗兔lgG 1∶1000。室温避光处理50 min,加入DAPI核染10 min。甘油封片,荧光显微镜下拍照。每组选两张玻片,每张玻片随机选5个非重叠视野,行阳性细胞和总细胞计数,计算每张玻片平均阳性细胞率。
1.8 统计学分析
采用SPSS 17.0软件进行数据分析。每组数据来自3次独立实验,以(xˉ±s)表示,组间比较采用独立样本t检验。显著性水平α=0.05。
2 结果
2.1 形态学
在有饲养层体系中,iPSCs呈克隆状生长,克隆为圆形或椭圆形,边界清晰;克隆内细胞紧密排列,细胞核大、核仁清晰,核质比较高。无饲养层体系中,iPSCs扁平贴壁生长,形成不规则形细胞克隆;克隆内细胞排列松散,核质比较高。
分化第6天,有饲养层细胞核质比下降,克隆中央细胞堆积增厚,出现早期花环状结构。无饲养层细胞核质比下降,细胞单层致密生长,无特异性结构。

图1 两种体系下培养的iPSCs、NEP和MNP(倒置显微镜,100×)
分化第12天,有饲养层细胞呈长梭形,排列成典型玫瑰花环样结构,细胞呈多层生长,花环中央出现空心结构,花环之间分界清晰。无饲养层细胞同样出现花环结构,细胞呈单层紧密排列,无明显立体结构,花环之间分界较模糊。两种体系下克隆边缘均有未分化单层细胞残留。见图1。
2.2 免疫荧光染色
iPSCs体外培养5代后,均表达多能性抗原SOX2、OCT4(图2)。分化第6天,细胞均表达NEP标记物SOX1及尾侧化标记HOXA3(图3)。分化第12天,细胞均表达MNP相关标记物OLIG2、PAX6,低表达多能性标记物OCT4(图4)。有饲养层细胞SOX1、HOXA3、OLIG2阳性细胞率明显高于无饲养层细胞(p<0.01)。OCT4表达量均极低,且无显著性差异(P>0.05)。见表2。
2.3 相关基因表达
分化第6天,有饲养层培养的NEP细胞SOX1和HOXA3基因表达明显高于无饲养层(p<0.01);分化第12天,有饲养层培养的MNP细胞OLIG2和OCT4表达水平显著高于无饲养层(p<0.001);SOX2和PAX6表达两组无显著性差异(P>0.05)。见表3。

表2 两组细胞标记蛋白阳性细胞率(%)
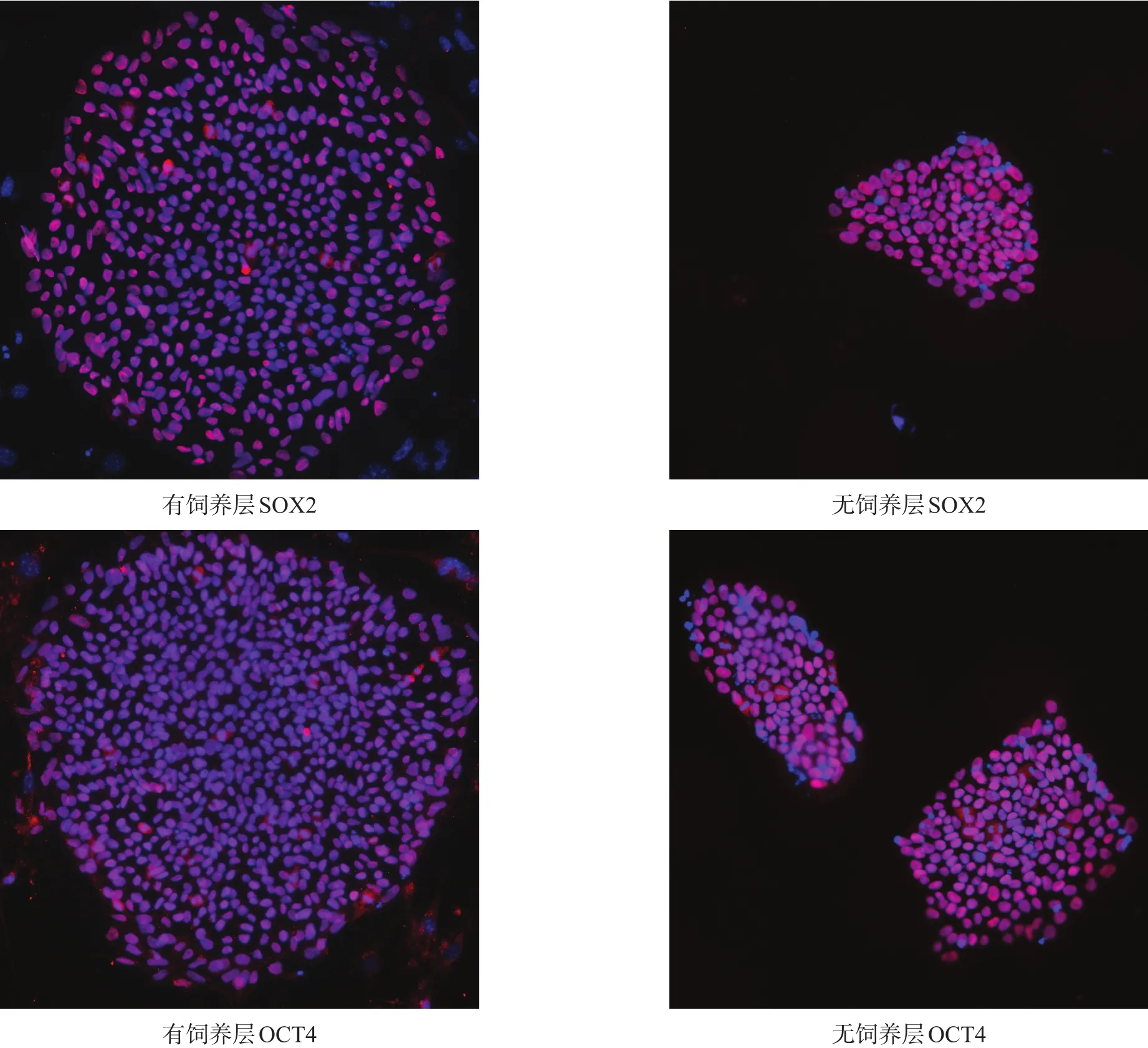
图2 两种体系下培养细胞多能性抗原表达(免疫荧光染色,200×)

图3 两种体系下培养细胞NEP标记抗原表达(免疫荧光染色,200×)
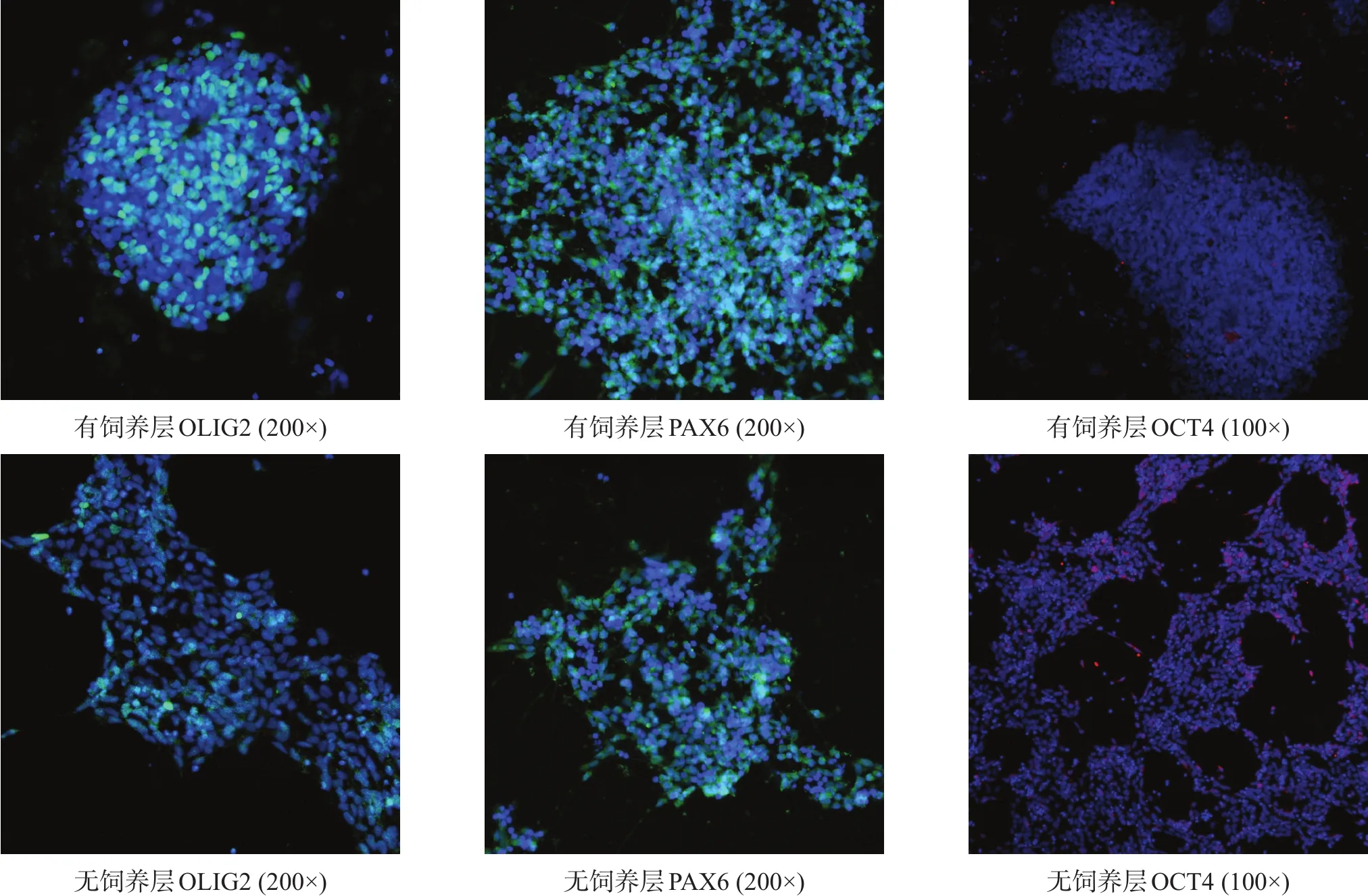
图4 两种体系下培养细胞MNP标记抗原及多能性抗原表达(免疫荧光染色)
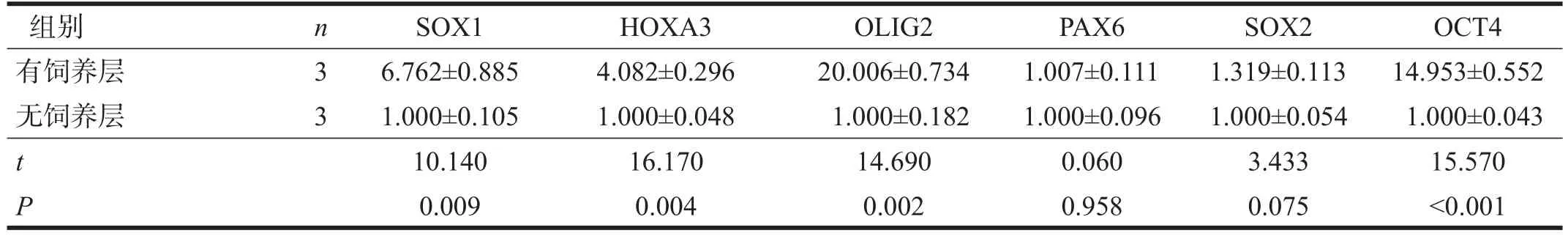
表3 两组细胞相关基因表达比较(2-ΔΔCt)
3 讨论
iPSCs是可以分化为三个胚层的多潜能干细胞,将其分化为特定区域神经元或神经前体细胞,为目前研究热点。
通过小分子可逐步诱导iPSCs向特定区域神经元分化。CHIR为Wnt信号激动剂,DMH1和SB分别为骨形态发生蛋白(bone morphogenetic protein,BMP)及Activin/Nodal通路抑制剂,三者共同作用可诱导细胞向神经尾侧化分化,使细胞表达神经发育早期标志物SOX1及尾侧化标志物HOXA3。
神经发育过程中,pMN区域产生所有的运动神经元[15],Pur为SHH通路激动剂,适当浓度可诱导神经上皮向脊髓腹侧pMN区神经元分化。OLIG2是脊索腹侧pMN区域的重要标记,OLIG2基因敲除后,pMN区域缺失,脊髓运动神经元缺失[16-17]。目前公认OLIG2蛋白为脊髓运动神经元前体细胞特异性标志物。
本研究显示,两种体系下iPSCs均能有效分化为MNP,但有饲养层分化效率更高。Gong等[18]报道,饲养层细胞能分泌白血病抑制因子和bFGF等多种生长因子。MEF较其他饲养层细胞可以更好维持胚胎干细胞正常核型[19],促进神经上皮发生。饲养层细胞作为iPSCs的细胞外基质,也为细胞本身维持和神经发生提供良好微环境,对NEP及MNP的发生起到促进和支持作用。
然而,有饲养层培养体系限制了iPSCs的批量扩增,且引入的动物源性细胞增加免疫排斥风险。Martin等[20]报道,MEF饲养层上培养的人胚胎干细胞可以表达非人源的唾液酸,引起人体免疫应答。目前iPSCs的无异源性培养体系有较多研究[21-23],如利用人血清衍生蛋白代替饲养层细胞,建立无异源性iPSCs培养体系[24]。然而这些体系中所用的蛋白或细胞来源有限,成本昂贵,不利于细胞批量生产,且各种体系下培养的细胞向特定类型细胞的分化效率需进一步研究。
分化过程中,多能标记蛋白OCT4表达下调,有饲养层MNP中OCT4基因转录水平高于无饲养层。OCT4蛋白为细胞多能性标志物,Wnt通路在维持干细胞多能性中发挥重要作用[25],Wnt经典通路中核心蛋白β-Catenin可增强OCT4的活性[26]。而在饲养层不同的培养条件下,人胚胎干细胞Wnt信号起始状态存在差异,可能对细胞分化和相关信号通路的研究结果有较大影响[27]。推测两种体系中Wnt信号通路初始状态的差异,使有饲养层培养细胞后期OCT4转录水平高于无饲养层。
在细胞分化的不同阶段加入小分子化合物组合,可以在有饲养层及无饲养层体系中同时获得特定区域的神经细胞——MNP,且有饲养层体系中分化效率更高。但饲养层细胞增加了后期免疫排斥的概率,不利于细胞移植。无饲养层培养体系减少了异源性细胞的介入,可进行iPSCs的批量扩增及分化。如何利用低或无免疫原性的培养体系获得大量神经前体细胞,仍需进一步尝试。
[1]周云国,曹玲玲,洪葵.诱导性多能干细胞在遗传性心脏病实验研究中的应用[J].中国康复理论与实践,2012,18(11):1047-1048.
[2]Nori S,Okada Y,Yasuda A,et al.Grafted human-induced pluripotent stem-cell-derived neurospheres promote motor functional recovery after spinal cord injury in mice[J].Proc Natl Acad Sci U SA,2011,108(40):16825-16830.
[3]Yuan T,Liao W,Feng NH,et al.Human induced pluripotent stem cell-derived neural stem cells survive,migrate,differentiate,and improve neurologic function in a rat model of middle cerebral artery occlusion[J].Stem Cell Res Ther,2013,4(3):73-83.
[4]杨永轩,郭宗成,贾子善.神经干细胞与脑梗死康复[J].中国康复理论与实践,2007,13(12):1137-1140.
[5]Chen H,Qian K,Du ZW,et al.Modeling ALS with iPSCs reveals that mutant SOD1 misregulates neurofilament balance in motor neurons[J].Cell Stem Cell,2014,14(6):796-809.
[6]Sareen D,O'Rourke JG,Meera P,et al.Targeting RNA foci in iPSC-derived motor neurons from ALS patients with a C9ORF72 repeat expansion[J].Sci Transl Med,2013,5(208):208ra149.
[7]Nizzardo M,Simone C,Rizzo F,et al.Minimally invasive transplantation of iPSC-derived ALDHhiSSCloVLA4+neural stem cells effectively improves the phenotype of an amyotrophic lateral sclerosis model[J].Hum Mol Genet,2014,23(2):342-354.
[8]Sareen D,Gowing G,Sahabian A,et al.Human induced pluripotent stem cells are a novel source of neural progenitor cells(iNPCs)that migrate and integrate in the rodent spinal cord[J].J Comp Neurol,2014,522(12):2707-2728.
[9]Cobo F,Navarro JM,Herrera MI,et al.Electron microscopy reveals the presence of viruses in mouse embryonic fibroblasts but neither in human embryonic fibroblasts nor in human mesenchymal cells used for hESC maintenance:toward an implementation of microbiological quality assurance program in stem cell banks[J].Cloning Stem Cells,2008,10(1):65-74.
[10]Kubikova I,Konecna H,Sedo O,et al.Proteomic profiling of human embryonic stem cell-derived microvesicles reveals a risk of transfer of proteins of bovine and mouse origin[J].Cytotherapy,2009,11(3):330-340.
[11]Desai N,Rambhia P,Gishto A.Human embryonic stem cell cultivation:historical perspective and evolution of xeno-free culture systems[J].Reprod Biol Endocrinol,2015,13(1):9-24.
[12]Villa-Diaz LG,Ross AM,Lahann J,et al.Concise review:The evolution of human pluripotent stem cell culture:from feeder cells to synthetic coatings[J].Stem Cells,2013,31(1):1-7.
[13]Du ZW,Chen H,Liu H,et al.Generation and expansion of highly pure motor neuron progenitors from human pluripotent stem cells[J].Nat Commun,2015,6:6626.
[14]刘尧,杨明,王惠,等.γ射线预处理制备胚胎干细胞滋养层的实验研究[J].医学研究杂志,2010,39(4):33-37.
[15]Ravanelli AM,Appel B.Motor neurons and oligodendrocytes arise from distinct cell lineages by progenitor recruitment[J].Genes Dev,2015,29(23):2504-2515.
[16]Lu QR,Sun T,Zhu Z,et al.Common developmental requirement for Olig function indicates a motor neuron/oligodendrocyte connection[J].Cell,2002,109(1):75-86.
[17]Zhou Q,Anderson DJ.The bHLH transcription factors OLIG2 and OLIG1 couple neuronal and glial subtype specification[J].Cell,2002,109(1):61-73.
[18]Gong J,Sagiv O,Cai H,et al.Effects of extracellular matrix and neighboring cells on induction of human embryonic stem cells into retinal or retinal pigment epithelial progenitors[J].Exp Eye Res,2008,86(6):957-965.
[19]Shah NM,Marchionni MA,Isaacs I,et al.Glial growth factor restricts mammalian neural crest stem cells to a glial fate[J].Cell,1994,77(3):349-360.
[20]Martin MJ,Muotri A,Gage F,et al.Human embryonic stem cells express an immunogenic nonhuman sialic acid[J].Nat Med,2005,11(2):228-232.
[21]Ding Y,Yang H,Yu L,et al.Feeder-free and xeno-free culture of human pluripotent stem cells using UCBS matrix[J].Cell Biol Int,2015,39(10):1111-1119.
[22]Zou Q,Wu M,Zhong L,et al.Development of a xeno-free feeder-layer system from human umbilical cord mesenchymal stem cells for prolonged expansion of human induced pluripotent stem cells in culture[J].PLoS One,2016,11(2):e0149023.
[23]Vuoristo S,Toivonen S,Weltner J,et al.A novel feeder-free culture system for human pluripotent stem cell culture and induced pluripotent stem cell derivation[J].PLoS One,2013,8(10):e76205.
[24]Pijuan-Galitó S,Tamm C,Schuster J,et al.Human serum-derived protein removes the need for coating in defined human pluripotent stem cell culture[J].Nat Commun,2016,7:12170.
[25]Kühl SJ,Kühl M.On the role of Wnt/β-catenin signaling in stem cells[J].Biochim BiophysActa,2013,1830(2):2297-2306.
[26]Kelly KF,Ng DY,Jayakumaran G,et al.β-catenin enhances Oct-4 activity and reinforces pluripotency through a TCF-independent mechanism[J].Cell Stem Cell,2011,8(2):214-227.
[27]邓磊玉,林戈,卢光琇.经典饲养层细胞Wnt表达的差异及其对人胚胎干细胞Wnt/β-Catenin信号通路的影响[J].激光生物学报,2016,25(5):423-430.

