加味脑泰方对卵巢摘除脑缺血大鼠海马细胞外信号调节蛋白激酶1/2和c-Jun氨基末端蛋白激酶蛋白活化的影响
秦莉花,李晟,成邵武,刘林,刘洋,黄娟,龚胜强,程诚,葛金文
1.湖南中医药大学,a.中西医结合心脑疾病防治湖南省重点实验室;b.护理学院;c.管理与工程信息学院,湖南长沙市410208
缺血性脑卒中是指脑组织局部血流灌注减少或完全中断,致使脑组织缺血缺氧,导致局限性脑组织坏死的总称,占脑卒中60%~80%。脑缺血性疾病在全球已成为发病率、死亡率、致残率极高的疾病,并呈持续增长趋势[1-2]。脑缺血后发生一系列联级反应损伤神经细胞,其中神经细胞凋亡是脑缺血造成神经系统损伤的重要机制[3]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是近年来神经细胞凋亡的热点之一[4],其中细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)与细胞增殖、凋亡密切相关,ERK也是神经保护的关键酶之一[5]。抗凋亡治疗成为治疗脑缺血的重要方法之一[6]。
脑泰方以补阳还五汤为基础化裁,临床已证明具有治疗急性脑梗死的作用[7],动物实验也证实脑泰方能保护脑缺血再灌注损伤[8]。加味脑泰方在脑泰方基础上加女贞子、墨旱莲,具有益气养阴、化痰活血的功效。本研究用雌性大鼠模型模拟绝经后脑缺血,观察加味脑泰方对模型大鼠细胞凋亡及ERK1/2、JNK活化的影响。
1 材料与方法
1.1 实验动物
清洁级雌性Sprague-Dawley大鼠40只,鼠龄8周,体质量200~240 g,由湖南斯莱克景达实验动物有限公司提供,合格证号SCXK(湘)2014-0011。动物饲养及动物取材严格遵循实验动物伦理准则和指南相关规定。
1.2 主要试剂与仪器
兔抗大鼠ERK1/2、JNK、磷酸化ERK(p-ERK 1/2)、磷酸化JNK(p-JNK)一抗:北京博奥森公司。山羊抗兔二抗:北京中杉金桥公司。ECL化学发光试剂盒:GE HEALTHCARE公司。TUNEL试剂盒:武汉博士德生物工程有限公司。冰冻切片机:德国LEICA公司。倒置相差显微镜:日本OLYMPUS公司。凝胶成像分析系统:美国BIO-RAD公司。水合氯醛:国药集团。线栓(2636A4):北京西浓科技有限公司。
1.3 药物制备
黄芪20 g、墨旱莲15 g、女贞子10 g、地龙10 g、僵蚕10 g、川芎5 g,由湖南中医药大学湖南省中药粉体与创新药物省部共建国家重点实验室按比例加水煎煮浓缩,冷冻备用。用时取24 g/kg,以生理盐水配成溶液灌胃。17β-雌二醇由湖南中医药大学第一附属医院采购。灌胃容量均10 ml/kg,每天1次。
1.4 动物分组及给药
大鼠编号1~40,从随机数字表第12行第1个数(48)开始,从左向右除以40,余数在1~10者分在假手术组,余数11~20者分在模型组,余数21~30者分在雌激素组,余数31~40者分在加味脑泰方组;分组出现分布不均,以样本数多的假手术组、模型组样本数除以随机数字表中下一个随机数字,再根据余数调整到雌激素组、加味脑泰方组,最终每组各10只大鼠。
动物适应喂养3 d后,模型组、雌激素组、加味脑泰方组行卵巢摘除术;术后11 d,雌激素组、加味脑泰方组每天分别予雌激素0.18 mg/kg、加味脑泰方24 g/kg灌胃,连续3 d,假手术组、模型组予等量生理盐水灌胃;术后14 d,模型组、雌激素组、加味脑泰方组制备脑缺血模型。
1.5 造模方法
参照文献[9]行卵巢摘除术。模型组、雌激素组、加味脑泰方组术前禁食12 h。10%水合氯醛0.35 g/kg腹腔注射麻醉。无菌条件下背部两侧切口约3 cm,扎紧输卵管后切除卵巢。缝合切口。术后第5天开始取大鼠阴道分泌物涂片,每天1次,共5 d,以不出现动情周期反应为造模成功。假手术组背部切口后直接缝合。术后予腹腔注射青霉素每天16万U,共3 d。
采用线栓法[10]制备大鼠脑缺血模型。大鼠卵巢摘除成功,并连续给药3 d后,禁食12 h,于术后14 d以10%水合氯醛0.35 g/kg腹腔注射麻醉,颈正中切口,钝性分离,暴露右颈总动脉,分离颈内动脉、颈外动脉,结扎颈外动脉近心端及远心端。将鱼线插入颈内动脉,深(18.5±0.5)mm,至微感阻力,固定线栓。逐层缝合。脑缺血后24 h采用Longa评分法进行神经功能评分[11],1~3分为模型成功,0分和4分者剔除。假手术组切开皮肤、分离右颈总动脉后缝合。
1.6 TUNEL染色
神经功能评分后,每组随机取5只大鼠,10%水合氯醛350 mg/kg腹腔注射麻醉,消毒后冰盒上分离大脑,取脑组织,多聚甲醛固定,石蜡切片,海马切片行TUNEL染色。常规脱蜡,PBS洗2次;加20 μg/ml不含DNase的蛋白酶K消化30 min,PBS洗2次;加过氧化氢封闭内源性过氧化酶活性,PBS洗2次;加TUNEL反应液100 μl,37 ℃孵育60 min,PBS洗3次;加POD 37℃孵育30 min,PBS洗3次;DAB显色,苏木素复染,脱水,透明,封片,光镜下观察。取5个不重复高倍视野,计数视野中阳性细胞数占总细胞数的百分比,取均值。
1.7 Western blotting
神经功能评分后,另5只大鼠以10%水合氯醛350 mg/kg腹腔注射麻醉,消毒后冰盒中取出右侧海马组织置于液氮冻存,-80℃冰箱保存。按说明书提取蛋白,考马斯亮蓝法检测蛋白质含量。经灌胶、上样、凝胶电泳、转膜后,加入5%TBST-BSA室温封闭1 h,分别加ERK1/2、JNK、p-ERK1/2、p-JNK一抗(均1∶100)和β-actin一抗(1∶500),4 ℃摇床过夜,用TBST室温下脱色摇床洗2次,每次10 min,再用TBS 洗 10 min。 加 入 ERK1/2、 JNK、 p-ERK1/2、p-JNK二抗(均1∶2500),室温孵育1 h,TBST室温脱色摇床洗2次,每次10 min,再用TBS洗10 min。ECL化学发光法显影1 min后,凝胶成像系统扫描成像,以β-actin为内参,用Quantity One软件分析目标条带的相对光密度。计算p-ERK1/2与ERK1/2、p-JNK与JNK的比值,代表ERK1/2和JNK活化程度。
1.8 统计学分析
所有数据用SPSS 22.0统计软件进行处理。各组神经细胞凋亡率及p-ERK1/2、p-ERK1/2蛋白表达采用单因素方差分析及LSD检验。显著性水平α=0.05。
2 结果
2.1 细胞凋亡率
假手术组偶见凋亡细胞,模型组可见较多凋亡细胞,核被染成棕黄色,胞体缩小;雌激素组和加味脑泰方组凋亡细胞数下降。见图1。
与假手术组比较,模型组、雌激素组、加味脑泰方组细胞凋亡率显著升高(p<0.001);与模型组比较,雌激素组、加味脑泰方组细胞凋亡率显著下降(p<0.001);雌激素组和加味脑泰方组海马细胞凋亡率无显著性差异(P=0.973)。见表1。
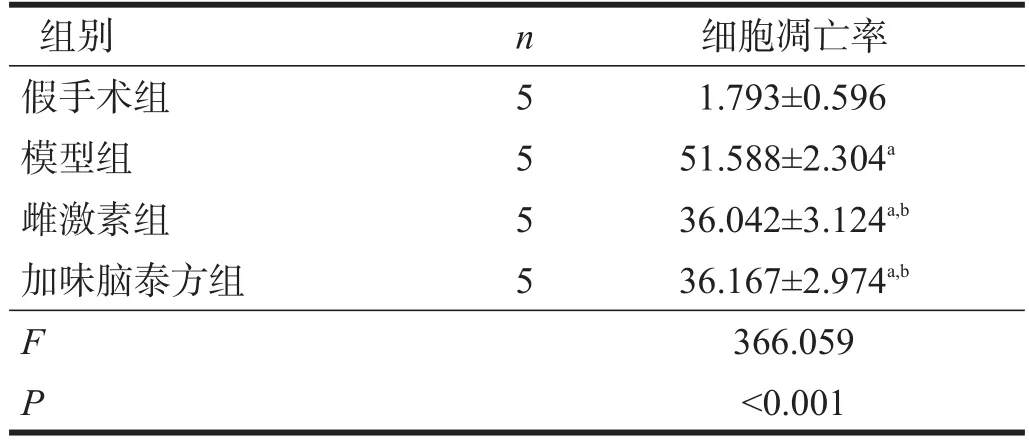
表1 各组细胞凋亡率比较(%)
2.2 p-ERK1/2和p-JNK
与假手术组比较,模型组、雌激素组p-ERK1/2表达显著降低(p<0.001),加味脑泰方组p-ERK1/2表达无显著性差异(P=0.065)。与模型组比较,雌激素组(p<0.01)、加味脑泰方组(p<0.001)p-ERK1/2表达明显升高。与雌激素组比较,加味脑泰方组p-ERK1/2表达显著升高(p<0.001)。见图2、表2。
与假手术组比较,模型组、雌激素组p-JNK表达明显升高(p<0.01),加味脑泰方组p-JNK表达无显著性差异(P=0.088)。与模型组比较,雌激素组、加味脑泰方组p-JNK表达显著降低(p<0.001)。与雌激素组比较,加味脑泰方组p-JNK表达无显著性差异(P=0.193)。见图2、表2。
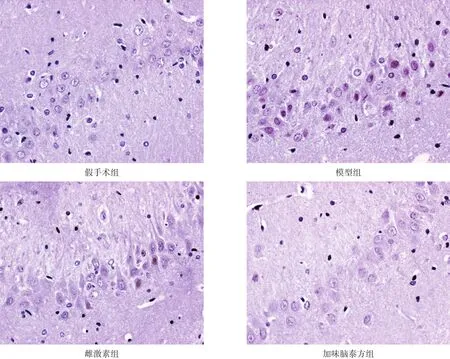
图1 各组大鼠神经细胞凋亡(TUNEL染色,400×)
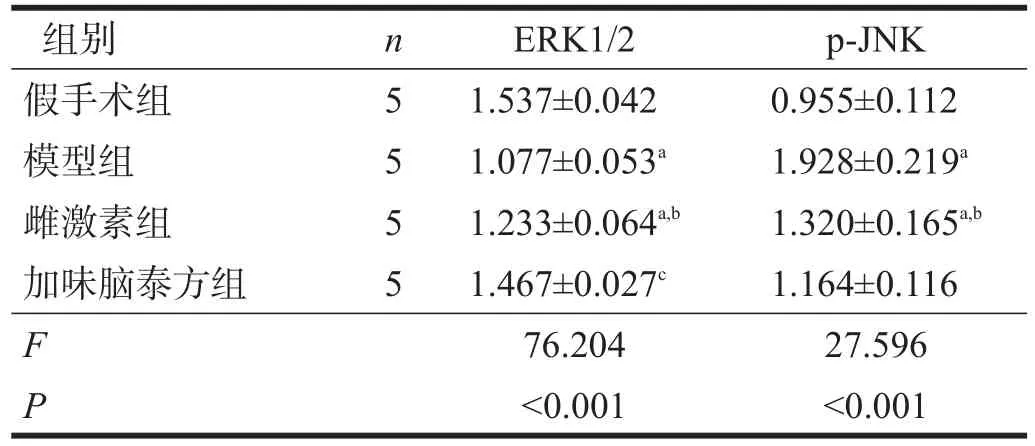
表2 各组海马ERK1/2、JNK活化程度比较
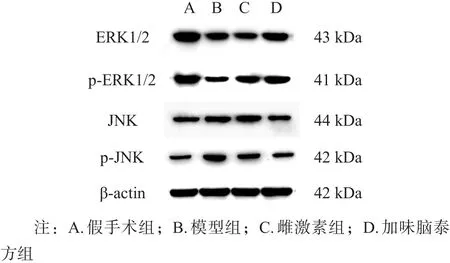
图2 各组海马Western blotting检测结果
3 讨论
凋亡是脑缺血再灌注后神经元死亡的一种重要形式,有研究表明,脑缺血后细胞存活还是凋亡,取决于ERK1/2通路和JNK通路活化的动态平衡[12]。ERK激活保护神经细胞,而JNK激活导致神经细胞凋亡。
ERK1/2可被各种刺激磷酸化激活,p-ERK转入细胞核,进而介导转录因子的转录活化(磷酸化),本身则持续活化,最终促进细胞增殖、凋亡等[13-14]。本研究显示,卵巢摘除脑缺血大鼠ERK1/2活化降低,与部分文献报道一致[15-17],部分文献不一致[18-20]。这可能与ERK通路激活与预适应、上调抗氧化因子转录等保护作用有关[18]。ERK1/2既可促进神经细胞凋亡,也可促进其生长,不同作用取决于激活通路不同[21]。
JNK也可被应激刺激激活,进一步使核内转录因子c-Jun氨基末端63及73位丝氨酸残基磷酸化,进而激活c-Jun,增强其转录活性。本研究显示,卵巢摘除脑缺血大鼠JNK活化升高,与文献报道一致[22]。
加味脑泰方君药黄芪含有黄芪甲苷、黄芪多糖等多种成分,其中黄芪甲苷能抑制脑缺血再灌注后神经细胞凋亡[23],黄芪多糖能缓解脑缺血造成的神经元损伤[24]。川芎嗪是川芎的主要成分之一,具有抗缺血再灌注损伤作用,可能是通过下调JNK信号通路的转导,减轻大鼠海马神经元的损伤[25]。本研究显示,卵巢摘除脑缺血大鼠予加味脑泰方灌胃后,神经细胞凋亡率下降,大鼠海马ERK1/2活化升高、JNK活化降低,提示加味脑泰方通过促进ERK通路、抑制JNK通路,抑制神经细胞凋亡。
加味脑泰方对ERK与JNK信号转导通路作用强度还需进一步应用相应的激活剂或抑制剂进行观察。加味脑泰方调节ERK、JNK通路的具体机制尚需进一步研究。
[1]Meschia JF,Bushnell C,Boden-Albala B,et al.Guidelines for the Primary Prevention of Stroke:A Statement for Healthcare Professionals from the American Heart Association/American Stroke Association[J].Stroke,2014,45(12):3754-3832.
[2]董晓宇,翟志永,佡剑非.FLAIR血管高信号在颈动脉系统短暂性脑缺血发作的意义及相关因素分析[J].中国神经精神疾病杂志,2015,41(8):449-454.
[3]Bauer AM,Bain MD,Rasmussen PA.Chronic cerebral ischemia:where"evidence-based medicine"fails patients[J].World Neurosurg,2015,84(3):714-718.
[4]王巧云,刘凤,吴峰阶,等.人参皂苷Rg1对局灶性脑缺血再灌注损伤大鼠海马p-ERK1/2与p-JNK表达的影响[J].中国中西医结合杂志,2013,33(2):229-234.
[5]Xing L,Larsen RS,Bjorklund GR,et al.Layer specific and general requirements for ERK/MAPK signaling in the developing neocortex[J].eLife,2016,5:e11123.
[6]刘文明,蔡晓旭,赫天辉,等.小鼠脑缺血-再灌注损伤中神经细胞BCL2及p-JNK2的表达[J].宁夏医科大学学报,2016,38(2):148-150.
[7]贺运河,郝晓元,葛金文.脑泰方治疗气虚血瘀证脑梗塞临床研究[J].中国中医急症,2001,10(6):319-320.
[8]钟晴,童骄,钟欣池,等.脑泰方提取物对大鼠脑缺血再灌注损伤后海马神经干细胞增殖及Notch1蛋白表达的影响[J].中华中医药学刊,2016,34(8):1823-1826.
[9]陈奇.中药药效研究思路与方法[M].北京:人民卫生出版社,2005:949.
[10]Garcia JH.A reliable method to occlude a middle cerebral artery in Wistar rats[J].Stroke,1993,24(9):1423.
[11]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[12]邢变枝,陈晖,张苏明.缺血后处理对脑缺血再灌注损伤后ERK1/2和Akt磷酸化及神经细胞凋亡的影响[J].神经损伤与功能重建,2012,7(3):175-179.
[13]Viscoli CM,Brass LM,Kernan WN,et al.A clinical trial of estrogen-replacement therapy after ischemic stroke[J].N Engl J Med,2001,345(17):1243-1249.
[14]Troy CM,Rabacchi SA,Xu Z,et al.beta-amyloid-induced neuronal apoptosis requires c-Jun N-terminal kinase activation[J].J Neurochem,2001,77(1):157-164.
[15]Gladbach A,van Eersel J,Bi M,et al.ERK inhibition with PD184161 mitigates brain damage in a mouse model of stroke[J].J Neural Transm,2014,121(5):543-547.
[16]涂献坤,石松生,杨卫忠,等.齐留通通过激活ERK1/2信号通路减轻大鼠脑缺血炎症反应和缺血性脑损伤[J].中国药理学通报,2014,30(10):1441-1444.
[17]唐强,叶涛,朱路文,等.针康法对脑缺血大鼠神经功能和细胞外信号调节激酶1/2信号通路的影响[J].中国康复理论与实践,2017,23(1):27-31.
[18]Zhu H,Zhu H,Xiao S,et al.Activation and crosstalk between the endoplasmic reticulum road and JNK pathway in ischemia-reperfusion brain injury[J].Acta Neurochir(Wien),2012,154(7):1197-1203.
[19]李嘉瑶,戚基萍.黄芩甙对缺血再灌注损伤的脑保护作用及对MAPKs的影响[J].哈尔滨医科大学学报,2014,48(2):114-118.
[20]林亚平,刘琴,陈楚淘,等.针刺联合亚低温对脑缺血再灌注损伤大鼠脑组织MAPK/ERK通路及凋亡相关因子的影响[J].中南大学学报(医学版),2017,42(4):380-388.
[21]罗玉梅,张立羽,刘芳.细胞外信号调节激酶的研究进展[J].中国生物制品学杂志,2018,31(1):93-96.
[22]吕欣欣,张瑞雪,唐吉友.ERK1/2与ROCK对话调控对脑梗死后神经血管单元的影响[J].国际神经病学神经外科学杂志,2013,40(5-6):456-459.
[23]黄小平,欧阳国,丁煌,等.黄芪甲苷与三七有效成分配伍对小鼠脑缺血再灌注后神经细胞凋亡和内质网应激的影响[J].中草药,2015,46(15):2257-2264.
[24]向艳霞,肖凌云,张菊,等.黄芪多糖治疗神经系统疾病的作用及其机制研究进展[J].中国医院药学杂志,2016,36(8):687-691.
[25]王昀,马武华.川芎嗪对缺氧/复氧海马神经元JNK通路相关蛋白表达的影响[J].实用医学杂志,2015,31(13):2095-2097.

