联合应用A-PRF、i-PRF与牛骨替代材料在牙槽位点保存术的CBCT观察
高 也,孙 勇,赵 峰,陈红亮
继Choukroun等发现并制备第二代血小板浓缩物—富血小板纤维蛋白(plateletsrich-fibrin,PRF)后,Ghanaati等[1]于2014年提出了一种较PRF离心速度较慢、时间较长的改良型富血小板血纤维蛋白(Advanced-plateletsrich-fibrin,A-PRF)。与PRF相比,A-PRF包含更多嗜中性粒细胞、活的祖细胞和血小板,释放更多的生长因子和总蛋白,能促进软硬组织的愈合和再生[2,],但A-PRF在压制成膜的过程中,丧失较多生长因子等活性成分;Carlos等[3]于2015年提出了注射型富血小板纤维蛋白(injectableplateletsrich-fibrin,i-PRF),与A-PRF相比,其离心管内不含二氧化硅促凝成分,离心后是液体形式的血小板产物,较PRF释放更高浓度的各种生长因子和一定量的干细胞,并诱导更高成纤维细胞迁移和PDGF,TGF-β和胶原蛋白-I的表达的能力[3,4],其在体外与A-PRF和牛骨替代材料混合后,能补充和增加A-PRF丧失的生长因子,且能迅速聚合成固体形态,手术操作更简易。
1对象与方法
1.1研究对象 选择2016年11月到成都军区机关医院行下颌磨牙拔牙同期行位点保存的患者16例16个牙位,术前与患者充分沟通,解释所有医疗程序,告知患者手术治疗过程,征得患者同意后签署手术同意书。
1.2病例纳入标准 (1)全身条件良好,排除手术禁忌症;(2)患牙因牙体或牙周疾病需拔除,拔牙窝四周骨壁完整;(3)术前CBCT检测,预手术区无下牙槽神经管穿通情况,与下牙槽神经管间剩余骨板≥2mm;(4)患者预手术区已进行牙周处理,无急性炎症症状,如牙龈明显红肿溢脓等;(5)患者能按期复诊,依从性好;(6)口腔卫生控制良好,无吸烟饮酒等不良嗜好。
1.3主要试剂和器材 离心机 (PC-02,Process,Nice,法国);CBCT(Sirona,德国);A-PRF不抗凝真空玻璃涂层塑料管(Vacuette),i-PRF不抗凝真空玻璃管(Vacuette),PRF工具盒 (Process,Nice,法国);骨替代材料(Bio-Oss,GeistlichPharma,瑞士)。
1.4治疗方法
1.4.1A-PRF制备A-PRF专用管抽取2管肘部静脉血各10mL,立即放入离心机进行离心(1500rmp,14min)制取A-PRF(图1),离心后于无菌超净工作台,PRF工具盒内制备A-PRF膜2张(图2),其中1张A-PRF膜于金属盘中剪成大小约0.8×0.8mm大小的碎屑(图3),与Bio-Oss骨替代材料在金属盘中均匀混合,无菌纱布吸去多余液体成分(图4)另1张浸入压制膜剩余的液体中备用。
1.4.2i-PRF制备i-PRF专用管抽取1管肘部静脉血约7mL,立即放入离心机进行离心(800rmp,3min)制取i-PRF(图5),5ml无菌注射针吸取玻璃管内上层的i-PRF约1mL(图6),备用。
1.4.3A-PRF、i-PRF与骨替代材料混合 助手将注射针内的i-PRF液体缓慢均匀地滴入混合物中(图7),数秒后,混合物聚合(图8),备用。
1.4.4手术开始常规消毒铺巾,术区局部浸润麻醉;翻瓣暴露牙体周围骨边缘及牙槽骨面约3mm,微创拔除患牙,用刮匙去尽残留的炎性肉芽组织;0.5%甲硝唑冲洗术区。将已制取好的聚合物稍施加压力较严密地填入拔牙创骨表面上以填充缺损(图9),填充物以平齐牙槽骨最高骨边缘为宜(图10),牙槽骨吸收较严重的患者,填充物高度应与邻牙高度相当,将另一张A-PRF膜覆盖所有的移植物和暴露骨面(图11~12)。最后,软组织缝合,膜暴露约5.0×5.0mm,手术结束。
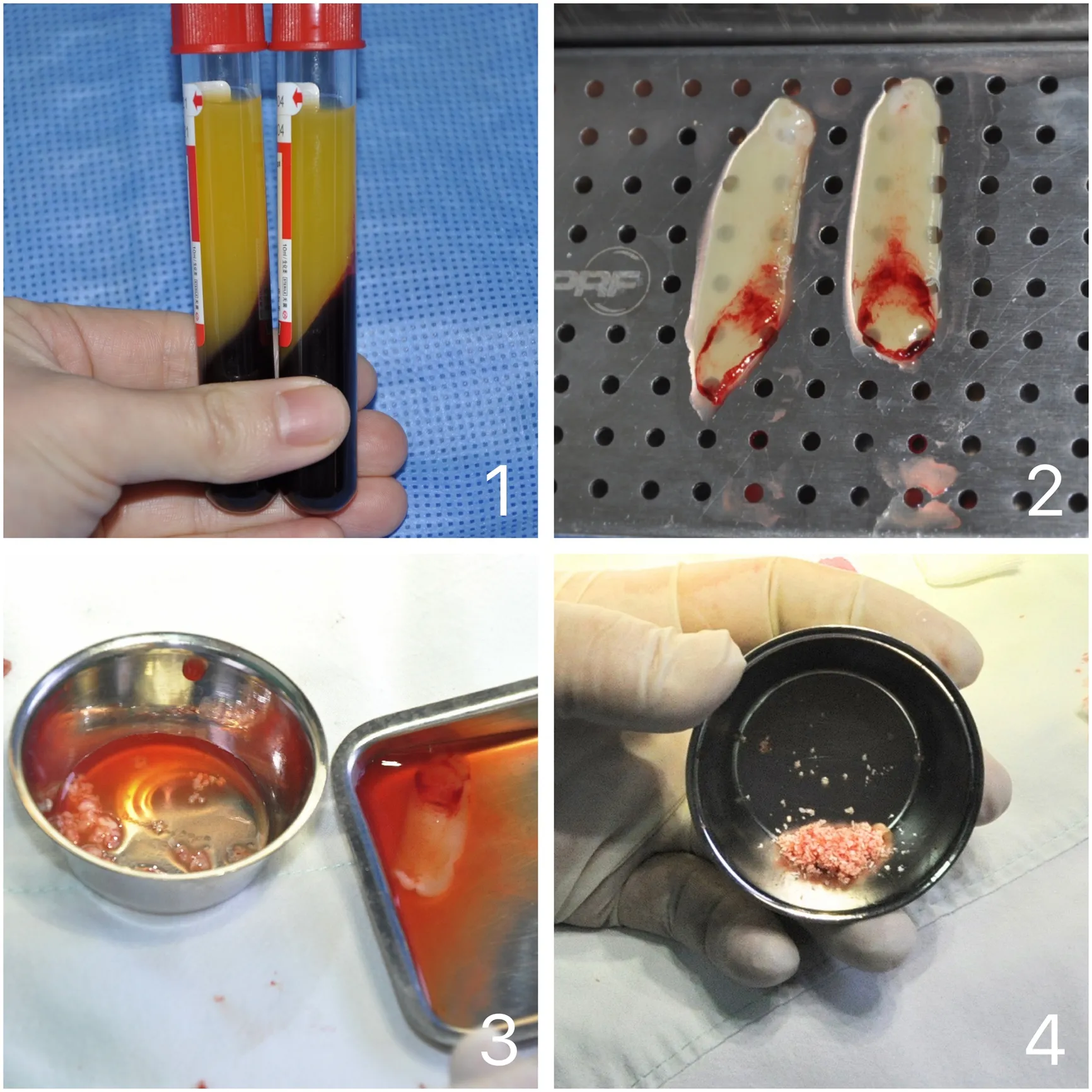
图1:全血离心分为三层,黄色中间层为A-PRF凝胶
图2:制备好的A-PRF膜
图3:制备好的A-PRF膜
图4:制备好的A-PRF和io-Oss骨替代材料混合物
1.5观察指标及判断标准 术后当天和第6个月进行CBCT检查,观察移植区近远中牙槽嵴垂直骨高度和水平骨宽度吸收情况以及移植区骨密度情况,以评价骨再生和牙槽嵴骨吸收情况。
CBCT检测:分别于术后当天及术后6个月行CBCT检查。患者直立体位,检查医师立于患者正前方,调整患者体位,使其听鼻线与地平面平行,面中线与定位线重叠。扫描参数:85kV,28mA,14s,旋转204。。所有影像均使用同一台机器同一参数拍摄,由同一位口腔放射医师完成。使用GALAXIS软件获得影像,分别进行牙槽骨高度和宽度数据测量。骨高度

图5:全血离心分为两层,上层为i-PRF
图6:收集上层i-PRF凝胶
图7:i-PRF凝胶滴入混合物中
图8:制备好的聚合物
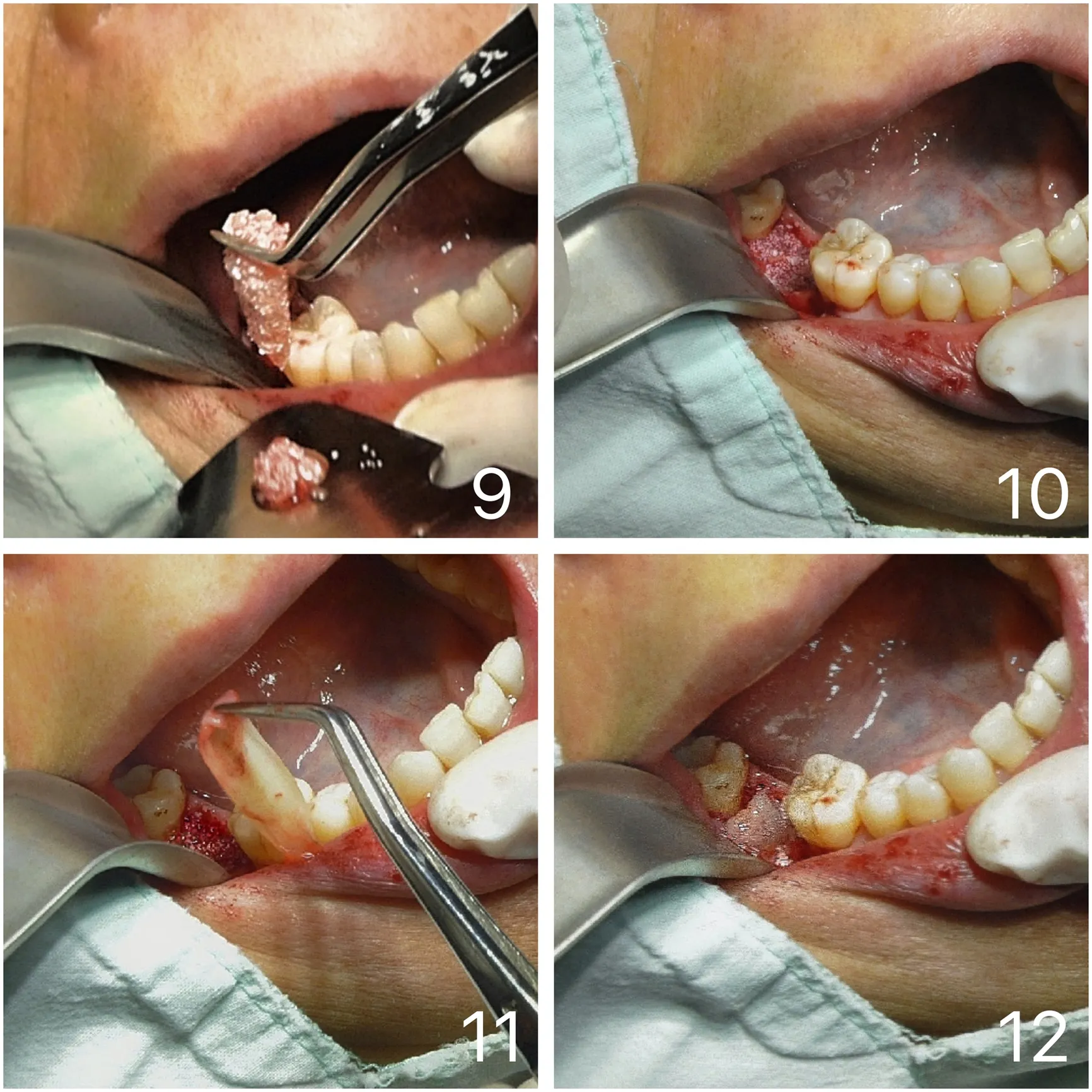
图9~图10:拔牙创内填塞聚合物
和宽度测量参考万永[5]的研究方法。随机选取6个理想层位,采用imageproplus6.0软件分别进行术后当天和术后6个月移植区密度测量分析。图13~16。
1.6统计学方法 采用GraphPadPrism6.0软件对所测数据进行分析,统计描述以均数±标准差表示,组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2结 果
2.1骨吸收情况A、B两组分别在CBCT影像上测量术后当天和术后6个月术区近远中牙槽嵴骨高度和骨宽度,并做统计学分析,得出术后6个月A、B两组术区近远中牙槽嵴平均垂直骨高度吸收测量值分别为(0.50±0.25)mm和(0.51±0.29)mm,近远中牙槽嵴平均水平骨宽度吸收测量值分别为(0.97±0.14)mm和(0.99±0.32)mm,P>0.05,两组差别无统计学意义。
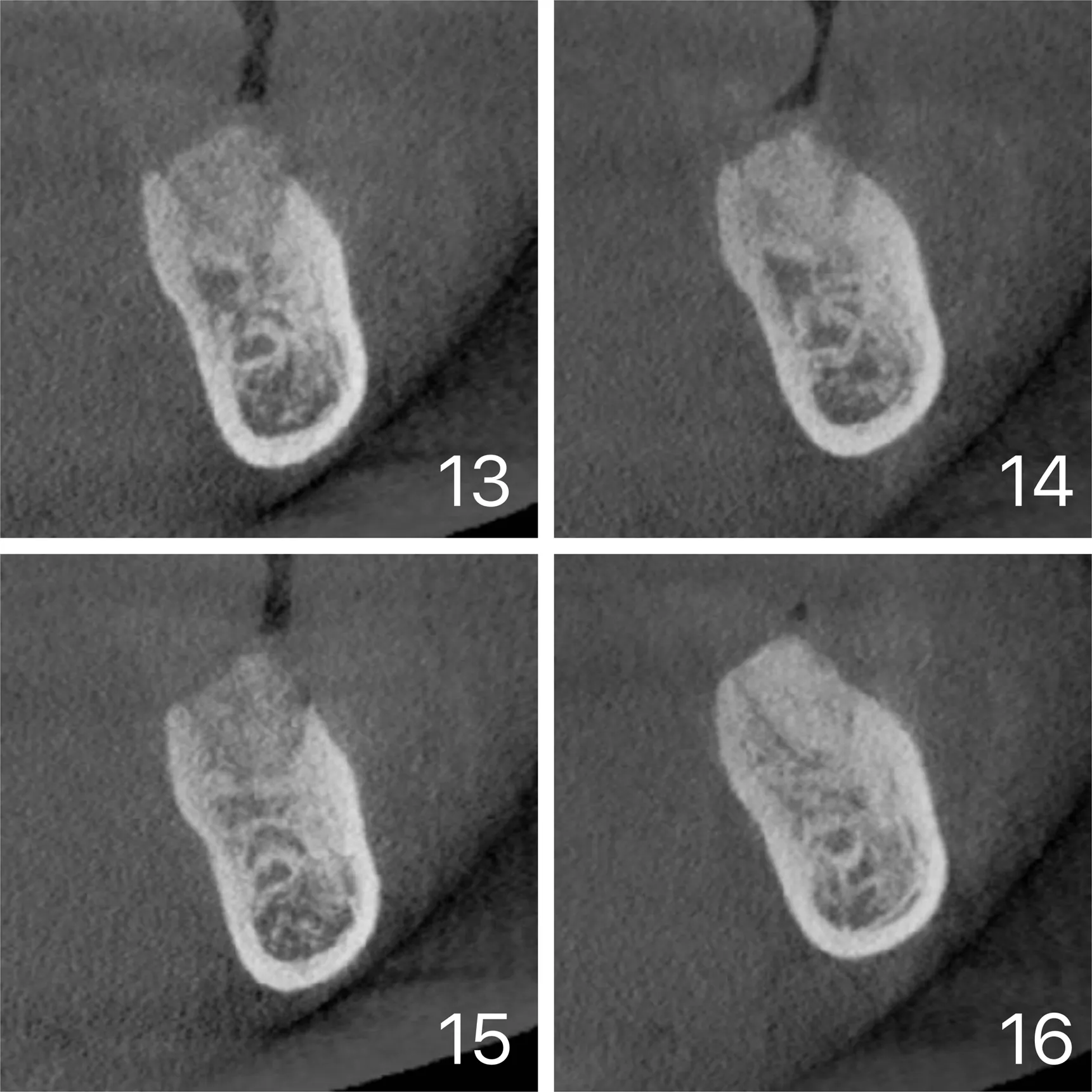
图13~图14:A组术后当天和术后6个月手术
2.2骨再生情况 术后当天与术后6个月分别进行术区骨密度测量,A组分别为(123.92±2.36)和(131.97±0.90),B组分别为(122.87±1.35)和(141.40±1.09);与术后当天相比较,6个月期间平均骨密度增加分别为6.5%和15%,差异具有统计学意义(P<0.05)。
3讨 论
在本研究的位点保存术中,应用成品牛骨替代材料作为支架材料,它是一种较慢吸收的骨替代材料,完全吸收大约需要1~5年,能刚性维持拔牙创的骨缺损区,为成骨提供足够时间和三维空间;其多孔结构能允许血管和新骨长入,较好引导骨再生。在本实验中,两组均应用了这种较慢降解速率的骨替代材料,术后6个月两组术区近远中牙槽嵴平均垂直骨高度吸收测量值分别为(0.50±0.25)mm和(0.51±0.29)mm,近远中牙槽嵴平均水平骨宽度吸收测量值分别为(0.97±0.14)mm和(0.99±0.32)mm,而传统拔牙术后6个月牙槽骨高度和宽度吸收值分别为(0.84±0.62)mm和(3.79±0.23)mm[5-7],两组剩余牙槽骨的吸收程度均明显低于传统拔牙技术导致的骨吸收,达到了良好的位点保存作用,说明在牙槽骨保存技术中,较慢降解速率的骨替代材料维持了骨缺损区的高度和宽度,抵抗了传统拔牙后的骨吸收并引导骨再生,在位点保存中起主要作用。
在成骨的过程中,骨替代材料一方面作为支架材料,另一方面材料的空隙和血小板制品吸收后的空间提供了各种骨细胞及相关生长因子聚集的场所,在成骨期间,骨替代材料在体内环境和破骨细胞作用下吸收降解,由新生骨组织替代,3~4月后新生骨成熟矿化成熟,影像学表现为骨密度增加,骨密度的这种增加表明在移植部位有效的新骨形成,矿化,重塑和成熟[4]。成纤维细胞生长因子(FGF),表皮生长因子(EGF)和血小板衍生的表皮生长因子(PDEGF)[8,9]等生长因子能促进新生骨组织内纤维细胞和肉芽组织的生成,从而促进血管的生成,为骨组织的生成提供营养[10-11]。转化生长因子-b(TGF-b),胰岛素样生长因子-1(IGF-1),血小板衍生生长因子(PDGF)等促进成骨细胞的增殖与矿化结节形成。
本研究中应用了一种新型的牙槽骨缺损填充物,即将A-PRF、i-PRF和Bio-Oss骨替代材料混合制备复合物,A-PRF和i-PRF通过增加生长因子例如TGF-b、IGF-1、PDGF,血管内皮生长因子(VEGF),FGF、EGF、PDEGF,A-PRF和i-PRF联合应用后其生长因子含量大于单独应用A-PRF血液制品,结果观察到联合应用A-PRF和i-PRF复合组移植区平均骨密度增加值明显高于单独应用A-PRF组,表明生长因子的增加有助于新骨的形成和矿化成熟。本课题组前期的研究已证实A-PRF能促进骨组织骨小梁的生成,在更短的时间内成骨,且新生骨在组织学上和生物力学性能均优于不使用血小板制品或历代血小板制品[9-10]。i-PRF的加入能弥补A-PRF在压制成膜的过程中丢失的生长因子等活性成分,且能与骨替代材料聚合,生成更易操作的块状,联合应用于位点保存术中,能有效保存了牙槽骨的剩余骨组织骨高度及骨宽度的同时,促进骨缺损区血管再增殖与生成,促进骨再生修复,在本实验中得出的结果也与之前的实验结果相统一。
在移植物及骨暴露区上覆盖A-PRF膜,一方面起到屏障膜的作用,另一方面能促进软组织的早期愈合和软组织缺损的再生,这一问题本课题组的相关临床及动物学研究也已进行了证实。但i-PRF进入临床时间较短,其相关临床和实验研究较少,其生物性能有待进一步研究。
4结 论
牙槽位点保存术中,联合应用A-PRF、i-PRF及牛骨替代材料的新方法,操作更简易,能有效保存拔牙位点的骨高度和宽度;具有高浓度生长因子的A-PRF和i-PRF能有效促进移植区更快更好地形成骨组织,联合应用效果最佳。
[1]GHANAATIS,BOOMSP,ORLOWSKAA,etal.AdvancedPlatelet-RichFibrin:ANewConceptforCell-BasedTissueEngineeringbyMeansofInflammatoryCells[J].JOralImplantol, 2014,40(6):679-89.
[2]KOBAYASHIE,FLüCKIGERL,FUJIOKAKOBAYASHIM,etal.ComparativereleaseofgrowthfactorsfromPRP,PRF,andadvanced-PRF[J].ClinicalOralInvestigations, 2016, 20(9):2353-2360.
[3]MOURAOCF,VALIENSEH,MELOER,etal.Obtentionofinjectableplateletsrich-fibrin(i-PRF)anditspolymerizationwithbonegraft:technicalnote[J].RevColBrasCir, 2015,42(6):421-423.
[4]MELEKLN,ETSAIDMM.Evaluationof“AutogenousBioengineeredInjectablePRF-Toothgraft”combination(ABIT)inreconstructionofmaxillaryalveolarridgedefects:CBCTvolumetricanalysis[J].SaudiJournalforDentalResearch, 2016, 8(1).
[5]万永,赵峰,聂国军等.PRF在牙槽嵴位点保存应用中的CBCT观察[J].西南国防医药,2015,25(12):1355-1358.
[6]JUNGRE,PHILIPPA,ANNENBM,eta1.Radiographicevaluationofdifferenttechniquesforridgepreservationaftertoothextraction:arandomizedcontrolledclinicaltrial[J].ClinPeriodontol,2013, 40(1):90-98.
[7]Tan,WL,Wong,TL,WongMC,etalAsystematicreviewofpost-extractionalalveolarhardandsofttissuedimensionalchangesinhumans[J].ClinicalOralImplantsResearch,2012,23(Suppl5): 1-21.
[8]HIDEOM,TOSHIMITSUO,TAISUKEW,etal.Growthfactorandpro-inflammatorycytokinecontentsinplatelet-richplasma(PRP),plasmarichingrowthfactors(PRGF),advancedplatelet-richfibrin(A-PRF),andconcentratedgrowthfactors(CGF)[J].InternationalJournalofImplantDentistry, 2016, 2(1):19.
[9]FUJIOKA-KOBAYASHIM,MIRONRJ,HERNANDEZM,etal.OptimizedPlateletRichFibrinWiththeLowSpeedConcept:GrowthFactorRelease,BiocompatibilityandCellularResponse[J].JournalofPeriodontology, 2015, 88:1.
[10]董露,肖琼,杨琴秋等.富血小板纤维蛋白与胶原膜修复牙龈缺损创面的能力[J].中国组织工程研究,2016,20(16):2340-2346.
[11]付冬梅,肖琼,杨琴秋等.富血小板纤维蛋白新生诱导骨的组织学观察[J].中国组织工程研究,2016,20(7):933-939.

