新辅助化疗联合保乳手术治疗中晚期乳腺癌的临床疗效分析
付 玉,刘砥彬
乳腺癌是指乳腺腺上皮组织的恶性细胞病变,其中99.0%的乳腺癌患者为女性[1]。乳腺癌发病的高危因素包括:乳腺癌家族史、乳腺腺体致密、月经初潮早(<12岁)、绝经期推迟(>55岁)、晚婚、晚育、未哺乳、胸部受过高剂量辐射、长期服用雌激素、长期酗酒及携带与乳腺癌相关的突变基因[2]。该病临床主要表现为乳腺肿块,边缘不规则,非哺乳期乳头溢液,乳头有血液、脓液流出,乳房表面皮肤呈“酒窝样”“橘皮样”改变,乳头出现回缩或抬高状态,腋下可触摸到肿大淋巴结且质硬[3]。发病年龄在25岁以后呈逐渐上升趋势,50~54岁达到高峰。原位乳腺癌无致命危险,但是由于乳腺癌细胞不具有正常细胞的属性,细胞间组织疏松,易分裂、脱落、游离的癌细胞随淋巴液、血液散布全身,发生近端或远端转移,形成局部或大范围扩散。乳腺癌的治疗手段通常为外科手术切除病灶并联合化疗、放疗杀灭体内潜在的癌变细胞[4]。乳腺癌的外科治疗经历了乳腺癌根治术、乳腺癌扩大根治术、乳腺癌改良根治术到乳腺癌保留乳房手术(保乳术)。保乳术在外形上保留了乳房的美观,成为越来越多患者的临床选择。对于具有强烈保乳意向的中晚期乳腺癌患者,先实施新辅助化疗,杀灭肿瘤散播的病灶,使肿瘤体积缩小,降低原发病灶和区域淋巴结临床分期,可达到保乳术的要求[5]。本研究分析了中晚期乳腺癌实施新辅助化疗联合保乳手术的临床效果,旨在为乳腺癌的治疗上提供理论依据,现报道如下。
1 资料与方法
1.1 资料 选取2013-01至2014-12吉林省长白朝鲜族自治县人民医院血液肿瘤科收治的126例中晚期乳腺癌患者的临床资料。均为女性,年龄33~59岁;左侧78例,右侧48例;未绝经69例,绝经57例;有乳房刺痛感27例,患侧肩臂疼痛31例。其中,实施乳腺癌改良根治术的为对照组(n=63),实施新辅助化疗联合保乳手术的为观察组(n=63)。
1.2 资料筛选标准 纳入标准:(1)经病理学诊断确诊为中晚期乳腺癌;(2)初诊结果均不符合保乳术标准;(3)均为单侧乳房病灶;(4)乳房肿瘤生物学行为低度恶性,乳房肿瘤最大直径≤3 cm;(5)通过详细沟通后,患者及家属对手术、化疗、放疗所可能产生的不良反应均表示知情,并自愿接受相应治疗;(6)经伦理委员会讨论后批准本研究,患者同意参与本研究并签订知情同意书。排除标准:(1)男性乳腺癌患者;(2)妊娠期、哺乳期女性;(3)伴有严重的脏器功能损伤者;(4)对本研究应用的药物有过敏史者;(5)不同意参与本研究者。
1.3 方法
1.3.1 对照组 对照组行改良根治术。全麻后,仰卧,肩部垫高,消毒,铺无菌单。取乳房横行梭形切口或竖梭形切口,潜行分离皮瓣,上至锁骨下缘,下至腹直肌前鞘上缘,内至胸骨边缘,外至背阔肌前缘,完整切除肿瘤及周围腺体、脂肪组织及胸大肌筋膜,完整显露并打开腋鞘,探查是否有肿大、质硬及融合淋巴结,消除胸肌间淋巴脂肪组织,沿腋动静脉周围完整清除腋窝淋巴、脂肪组织。彻底止血,检查创腔是否有活动性出血,以无菌氯化钠溶液反复冲洗创腔,于胸前及腋下各留置引流管一枚,分别连接负压袋,缝合,加压包扎。切除标本送检,根据病理结果进行相应的化疗和放疗。
1.3.2 观察组 观察组行新辅助化疗联合保乳手术。化疗方案:TEC(多西他赛+表柔比星+环磷酰胺)方案,多西他赛注射液(H20130565,Aventis Pharma S.A.)药物治疗[6,7]。用药方法:于第1天静脉滴注,一次75~100 mg/m2;治疗量为75 mg/m2,滴注时间1 h。在给予多西他赛前1 d开始服用地塞米松(国药准字H44024841,广东罗浮山国药股份有限公司),16 mg/d,连续服用3 d。给药期间注意监测血细胞计数,当中性粒细胞数目低于5×109/L时,暂停给药,给予相应辅助措施。盐酸表柔比星注射液[国药准字H20093251,辉瑞制药(无锡)有限公司]药物治疗。用药方法:于第1天静脉推注,一次60~120 mg/m2;治疗量,60 mg/m2。注射用环磷酰胺(国药准字H20093393,海正辉瑞制药有限公司)药物治疗。用药方法:于第1天、第8天静脉推注,一次500~1 000 mg/m2;治疗量为500 mg/m2。化疗过程中适当给予止吐、抑酸、健胃等对症支持。以21 d为一个化疗周期,共化疗3~4个周期。
在完成规定的化疗后,通过病灶基线体检、基线影像学评估、乳腺原发灶空芯针活检、胸部计算机X线断层扫描(computed tomography,CT)等一系列检查,评价是否适合实施保乳术。保乳指征为:(1)肿瘤最大直径<3.0 cm,肿瘤位置距离乳晕≥2.0 cm;(2)乳房有适当的美观和体积,肿瘤与乳房比例适当,术后依然能具有较好的外形;(3)患者有强烈的保乳意愿;(4)无散在的多发病灶,无淋巴结肿大和远端转移[8]。
手术方法:根据肿瘤位置做相应的切口,肿瘤位于中上象限做弧形切口,肿瘤位于中下象限做放射状切口。切除肿瘤及其周围2.0 cm范围内的乳腺组织,切缘组织做冰冻病理切片,确定是否有残留癌组织,为阴性者,可结束手术;为阳性者,扩大1.0 cm切除范围,再行病理检查,切缘仍为阳性者,则考虑改良根治术,并行腋窝淋巴结清扫。检查无活动性出血,置引流管,缝合、包扎。根据患者的实际情况给予后续的治疗。
1.4 疗效评价标准 (1)患者治疗结束出院后,进行跟踪随访2年,第1年为3个月/次,之后为6个月/1次。每年对患者进行乳腺、腋窝、颈部、腹部、妇科彩超,胸部CT、肿瘤标志物癌胚抗原(carcino-embryonic antigen,CEA)、 糖链抗原 15-3(chain antigen 15-3,CA15-3),全身骨扫描检查[9]。(2)比较两组的乳房丰富满意度、局部复发率、远端转移率[10];采用生活质量评分(quality of life,QOL)评估其生存质量[11],患者治疗结束出院1年后,对其进行QOL评估,总分为60分,得分越高代表生存质量越好。
1.5 统计学处理 采用SPSS 19.0统计软件行数据处理,计量资料以描述,组间比较采用独立样本t检验;计数资料以频数和率描述,组间比较采用χ2检验,当有1/5及以上的单元格理论频数小于5时,采用Fisher确切概率法,组间临床分期的比较采用Wilcoxon秩和检验,以双侧P<0.05为差异具有统计意义。
2 结 果
2.1 一般资料 对照组63例,年龄33~58岁;肿瘤直径2.5~7.0 cm。观察组63例,年龄34~59,肿瘤直径3.0~7.0 cm。两组在年龄、肿瘤直径、临床分期上相比,差异无统计学意义(P>0.05),具有可比性,见表1。
表1 两组乳腺癌患者一般资料对比
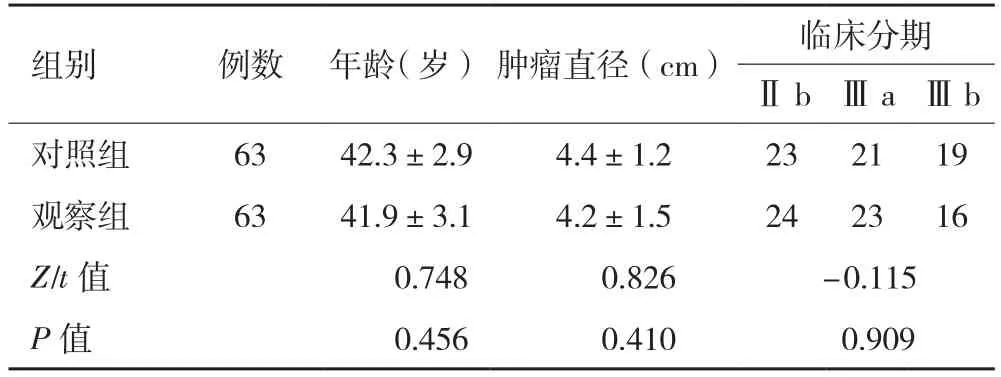
表1 两组乳腺癌患者一般资料对比
注:对照组,改良根治术;观察组,新辅助化疗联合保乳手术
?
2.2 临床疗效比较 观察组乳房丰富满意度、局部复发率、远端转移率远高于对照组,差异均有统计学意义(P<0.05,表 2)。
2.3 生存质量评估比较 治疗前,两组的QOL评分相比,差异无统计学意义(t=1.138,P=0.257);患者治疗结束出院1年后,观察组的QOL评分高于对照组,差异具有统计学意义(P<0.05,表2)。
3 讨 论
女性的乳房不仅提升了女性的外形魅力,同时还承载着哺育下一代的功能。我国的乳腺癌发病平均年龄较西方国家已提前10年[12],可见乳腺癌已对女性的生命健康构成严重威胁,为了增加公众对乳腺癌的认识,国际上将每年的10月份定为乳腺癌防治月,以粉红丝带作为标识,倡导“早预防、早发现、早治疗”的理念,提醒人们关注乳房健康,珍爱生命。
对于已患乳腺癌的女性,手术范围越小,乳房外形损伤越小,对患者身心健康越有利。随着女性对自身外形要求的提升,乳腺癌保乳手术成为越来越多患者的选择,保乳术适用于临床早期,肿瘤直径小于3.0 cm的患者。对于有强烈保乳意愿的中晚期患者,通过有效的新辅助化疗,经临床分析会诊,达到保乳标准,也可实施保乳术[12],但要综合考虑病灶分布、临床分期、病理分型、身体状况等多方面的因素。具有以下症状者,均不适合实施保乳术:病变范围广泛、多中心病灶,弥漫分布的恶性微钙化病灶,难以达到切缘阴性而保留理想的外形;伴有活动性结缔组织疾病,如硬皮病、系统性红斑狼疮,难以忍受放疗;病变范围侵犯乳头,乳腺癌遗传易感性强者,保乳后复发风险值高[13]。在治疗中以清除病灶、消灭癌细胞为主要目标,对外形有强烈诉求者,可后续进行乳房再造。
新辅助化疗即在实施乳腺癌手术前,先给予化疗药物进行全身化疗后再进行外科手术。根据现有的研究成果,新辅助化疗和辅助化疗所获得的临床效果是一致的[14]。新辅助化疗作为中晚期乳腺癌规范的治疗方式,可降低临床分期,使部分初诊不符合保乳术的患者获得保乳的机会,也可使部分不能实施手术的患者获得手术的机会。接受新辅助化疗后,临床上仍有一部分患者会出现疾病进展的可能,故要在每个化疗周期密切关注患者的肿瘤变化情况,若两个化疗周期后肿瘤无变化或增大,应根据具体情况考虑其他方案[15-18]。在新辅助化疗起效后,即使经检查肿瘤完全消失,也要完成规定的后续治疗,包括外科手术,并根据病理结果设计进一步的治疗方案。
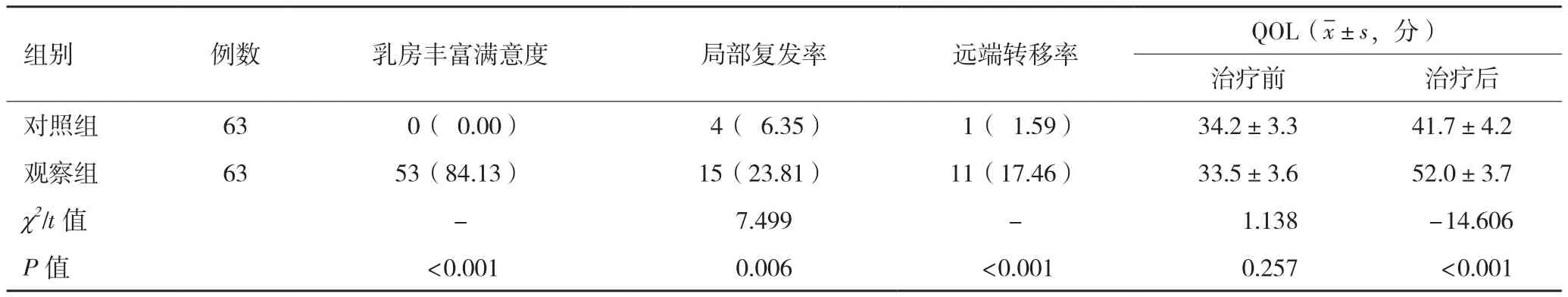
表2 两组乳腺癌患者的临床疗效及QOL评分比较n[(%)]
本研究结果表明,新辅助化疗联合保乳术使患者获得外形上良好的满意度,提升了对外表美观的自信心,但是其局部复发和远端转移的风险也高于改良根治术组。分析其原因,中晚期乳腺癌已有不同程度的腋下淋巴结转移,改良根治术切除范围广,病灶根除彻底,而实施新辅助化疗使病灶缩小或消失,切除范围小,但也留有病灶隐患,后期的复发风险高。这是新辅助化疗联合保乳术的局限性,也是未来临床工作研究方向。在临床工作中,还应根据具体情况,制定合理的治疗方案。总之,新辅助化疗联合保乳术应用于中晚期乳腺癌,并不适用于所有乳腺癌中晚期患者,要经过一系列严格的综合性评定,满足保乳条件方可实施。
[1]Apostoli A J, Skelhorne-Gross G E, Rubino R E,et al. Loss of PPARγ expression in mammary secretory epithelial cells creates a pro-breast tumorigenic environment [J].Int J Cancer, 2014, 134(5): 1055-1066. DOI: 10.1002/ijc.28432.
[2]Sigl V, Penninger J M. RANKL/RANK-From bone physiology to breast cancer [J]. Cytokine Growth Factor Rev, 2014, 25(2): 205-214. DOI: 10.1016/j.cytogfr.2014.01.002.
[3]Arora D, Frakes J, Scott J,et al. Incidental radiation to uninvolved internal mammary lymph nodes in breast cancer [J]. Breast Cancer Res Treat, 2015, 151(2): 365-372. DOI: 10.1007/s10549-015-3400-9.
[4]Lian Z Q, Wang Q, Zhang A Q,et al. A nomogram based on mammary ductoscopic indicators for evaluating the risk of breast cancer in intraductal neoplasms with nipple discharge [J]. Breast Cancer Res Treat, 2015, 150(2):373-380. DOI: 10.1007/s10549-015-3320-8.
[5]张彦收, 刘运江. 乳腺癌手术治疗回顾和进展[J]. 现代肿瘤医学 , 2015, 23(5): 719-723. DOI: 10.3969/j.issn.1672-4992.2015.05.42.
[6]Rico M J, Perroud H A, Mainetti L E,et al. Comparative effectiveness of two metronomic chemotherapy schedulesour experience in the preclinical field [J]. Cancer Invest,2014, 32( 10): 92-98. DOI: 10.3109/07357907.2013.877480.
[7]林 丹. 两种新辅助化疗对乳腺癌临床治疗疗效观察[J]. 中国实用医药, 2016, 11(29): 26-28. DOI: 10.14163/j.cnki.11-5547/r.2016.29.012.
[8]中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2017年版)[J].中国癌症杂志,2017(9): 695-760.
[9]曹志宇, 何建苗, 杨 波. 局部晚期乳腺癌新辅助化疗联合保乳手术的临床疗效观察:附81例报告[J].解放军医学杂志 , 2015, 40(6): 488-491. DOI:10.11855/j.issn.0577-7402.2015.06.14.
[10]李 鹏. 术前新辅助化疗结合保乳术治疗中晚期乳腺癌[J]. 临床军医杂志, 2013, 41(3): 224-226. DOI:10.3969/j.issn.1671-3826.2013.03.03.
[11]刘 洋. 乳腺癌保乳术结合新辅助化疗法治疗乳腺癌疗效观察[J]. 医学理论与实践, 2017, 30(6): 854-855. DOI: 10.19381/j.issn.1001-7585.2017.06.040.
[12]杨万春, 李 庄. 乳腺癌保乳治疗的研究进展[J]. 现代医药卫生, 2015, 31(7): 1004-1007. DOI: 10.3969/j.issn.1009-5519.2015.07.017.
[13]李 武, 张景华. 乳腺癌的外科治疗新进展[J]. 当代医 学 , 2013, 19(4): 27-29. DOI: 10.3969/j.issn.1009-4393.2013.4.015.
[14]李秀清, 周文斌, 潘 虹. 乳腺癌新辅助化疗临床研究进展[J]. 江苏医药, 2016, 42(9): 1053-1055.
[15]赵晚君, 梅振宇. 乳腺癌新辅助化疗的研究进展[J]. 中国肿瘤外科杂志, 2016, 8(4): 270-272. DOI:10.3969/j.issn.1005-3697.2004.02.146.
[16]Tham Y L, Gomez L F, Mohsin S,et al. Clinical response to neoadjuvant docetaxel predicts improved outcome in patients with large locally advanced breast cancers [J].Breast Cancer Res Treat, 2005, 94(3): 279-284. DOI:10.1007/s10549-005-9020-z.
[17]Moon H G, Im S A, Han W,et al. Estrogen receptor status confers a distinct pattern of response to neoadjuvant chemotherapy: implications for optimal durations of therapy [J]. Breast Cancer Res Treat, 2012, 134( 3):1133-40. DOI: 10.1007/s10549-012-2145-y.
[18]Zembutsu H, Suzuki Y, Sasaki A,et al. Predicting response to docetaxel neoadjuvant chemotherapy for advanced breast cancers through genome-wide gene expression profiling [J]. Int J Oncol, 2009, 34(2): 361-370. DOI: 10.3892/ijo_00000159.

