辣蓼黄酮正丁醇部分对脂多糖诱导内毒素血症小鼠的保护作用
谷俐媛,陶俊宇,杨 剑,曾 芸,韦英益,胡庭俊*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西医科大学基础医学院,广西南宁 530021)
目前,内毒素血症与炎症感染仍是医学临床面临的一个重大难题。内毒素血症由革兰阴性菌感染所引起,以败血性休克为标志,常伴发脑、心、肾、肝、肺脏等重要器官的衰竭[1]。革兰阴性菌感染时脂多糖(lipopolysaccharides,LPS)会引起肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白介素1β(interleukin,IL-1β)等初级炎症因子的释放,研究表明在内毒素血症早期抑制此类因子的治疗方法能有效缓解炎症[2]。辣蓼是一种传统的中药,黄酮类化合物为辣蓼的活性成分之一,其抗炎、抗氧化功效与低毒易得的特点受到了广泛的关注,但关于辣蓼总黄酮对内毒素血症保护效果的研究尚未见报道[3]。本试验用酶解-超声偶联法提取辣蓼全草中的总黄酮,并经过萃取分离杂质,结合大孔树脂纯化富集获得辣蓼正丁醇部分黄酮(FNB),前期研究表明在小鼠单核巨噬细胞RAW264.7受到LPS刺激12 h内活性氧(reactive oxygen species,ROS)与一氧化氮(nitric oxide,NO)的释放急剧增多,经FNB处理后1 h能明显减少LPS诱导的ROS和促炎因子TNF-α、IL-1β、IL-6、IL-8释放,有助于降低炎症损伤。为了进一步考察FNB的体内抗炎效果,本试验采用LPS刺激小鼠建立内毒素血症小鼠模型,研究FNB对LPS诱导内毒素血症小鼠的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 80只雄性SPF级昆明株小鼠,体重18 g~22 g,健康,5周龄~6周龄,购自广西医科大学实验动物中心。
1.1.2 受试药物 辣蓼黄酮正丁醇部分(FNB),广西大学动物科学技术学院药理实验室采用酶解-超声偶联法提取后滤液经过石油醚、氯仿、正丁醇萃取。收集正丁醇部分,经XDA-8大孔吸附树脂分离纯化,得辣蓼黄酮正丁醇部分(FNB)。
1.1.3 主要试剂和仪器 脂多糖(大肠埃希菌O55:B5,批号:011M4001V)、胰酶(批号:031M7358V),Sigma公司产品;还原型谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、溶菌酶(lysozyme,LZM)、酸性磷酸酶(acid phosphatase,ACP)、髓过氧化物酶(myeloperoxidase,MPO)、总抗氧化能力(total antioxidant capacity,T-AOC)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)以及丙二醛(malondialdehyde,MDA)试剂盒,南京建成生物工程研究所产品;超纯RNA提取试剂盒,康为世纪公司产品;Prime ScriptTMRT reagent Kit with gDNA Eraser 反转录试剂盒、SYBR Premix ExTaqTMⅡ荧光定量PCR染料,宝生物工程(大连)有限公司产品;EnSpire多功能荧光酶标仪,Perkin Elmer公司产品;CFX 96实时定量PCR仪,BIO-RAD公司产品;Direct-Q 5UV 纯水系统,MERCK MILLIPORE公司产品;ZT-12M生物组织自动脱水机、YB-6LF型生物组织石蜡包埋机、YT-7FB生物组织摊烤片机,孝感市亚光医用电子技术有限公司产品;RM2245轮转式切片机,徕卡显微系统贸易有限公司产品;5418微量离心机,Eppendorf公司产品;制冰机,SANYO公司产品。
1.2 方法
1.2.1 动物分组处理 80只雄性SPF级昆明小鼠,自由饮水与采食,共分为5组:空白对照组、LPS模型组、FNB高、中、低剂量组。FNB的高、中、低剂量组均按(200、100、50 mg/kg)灌胃,空白对照组双蒸水灌胃(10 mL/kg),每日1次,连续给药3 d,最后一次给药1 h 后,空白对照组腹腔注射生理盐水(10 mL/kg)、其他组腹腔注射LPS(17 mg/kg)。各组小鼠于腹腔注射LPS后24 h眼球采血处死,分离受试小鼠的肺、小肠、肝脏。
1.2.2 生化指标与炎症因子的测定 严格按试剂盒说明书,测定肠组织中丙二醛(MDA)含量与髓过氧化物酶(MPO)活力,以及肝组织中总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX) 活性,并用考马斯亮蓝试剂盒测定其总蛋白含量。取各组小鼠血清,测定还原型谷胱甘肽(GSH)含量与溶菌酶(LZM)、酸性磷酸酶(ACP)活力。此外,用ELISA试剂盒测定血清、肠匀浆以及肝匀浆中TNF-α的含量。
1.2.3 组织病理学检测 各组小鼠处死后,取右肺,取回肠、结肠各1 cm~2 cm,福尔马林固定,其余肠组织置-80 ℃冰箱保存备用,固定于40 g/L甲醛溶液中的组织,随后进行石蜡切片及常规HE染色,光学显微镜下观察肠组织病理学改变。
1.2.4 real-time PCR检测肺组织中TNF-α、IFN-α、IFN-γ及IL-2表达量 取分离所得的肺组织按试剂盒说明书提取RNA并对其反转录,对目的基因与内参基因分别用CFX 96实时定量PCR仪(BIORAD)进行PCR扩增,反应体系按荧光定量PCR染料说明书操作,引物见表1。

表1 引物信息
2 结果
2.1 FNB对LPS诱导的内毒素血症小鼠的保护作用
小鼠注射LPS后8 h,扎堆蜷缩,采食量减少或停止,12 h后药物处理组与模型组出现腹泻现象且模型小鼠开始出现死亡,各组小鼠腹泻率与死亡率见表2。
2.2 FNB对LPS诱导的内毒素血症小鼠肠中MDA含量与MPO活力的影响
由图1可知,在LPS刺激下,模型组与空白组相比,肠匀浆MDA含量极显著升高(P<0.01),各剂量FNB能极显著降低肠匀浆中MDA的含量(P<0.01);由图2可知,与空白组相比,模型组的肠匀浆MPO含量极显著升高(P<0.01),FNB各剂量均能极显著降低肠匀浆中MPO的含量(P<0.01)。表明FNB能减轻LPS对小鼠肠道的损伤。
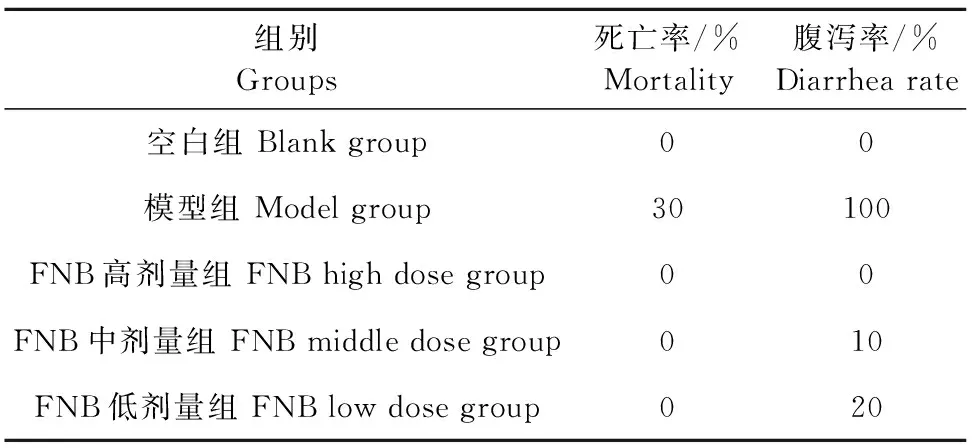
表2 各试验组小鼠死亡率与腹泻率
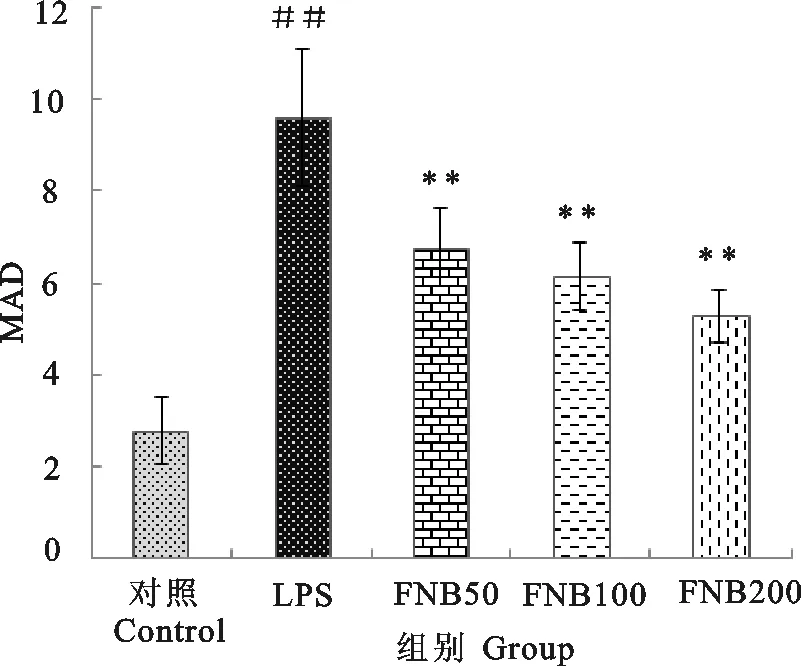
##.表示与空白对照组相比差异极显著(P<0.01);**.表示与LPS组相比差异极显著(P<0.01)
##.Compared with blank control group,extremely significant difference(P<0.01);**.Compared with LPS group,extremely significant difference(P<0.01)
图1 FNB对LPS诱导的内毒素血症小鼠肠中MDA含量的影响
Fig.1 Effect of FNB on MDA content in small intestine of endotoxemia mice induced by LPS

##.表示与空白对照组相比差异极显著(P<0.01);**.表示与LPS组相比差异极显著(P<0.01)
##.Compared with blank control group,extremely significant difference(P<0.01);**.Compared with LPS group,extremely significant difference(P<0.01)
图2 FNB对LPS诱导的内毒素血症小鼠肠中MPO活力的影响
Fig.2 Effect of FNB on MPO activities in small intestine of endotoxemia mice induced by LPS
2.3 FNB对LPS诱导的内毒素血症小鼠肝脏T-AOC、T-SOD、GSH-PX 活性的影响
由图3可知,与模型组相比,高剂量的FNB能显著升高肝匀浆中T-AOC水平(P<0.05)。由图4可知,高、中剂量的FNB能极显著升高肝匀浆中T-SOD水平(P<0.01)。由图5可知,各剂量FNB处理能使肝匀浆中GSH-PX极显著升高(P<0.01)。表明FNB能抑制LPS对小鼠肝脏抗氧化能力的影响。

*.表示与LPS组相比差异显著(P<0.05)
*.Compared with LPS group,significant difference(P<0.05)
图3 FNB对LPS诱导的内毒素血症小鼠肝脏总抗氧化能力(T-AOC)的影响
Fig.3 Effect of FNB on levels of T-AOC capacity in liver of endotoxemia mice induced by LPS

##.表示与空白对照组相比差异极显著(P<0.01);**.表示与LPS组相比差异极显著(P<0.01)
##.Compared with blank control group,extremely significant difference(P<0.01);**.Compared with LPS group,extremely significant difference(P<0.01)
图4 FNB对LPS诱导的内毒素血症小鼠肝脏总超氧化物歧化酶(T-SOD)活力的影响
Fig.4 Effect of FNB on levels of T-SOD activities in liver of endotoxemia mice induced by LPS
2.4 FNB对LPS诱导的内毒素血症小鼠血中GSH、LZM、ACP含量的影响
由图6可知,中剂量与高剂量的FNB处理能极显著升高血中GSH含量(P<0.01);低剂量的FNB处理能显著升高血中GSH含量(P<0.05)。由图7可知,各剂量FNB能极显著升高血中溶菌酶含量(P<0.01)。由图8可知,中剂量与高剂量的FNB处理能显著降低血中酸性磷酸酶的含量(P<0.05)。表明FNB能抑制LPS引起的小鼠炎性损伤,增加小鼠血液抗氧化力与吞噬活力,增强小鼠的炎症抵御力。
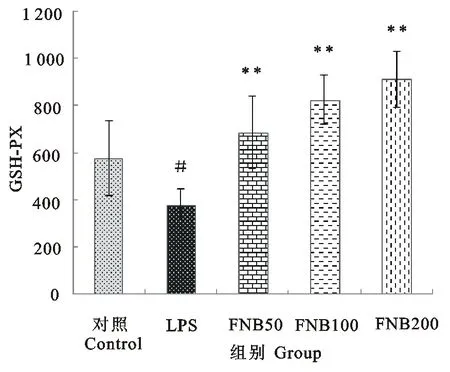
#.表示与空白对照组相比差异显著(P<0.05);**.表示与LPS组相比差异极显著(P<0.01)
#.Compared with blank control group,significant difference(P<0.05);**.Compared with LPS group,extremely significant difference(P<0.01)
图5 FNB对LPS诱导的内毒素血症小鼠肝脏GSH-PX含量的影响
Fig.5 Effect of FNB on levels of GSH-PX activities in liver of endotoxemia mice induced by LPS

*.表示与LPS组相比差异极显著(P<0.05);**.表示与LPS组相比差异极显著(P<0.01)
*.Compared with LPS group,significant difference(P<0.05);**.Compared with LPS group,extremely significant difference(P<0.01)
图6 FNB对LPS诱导的内毒素血症小鼠血中GSH含量的影响
Fig.6 Effect of FNB on levels of GSH in serum of endotoxemia mice induced by LPS
2.5 FNB对LPS诱导的内毒素血症小鼠血浆、肠匀浆及肝匀浆中TNF-α含量的影响
由图9可知,各剂量FNB处理能极显著降低血中TNF-α含量(P<0.01);高剂量FNB处理能极显著降低肠匀浆中TNF-α含量(P<0.01),中剂量FNB处理能显著降低肠匀浆中TNF-α含量(P<0.05)。表明FNB能降低LPS引起的小鼠血、肠、肝中促炎因子TNF-α的生成。
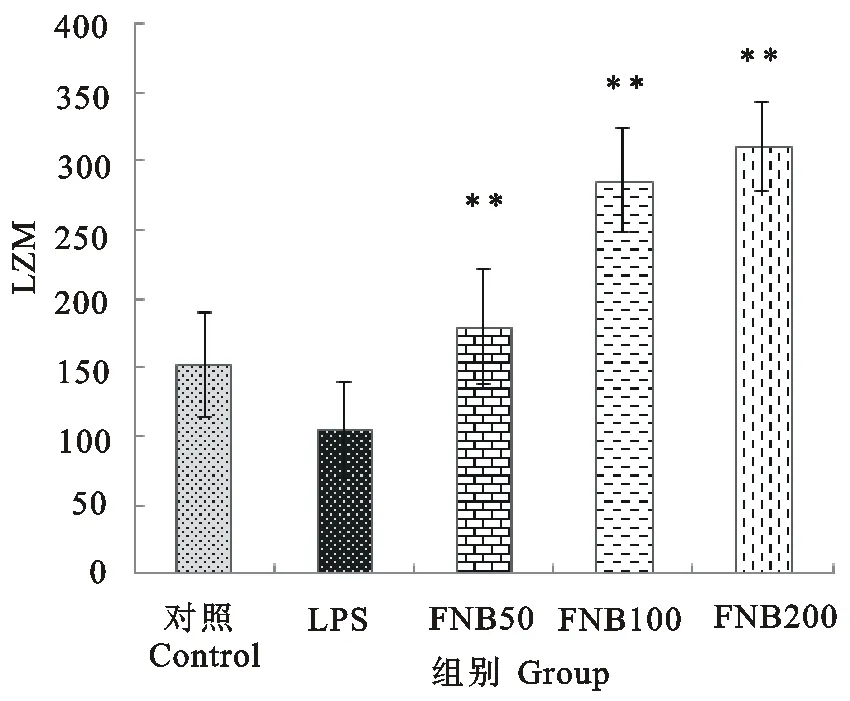
**.表示与LPS组相比差异极显著(P<0.01)
**.Compared with LPS group,extremely significant difference(P<0.01)
图7 FNB对LPS诱导的内毒素血症小鼠血中LZM含量的影响
Fig.7 Effect of FNB on levels of LZM in serum of endotoxemia mice induced by LPS

##.表示与空白对照组相比差异极显著(P<0.01);*.表示与LPS组相比差异显著(P<0.05)
##.Compared with blank control group,extremely significant difference(P<0.01);*.Compared with LPS group,significant difference(P<0.05)
图8 FNB对LPS诱导的内毒素血症小鼠血中ACP含量的影响
Fig.8 Effect of FNB on levels of ACP in serum of endotoxemia mice induced by LPS
2.6 FNB对LPS诱导的内毒素血症小鼠肺脏组织中TNF-α、IFN-α、IFN-γ及IL-2 mRNA表达量的影响
由图10可知,各剂量FNB处理均能极显著降低炎症因子TNF-α、IFN-γ以及IL-2 mRNA的表达水平(P<0.01)。表明FNB能降低LPS引起的小鼠肺组织炎症因子mRNA的表达。

##.表示与空白对照组相比差异极显著(P<0.01);*.表示与LPS组相比差异显著(P<0.05)'**.表示与LPS组相比差异极显著(P<0.01)
##.Compared with blank control group,extremely significant difference(P<0.01);*.Compared with LPS group,significant difference(P<0.05);**.Compared with LPS group,extremely significant difference(P<0.01)
图9 FNB对LPS诱导的内毒素血症小鼠血浆、肠匀浆以及肝匀浆中TNF-α含量的影响
Fig.9 Effect of FNB mortality TNF-α content in serum,liver and intestine homogenates of endotoxemia mice induced by LPS
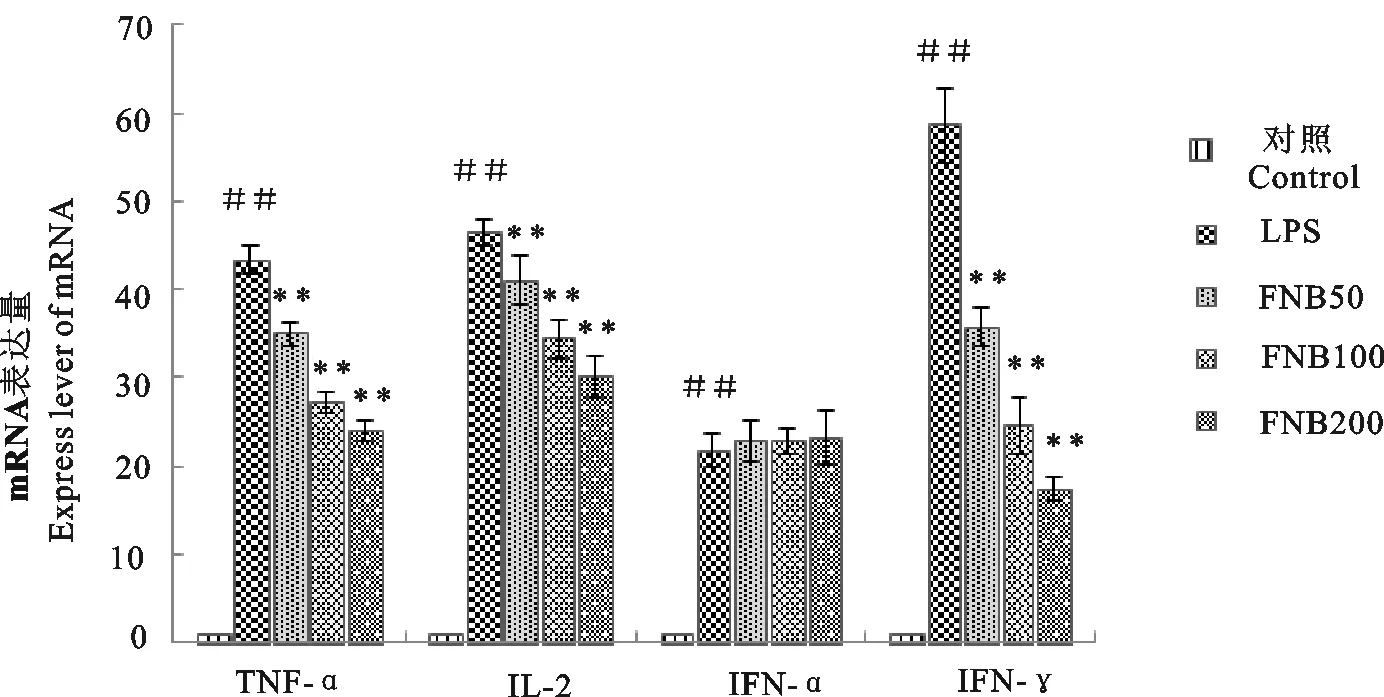
##.表示与空白对照组相比差异极显著(P<0.01);**.表示与LPS组相比差异极显著(P<0.01)
##.Compared with blank control group,extremely significant difference(P<0.01);**.Compared with LPS group,extremely significant difference(P<0.01)
图10 FNB对LPS诱导的内毒素血症小鼠肺脏组织中TNF-α、IFN-α、IFN-γ以及IL-2 mRNA表达量的影响
Fig.10 Effect of FNB on mRNA expression levels of TNF-α,IFN-α,IFN-γ and IL-2 in lung of endotoxemia mice induced by LPS
2.7 FNB对LPS诱导的内毒素血症小鼠回肠、结肠及肺脏组织的保护作用
2.7.1 FNB对LPS诱导的内毒素血症小鼠肺脏组织的保护作用 图11中A、B、C分别为空白组、LPS组、FNB组;模型组与空白组相比肺泡壁明显增厚;出现大量中性粒细胞浸润,并有大面积的渗出液漏出,肺毛细血管充血、出血。FNB组与模型组相比,肺泡壁增厚现象减轻及渗出液漏出现象减轻,中性粒细胞未见减少。
2.7.2 FNB对LPS诱导的内毒素血症小鼠回肠组织的保护作用 图12中A、B、C分别为空白组、LPS组、FNB组。空白组回肠结构完整,可见完整的绒毛;模型组回肠结构出现较大程度的破坏,黏膜下层变薄,出现绒毛大量脱落的现象。FNB高剂量组回肠结构完整,黏膜下层与空白组无差异,可见完整的绒毛。
2.7.3 FNB对LPS诱导的内毒素血症小鼠结肠组织的保护作用 图13中A、B、C分别为空白组、LPS组、FNB组。空白组结肠结构完整;模型组可见结肠结构出现较大程度的破坏;FNB高剂量组结肠结构完整。
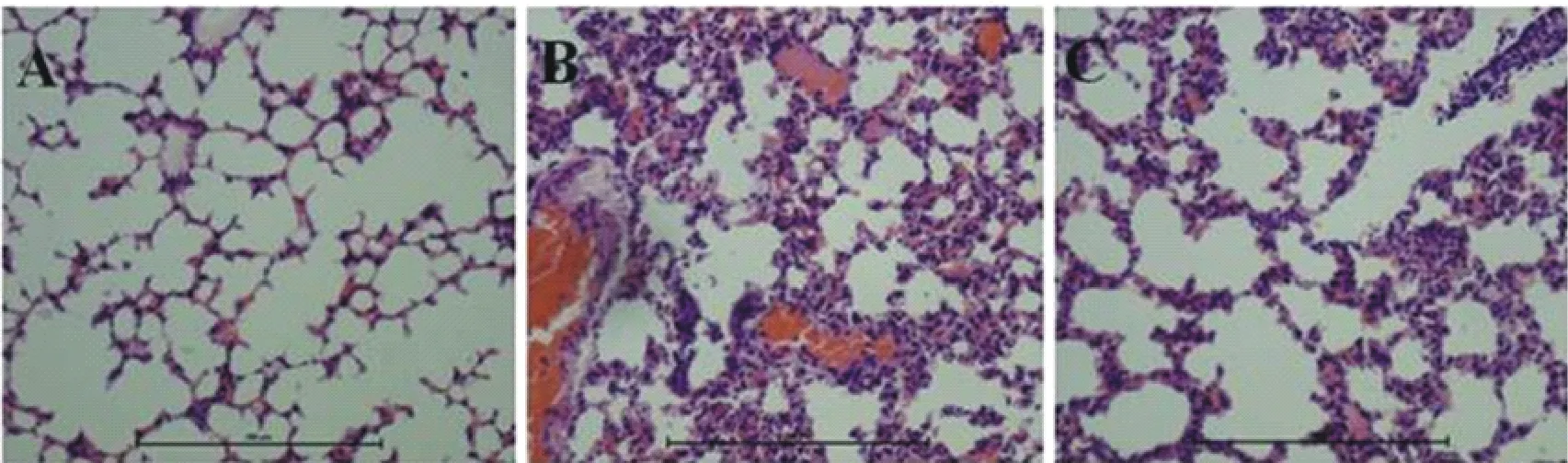
A.空白对照组;B.LPS诱导的内毒素血症模型组;C.FNB处理组
A.Blank control group;B.Model group of endotoxemia induced by LPS;C.FNB treated group
图11 FNB对LPS诱导的内毒素血症小鼠肺脏组织的保护作用(100×)
Fig.11 Protective effect of FNB on lungs of endotoxemia mice induced by LPS(100×)

A.空白对照组;B.LPS诱导的内毒素血症模型组;C.FNB处理组
A.Blank control group;B.Model group of endotoxemia induced by LPS;C.FNB treated group
图12 FNB对LPS诱导的内毒素血症小鼠回肠组织的保护作用(400×)
Fig.12 Protective effect of FNB on ileum of endotoxemia mice induced by LPS(400×)
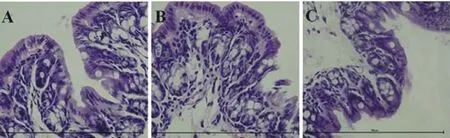
A.空白对照组;B.LPS诱导的内毒素血症模型组;C.FNB处理组
A.Blank control group;B.Model group of endotoxemia induced by LPS;C.FNB treated group
图13 FNB对LPS诱导的内毒素血症小鼠结肠组织的保护作用(400×)
Fig.13 Protective effect of FNB on colon of endotoxemia mice induced by LPS(400×)
3 讨论
内毒素血症是一个复杂的病理过程,研究表明其对机体的损伤是由一系列的氧化应激与炎症反应所造成的[4]。LPS刺激小鼠后,其肠道MDA与MPO活性以及酸性磷酸酶(ACP)含量极显著升高,GSH含量与溶菌酶活性降低;肝脏T-SOD与GSH-PX 活性极显著下降,总抗氧化能力降低;此外,肺脏TNF-α、IFN-α、IFN-γ以及IL-2 mRNA表达水平升高,造成肺组织中性粒细胞浸润,炎性渗出物漏出,肺毛细血管充血出血[5-6]。
在本研究中,经FNB处理后,MDA和MPO以及ACP的含量下降,减轻了LPS对肠道的损伤;小鼠肝脏总SOD水平显著升高,增强了小鼠肝脏总抗氧化能力(T-AOC);肝脏GSH-PX活性及血液中GSH含量显著提高,为清除体内的自由基提供了物质基础。类似的研究表明,在LPS诱导的猪与大鼠败血症模型中,N-乙酰半胱氨酸的抗氧化可降低败血症损伤[7-8];阿魏酸在LPS诱导的大鼠败血症模型中提升GSH-PX、GSH与SOD水平,并降低MDA水平与DNA损伤[9]。因此,表明FNB可通过提升小鼠体内肝脏的抗氧化防御酶促体系的活性从而降低LPS对小鼠机体带来的损伤。
腹腔注射槲皮素与黄豆苷元能显著降低血中TNF-α水平,从而降低LPS诱导的败血症肺损伤[10-11]。用还原型谷胱甘肽(GSH)治疗轮状病毒肠炎合并肝功能异常30例有效,GSH在一定程度上能缓解肠炎[12]。同样的,本研究表明FNB预处理3 d能有效降低血、肝、肠组织中TNF-α的含量,抑制肺组织中炎性细胞因子的表达量,对小鼠机体起保护作用。
综上所述,辣蓼正丁醇部分黄酮(FNB)能通过提升小鼠体内肝脏的抗氧化防御酶促体系的活性,抑制LPS诱导的小鼠血中TNF-α、IL-1β、IL-6、IL-8的产生,降低肺部TNF-α、IFN-α、IFN-γ及IL-2 mRNA的表达水平,从而减轻LPS诱导的小鼠内毒素血症的炎性损伤,对机体产生保护作用。
[1] Bone R C,Grodzin C J,Balk R A.Sepsis: a new hypothesis for pathogenesis of the disease process[J].Chest,1997,112(1):235-243.
[2] Zou W,Roth R A,Younis H S,et al.Oxidative stress is important in the pathogenesis of liver injury induced by sulindac and lipopolysaccharide cotreatment[J].Toxicology,2010,272(1-3):32-38.
[3] 黄红泓,甄汉深.中草药辣蓼近年来的研究进展[J].中国民族民间医药,2013,22(1):38-40.
[4] 马超英,周 鹃,李海霖,等.大承气汤对内毒素血症大鼠炎性细胞因子的影响[J].中国实验方剂学杂志,2011,17(13):130-133.
[5] 詹光杰,肖本见,杨年安.延龄草对LPS诱导大鼠肝损伤的保护作用及机制[J].中国应用生理学杂志,2016,32(4):373-377.
[6] 宣国平,张 琳,钟明媚.脂多糖致大鼠急性肺损伤模型取材时间选择[J].中华实用诊断与治疗杂志,2015,29(2):136-138.
[7] Vassilev D,Hauser B,Bracht H,et al.Systemic,pulmonary,and hepatosplanchnic effects of N-acetylcysteine during long-term porcine endotoxemia[J].Crit Care Med,2004,32(2):525-532.
[8] Ritter C,Andrades M E,Reinke A,et al.Treatment with N-acetylcysteine plus deferoxamine protects rats against oxidative stress and improves survival in sepsis[J].Crit Care Med,2004,32(2):342-349.
[9] Bacanli M,Aydin S,Taner G,et al.The protective role of ferulic acid on sepsis-induced oxidative damage in Wistar albino rats[J].Environ Toxicol Phar,2014,38(3):774-782.
[10] 柯友建.还原型谷胱甘肽治疗轮状病毒肠炎合并肝功能异常30例[J].中国药业,2009,18(15):73-73.
[11] Liao Y R,Lin J Y.Quercetin intraperitoneal administration ameliorates lipopolysaccharide-induced systemic inflammation in mice[J].Life Sci,2015,137:89-97.
[12] Parida S,Singh T U,Thangamalai R,et al.Daidzein pretreatment improves survival in mouse model of sepsis[J].J Surg Res,2015,197(2):363-373.

