南非蜱虫套式PCR鉴定方法的建立
王素华,闫宝龙,吴绍强,帅江冰,张晓峰,吕继洲
(1.温州出入境检验检疫局,浙江温州 325027;2.温州医科大学,浙江温州 325000;3.中国检验检疫科学研究院动物检疫所,北京 100029;4.浙江出入境检验检疫局,浙江杭州 310016)
蜱隶属节肢动物门(Arthropoda),蛛形纲(Arachnida),蜱螨亚纲(Acari),寄螨总目(Parasitiformes),蜱目(Ixodida)。蜱目包括硬蜱科(Ixodidae)、软蜱科(Argasidae)和纳蜱科(Nuttalliellidae),共计3科17属899种[1]。蜱是许多细菌、病毒、立克次体、螺旋体和原虫的传播媒介和贮存宿主,携带病原体的蜱叮咬人或动物后,可致使人或动物发病,所引起的疾病统称为蜱传疾病[2]。国内外相继发现了巴贝斯虫[3]、新布尼亚病毒[4]、塔拉萨维奇立克次体[5]、劳氏立克次体[6]等新发蜱传病原体及其所致疾病。当前,蜱和蜱传疾病的危害已经成为一个重大的社会公共卫生问题[7]。近年来,有关部门在进口南非生牛皮中截获了大量的媒介蜱,但对蜱的相关鉴定较少。为了弥补该项工作的不足,本文对截获到的南非蜱进行种类鉴定。蜱的鉴定一般借助于光学显微镜,以形态学特征为主,根据蜱分类检索表进行形态学分类鉴定[8]。但在光学显微镜下观察蜱的结构易受主观因素影响,且对于结构模糊、畸形、亲缘种的鉴别在形态上易混淆。随着分子生物学技术的不断发展,蜱的鉴定方法也随之发展[9]。DNA序列分析能够在基因水平上对比不同种的同源DNA序列,来分析样品的遗传变异情况;能准确获取基因组的特定序列片段的数据,对于鉴定蜱的种类,以及进行系统分类和发育研究有很大帮助[10]。
1 材料与方法
1.1 材料
1.1.1 主要仪器和试剂 琼脂糖、溴化乙锭,美国Sigma公司产品;树脂型基因组DNA提取试剂盒,北京赛百盛基因技术有限公司产品;胶回收试剂盒,美国OMEGA公司产品;DNA Marker DL 5 000、LATaq酶、10×PCR buffer、2 mmol/L dNTPs,宝生物工程(大连)有限公司产品;M26型混合研磨仪,捷克RETECH公司产品;台式高速冷冻离心机、DK-600A型电热恒温水浴锅,美国Thermo Scientific公司产品;Bio-Rad电泳仪、PCR仪,美国Bio-Rad公司产品。
1.1.2 蜱虫来源 2016年4月—2016年11月在进口的南非生牛皮上截获到数千只蜱虫,将蜱虫装入洁净的采集瓶中,带回实验室待检。
1.2 方法
1.2.1 蜱虫的形态学鉴定 将蜱虫进行清洗处理后,在光学显微镜下观察蜱虫的假头基、基突、盾板、侧沟、须肢、生殖孔、足基节、肛沟和气门板等形态学特征,根据蜱虫分类检索表进行形态学分类鉴定(图1)。
1.2.2 引物的设计与合成 根据GenBank中蜱虫18 S rRNA序列保守区设计两对特异性引物,引物由上海生工生物工程技术服务有限公司合成,引物核酸序列见表1。

图1 蜱类分属简要检索表

表1 18 S rRNA引物的核苷酸序列
1.2.3 蜱虫基因组DNA提取 先将形态学鉴定为不同种的蜱虫各1只清洗处理后分别在混合研磨仪中研磨,按照基因组提取试剂盒说明进行基因组DNA提取,样品无需RNA酶处理,置-20℃保存备用。
1.2.4 套式PCR克隆策略 克隆分两步,按照图2所示进行。
以蜱虫基因组DNA为模板,以T18sF1+T18sR1为第1套引物扩增18 S rRNA基因片段。25 μL PCR扩增体系:10×PCR buffer 2.5 μL,T18sF1、T18sR1引物(10 mmol/L)各1 μL,LATaq酶(5 U/μL)0.25 μL,dNTPs(2 mmol/L)2 μL,基因组DNA 2 μL,ddH2O 16.25 μL。进行第1轮PCR,扩增条件为:95℃ 5 min;94℃ 1 min,60℃ 1 min,72℃ 2 min,10个循环;72℃ 10 min。15 g/L琼脂糖凝胶电泳检测扩增产物。
以第1轮PCR产物DNA为模板,分别以T18sF1+ T18sR2、T18sF2+T18sR1为第2套引物,扩增18 S rRNA基因片段。25 μL PCR扩增体系:10×PCR buffer 2.5 μL,T18sF1+T18sR2、T18sF2+T18sR1引物(10 mmol/L)各1 μL,LATaq酶(5 U/μL)0.25 μL,dNTPs(2 mmol/L)2 μL,第1轮PCR产物DNA 1 μL,ddH2O 17.25 μL。进行第2轮PCR,扩增条件为:95℃ 5 min;94℃ 1 min;60℃ 1 min,72℃ 2 min,25个循环;72℃ 10 min。15 g/L琼脂糖凝胶电泳检测扩增产物。

图2 18 S rRNA套式PCR克隆示意图
1.2.5 DNA序列测定及系统进化分析 PCR阳性产物送上海生工生物工程技术服务有限公司进行序列测定。利用Seq Man软件拼接序列后,通过Internet网进入美国国家生物技术信息中心(www.ncbi.nlm.nih.gov),利用“BLAST”工具和采用DNA Star中的Meg Align软件对序列进行同源性比较,并运用MEGA5.0软件,进行系统进化分析。
2 结果
2.1 南非截获蜱形态学鉴定
光学显微镜下观察蜱,根据外观和形态不同,将截获的蜱虫分成10种,命名为T1~T10。根据盾板、假头基、气门板、肛板、肛沟和足基节等形态特征,参考蜱类分属检索表,进一步进行形态学分类鉴定(图3)。

图3 进口南非生牛皮中截获蜱形态学观察
对照蜱类分属简要检索表,发现T1、T2、T3、T4、T7和T8分别属于花蜱属(Amblyomma)的不同种或亚种;T5和T6分别是牛蜱属(Boophilus)的不同种或亚种;T9和T10分别是扇头蜱属(Rhipicephalus)的不同种或亚种。
2.2 蜱虫基因组DNA
对经过形态学初步鉴定的10种蜱,每种蜱虫取1只,按照基因组DNA提取试剂盒说明提取蜱虫基因组DNA,提取的基因组DNA浓度为50 ng/μL~100 ng/μL。
2.3 套式PCR扩增蜱基因及序列分析
以所获得的蜱虫基因组DNA为模板,经两轮PCR扩增18 S rRNA基因,通过15 g/L琼脂糖凝胶电泳初步鉴定产物,10种测试样品均出现目的条带(图4)。
应用Meg Align软件将所获得的样本序列与GenBank中已知参考序列进行核苷酸相似性比较分析。基因序列分析显示,样本T1、T2、T3和T4的18 S rRNA与Amblyommarotundatum(KJ584369.1)的同源性为100%;样本T7和T8的18 S rRNA与Amblyommamaculatum(L76344.1)的同源性为99%;样本T5和T6的18 S rRNA与BoophilusmicroplusBiarra(Z74481.1)的同源性为100%;样本T9和T10的18 S rRNA与Rhipicephaluszambesiensis(KC769615.1)的同源性为99%。
2.4 系统进化分析
将T18sF1+ T18sR2和T18sF2+T18sR1引物分别扩增到的PCR产物测序后拼接,得到18 S rRNA基因序列,与NCBI中已公布的蜱虫18 S rRNA基因序列进行比对,应用MEGA5.0软件进行系统进化分析。结果显示,T1、T2、T3和T4与Amblyommarotundatum在同一分支上,是花蜱属的亚种;T7和T8与Amblyommamaculatum在同一分支上,也是花蜱属的亚种;T5、T6、T9和T10分别与BoophilusmicroplusBiarra和Rhipicephaluszambesiensis在同一分支上,是牛蜱属和扇头蜱属的不同种或亚种;与光学显微镜下的形态学鉴定结果基本吻合(图5)。

图4 套式PCR扩增18 S rRNA基因片段电泳结果
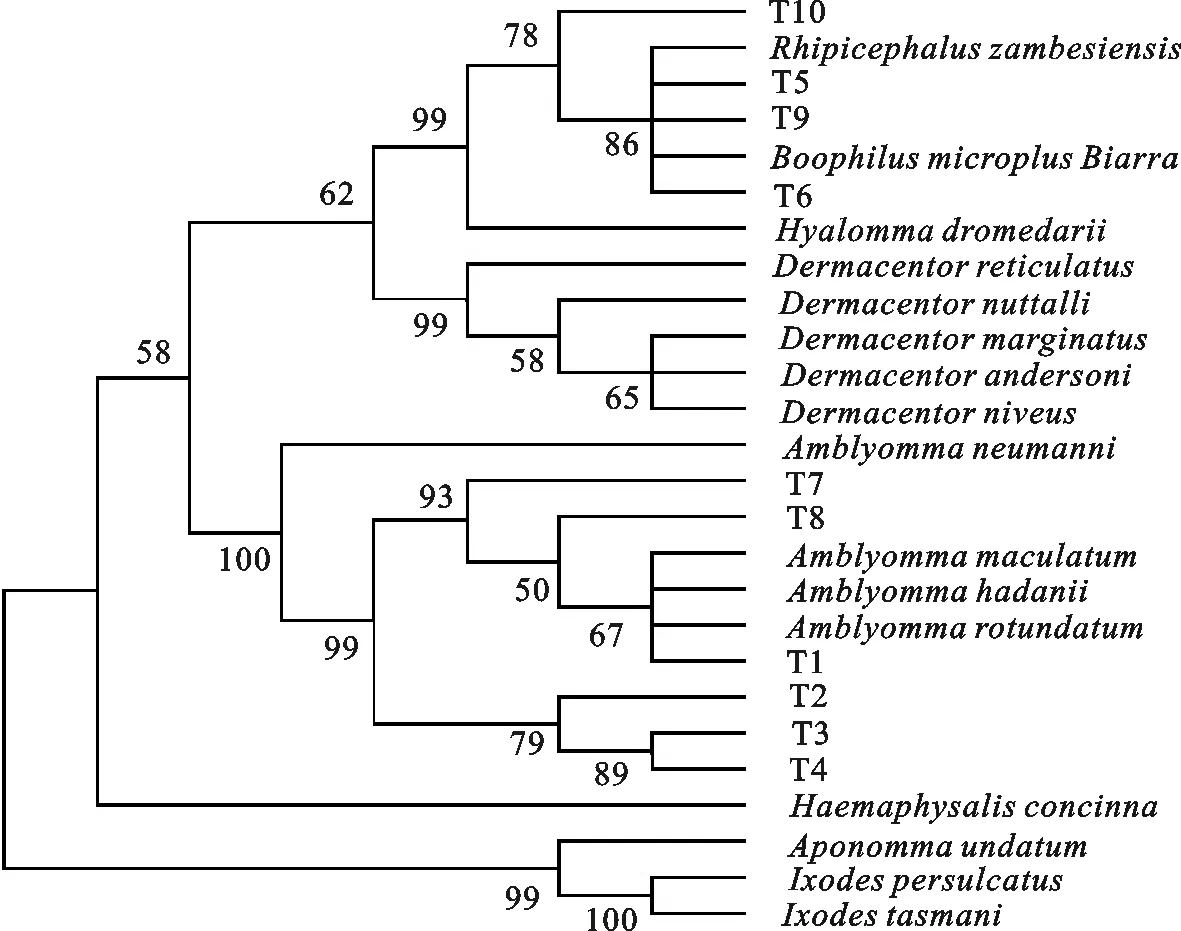
图5 10种蜱虫基于18 S rRNA序列的系统进化分析
3 讨论
蜱的种类鉴定需要具有鉴定经验的专业技术人员,一般人掌握起来比较困难。随着科技的发展,分子生物学方法在物种鉴定和病原检测中得到广泛应用。18 S rRNA基因是常用于分子生物学鉴定的候选基因[11],该序列高度保守,PCR容易扩增,GenBank数据库中相关序列信息丰富,方便做比对分析,但国内目前几乎没有对国外传入蜱种进行鉴定的报道。因此,本研究对经形态学初步鉴定的10种蜱的18 S rRNA基因序列进行了测定和分析,并将其与GenBank中已经公布的3个种属蜱的序列进行对比。序列分析和系统进化分析显示,从进口的南非生牛皮上截获的蜱分别是花蜱属、牛蜱属和扇头蜱属的不同种或亚种,T1、T2、T3、T4与T7和T8之间的亲缘关系较近,但它们之间也存在一定的差异,属于花蜱属的不同种或亚种;T5、T6、T9和T10之间的亲缘关系较近,是牛蜱属和扇头蜱属的不同种或亚种,而近年来的蜱种分类学也已经将牛蜱属合并到扇头蜱属[12]。本次经形态学和分子生物学综合鉴定得出的花蜱属、牛蜱属和扇头蜱属可作为媒介传播巴贝斯虫、环形泰勒虫、布鲁菌、立克次体和牛结节性皮肤病病毒等病原微生物,不同蜱种在蜱传疾病的发生和传播中所起作用值得进一步研究[13]。
[1] Barker S C,Murrell A.Systematics and evolution of ticks with a list of valid genus and species names[J].Parasitology,2004,129(S):15-36.
[2] Speck S,Derschum H,Damdindorj T,et al.Rickettsiaraoultii,the predominantRickettsiafound in MongolianDermacentornuttalli[J].Tick and Tick-borne Dis,2012,3(4):227-231.
[3] Razmi G,Pourhosseini M,Yaghfouri S,et al.Molecular detection ofTheileriaspp.andBabesiaspp.in sheep and ixodid ticks from the northeast of Iran[J].J Parasitol,2013,99(1):77-81.
[4] Yu X J,Liang M F,Zhang S Y,et al.Fever with thrombocytopenia associated with a novel bunyavirus in China[J].New Engl J Med,2011,364(16):1523-1532.
[5] Jia N,Zheng Y C,Jiang J F,et al.Human infection withCandidatusRickettsiatarasevichiae[J].New Engl J Med,2013,369(12):1178-1180.
[6] Jia N,Zheng Y C,Ma L, et al.Human infections withRickettsiaraoultii,China[J].Emerg Infect Dis,2014,20(5):866-868.
[7] Pfäffle M,Littwin N,Muders S V,et al.The ecology of tick-borne diseases[J].Int J Parasitol,2013,43(12-13):1059-1062.
[8] 邓国藩,姜在阶.中国经济昆虫志[M].北京:科学出版社,1991.
[9] Anderson J M,Ammerman N C,Norris D E.Molecular differentiation of metastriate tick immatures[J].Vector Borne Zoon Diseas,2004,4(4):334-342.
[10] Burger T D,Shao R,Beati L,et al.Phylogenetic analysis of ticks (Acari:Ixodida) using mitochondrial genomes and nuclear rRNA genes indicates that the genusAmblyommais polyphyletic[J].Mol Phylog Evolut,2012,64(1):45-50.
[11] Dobson S J,Barker S C.Phylogeny of the hard ticks (Ixodidae) inferred from 18S rRNA indicates that the genusAponommais paraphyletic [J].Mol Phylogenet Evolut,1999,11(2):288-295.
[12] Shemshad K,Rafinejad J,Kamali K,et al.Species diversity and geographic distribution of hard ticks (Acari:Ixodoidea:Ixodidae) infesting domestic ruminants, in Qazvin province,Iran[J].Parasitol Res,2012,110(1):373-380.
[13] 亚红祥,沈 姝,苏正元,等.滇西横断山区家畜体表蜱类调查及鉴定[J].中国人兽共患病学报,2016,32(10):865-870.
——和田盘羊

