鸡滑液囊支原体和禽呼肠病毒的实时荧光定量PCR快速检测
黄 莉,谢芝勋,王 盛,邓显文,谢志勤,谢丽基,曾婷婷,黄娇玲,张艳芳
(广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西南宁 530001)
鸡滑液囊支原体(Mycoplasmasynoviae,MS)和禽呼肠病毒(Avian reovirus,ARV)是禽类重要的病原体之一,可以引起多种综合征,给养鸡业造成巨大的经济损失。鸡滑液囊支原体主要引起鸡、鸭、鹅、鹌鹑、鸽等的一种以关节渗出性的滑液囊膜炎及腱鞘滑膜炎为特征的急性或慢性传染性疾病,在鸡群中普遍存在,主要侵害商品肉鸡、蛋鸡或种鸡[1-2]。禽呼肠病毒是呼肠病毒科的RNA病毒,主要危害鸡和火鸡,可引起肠道疾病、慢性呼吸道疾病、关节炎/矮小综合征、营养不良综合征等[3-4]。鸡滑液囊支原体和禽呼肠病毒的混合感染在鸡群中普遍存在,并且导致鸡只出现严重的免疫抑制、抑郁、生长发育迟缓,进而降低产蛋量、蛋品质以及孵化率和饲料转化率降低,屠宰时胴体质量下降,使屠体废弃率升高等。鉴别、控制和清除这些病原体依赖于准确和及时对感染群做出诊断。高度敏感、准确、快速有效的诊断方法对于这些禽病在鸡群中的有效监测和防控是必需的。因此,迫切需要建立一种快速敏感的鸡滑液囊支原体和禽呼肠病毒的鉴别检测技术,尤其在感染早期若能检测出这些病原体,将为这些疾病的有效防控争取宝贵时间。目前,这两种病原体的传统检测方法有病原培养分离、血清学试验等,但这些检测方法存在耗时长、敏感性较低、不易标准化等缺点,在实际应用中具有一定的局限性。实时荧光定量PCR实现了对模板的定量,而且具有敏感、特异、准确可靠、能实现多重反应和实时性好等特点。在实际应用中,多重荧光定量PCR采用多对引物扩增检测多个模板,克服了普通PCR、单项荧光定量PCR等的不足,是一种高通量、低成本、高效率的检测方法,可进行大量样品的批量快速检测[5-7]。目前,还未见有应用多重荧光定量PCR对鸡滑液囊支原体和禽呼肠病毒进行检测的报道。
本研究旨在建立一种检测时间短、灵敏度高和特异性强的鸡滑液囊支原体和禽呼肠病毒的二重荧光定量PCR检测方法,以实现对鸡滑液囊支原体和禽呼肠病毒的同时检测和定量,有利于这两种病原体在鸡群中的监测和净化。
1 材料与方法
1.1 材料
1.1.1 菌(毒)种及样品 MS、ARV、鸡新城疫病毒(Newcastle disease virus,NDV)、传染性支气管炎病毒(Infectious bronchitis virus,IBV)、传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)、鸡马立克病病毒(Marek's disease virus,MDV)、禽白血病病毒(Avian leukosis virus,ALV)、H9亚型禽流感病毒(H9 Avian influenza virus,H9 AIV)、禽网状内皮组织增生病毒(Reticuloendotheliosis virus,REV)、鸡毒支原体S6株(Mycoplasmagalliscepticum,MG)、火鸡支原体(Mycoplasmameleagridis,MM)、禽衣阿华支原体(Mycoplasmaiowae,MI)等,广西壮族自治区兽医研究所保存;40份临床疑似样品,采自广西部分养鸡场。
1.1.2 主要仪器和试剂 Lightcycler2.0荧光定量PCR仪,Roche公司产品;DNA片段回收试剂盒、质粒小量提取试剂盒,Axygen公司产品;pMD18-T试剂盒、Premix ExTaq(Probe qPCR)试剂盒、M-MLV体外转录试剂盒,宝生物工程(大连)有限公司产品;Trizol RNA提取试剂,Invitrogen公司产品。
1.2 方法
1.2.1 引物和TaqMan探针的设计及合成 根据GenBank上发表的ARV σC和MS vlhA 基因的保守序列,利用Primer Express3.0软件设计特异引物和TaqMan探针,序列见表1和表2,引物由宝生物工程(大连)有限公司合成,用于标准品的制备和二重荧光定量PCR的建立。

表1 ARV和MS的扩增所需引物

表2 二重荧光定量PCR引物和探针
1.2.2 核酸的提取和反转录 参照Trizol RNA提取试剂盒说明书,提取ARV、NDV、AIBV、IBDV、MDV、ALV、REV、H9 AIV的总RNA;参照本实验室已建立的方法提取MS、MG、MI和MM的DNA。参照M-MLV反转录试剂盒说明书,将提取的总RNA反转录成cDNA。
1.2.3 标准品的制备 分别以上述得到的ARV S1133的cDNA和MS的DNA为模板进行PCR扩增,反应体系为25 μL (含Premix ExTaq12.5 μL,上、下游引物(10 μmol/L)各1 μL,5 μL cDNA或DNA模板),反应条件为:94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 20 s ,35个循环;72℃ 10 min。将PCR产物连接至pMD18-T载体,阳性菌(pMD18-T-ARV和pMD18-T-MS)经测序验证。用NanoDrop浊度仪测定标准品质粒的浓度,计算拷贝数。
1.2.4 反应条件的优化 以pMD18-T-ARV质粒和pMD18-T-MS质粒(二者的拷贝比为1∶1)作为模板,将引物和探针进行不同浓度的配比,或选择不同退火温度,采用矩阵法进行荧光定量PCR,筛选引物和探针的最佳浓度和最佳退火温度。反应程序采用三步法,并进行熔解曲线检测,最后于40℃ 5 s结束反应。FAM在530 nm激发光下发荧光,用来检测禽呼肠病毒;ROX在610 nm激发光下发荧光,用来检测鸡滑液囊支原体。
1.2.5 特异性和敏感性试验 分别以质粒pMD18-T-MS、质粒pMD18-T-MS+pMD18-T-ARV、质粒pMD18-T-ARV、DNA样品(MG 、MI 、MM)、cDNA样品(NDV、AIBV、IBDV、MDV、ALV、REV、H9亚型AIV)作为模板,用于评价二重荧光定量PCR反应的特异性。为了进行敏感性试验,分别将pMD18-T-ARV和pMD18-T-MS质粒作10倍倍比稀释,得到拷贝数为1×108拷贝/μL~1×101拷贝/μL的稀释样品,再将每个稀释度的样品混合作为模板,分别通过二重荧光定量PCR和普通PCR进行检测。
1.2.6 重复性 用1×108拷贝/μL的pMD18-T-ARV和pMD18-T-MS混合样品,保存于-20℃,0、3、7 d后重复检测,通过计算Ct值的标准差(SD)和变异系数(CV)来验证二重荧光定量PCR的重复性。
1.2.7 普通PCR和PCR 分别用普通PCR和PCR进行ARV和MS扩增,退火温度是60℃ 30 s,共35个循环。PCR产物经15 g/L琼脂糖凝胶电泳,用分子影像仪Gel Doc XR+ imaging 系统进行观察。
1.2.8 临床病料的检测分析 利用建立的二重荧光定量PCR,对临床收集的疑似ARV/MS感染病料进行检测,并与常规病毒分离及血清学检测方法进行比较,评价其临床实用性。
2 结果
2.1 反应条件的优化结果
在模板浓度一致的前提下,以扩增曲线的荧光强度增加值最大、达到阈值时所经历的循环数(Ct值)最小为最优反应条件。当ARV和MS的上、下游引物和探针的浓度均为0.3 μmol/L时,对标准品的检测可获得较小的Ct值。当退火温度为60℃时,在其他反应条件不变的情况下,对标准品的检测可获得较小的Ct值。所以,优化后引物和探针的反应浓度均为0.3 μmol/L,退火温度为60℃。
2.2 特异性试验结果
如图1和表3所示,只检测到ARV和MS对应的特异性荧光曲线,而对照病原体如IBDV、NDV、AIBV、MDV、H9亚型AIV、REV、ALV、 MG、 MI、 MM等显示为阴性。该结果说明此方法引物和探针特异性强,可以有效地鉴别检测ARV和MS及其他病原体。
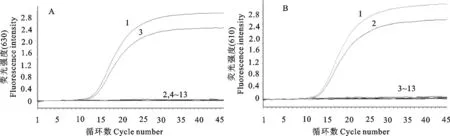
A.ARV;B.MS;1.MS+ARV;2.MS;3.ARV;4.IBDV;5.NDV;6.AIBV;7.MDV;8.H9亚型AIV;9.REV;10.ALV;11.MG;12.MI;13.MM;14.阴性对照
A.ARV;B.MS;1.MS+ARV;2.MS;3.ARV;4.IBDV;5.NDV;6.AIBV;7.MDV;8.H9 subtype AIV;9.REV;10.ALV;11.MG;12.MI;13.MM;14.Negative control
图1特异性试验结果
Fig.1 Specificity test results of the duplex real-time PCR

表3 特异性试验所测的病原体和Ct值
2.3 敏感性试验
如图2所示,当鸡滑液囊支原体和禽呼肠病毒模板为10拷贝时,仍可检测到荧光曲线,表明该检测方法对鸡滑液囊支原体和禽呼肠病毒的灵敏度均为10拷贝,比常规PCR敏感性高100倍。此外,从标准曲线可见其扩增成线性,说明该方法的扩增效率好(图3)。
2.4 重复性
检测结果如表4所示,标准品经不同时间保存后,检测的Ct值变异系数均小于3%,结果说明此方法具有良好的准确性和重复性。
2.5 临床病料的检测
待测样本为广西地区养鸡场中疑似感染鸡群收集的40份病料,分别提取鸡病料(病鸡的跗关节腔内的关节液及其内容物、病鸡的脾脏或病鸡的肺脏)的RNA和DNA,作为模板,进行荧光定量PCR检测,并通过病原分离或血清学方法验证结果。如表5所示,ARV检出率是7.5%, MS的检出率是5%;ARV 的Ct值范围为15.29~34.42, MS 的Ct值范围是13.53~30.68。而且,二重荧光定量PCR的检测结果和其他方法的结果相符。

A.ARV敏感性试验;B.ARV标准曲线;C.MS敏感性试验;D.MS标准曲线;1~8.2×108拷贝~ 2×101拷贝;9.阴性对照
A.Sensitivity test of ARV;B.Standard curve of ARV;C.Sensitivity test of MS;D.Standard curve of MS;1-8.2×108copies-2×101copies;9.Negative control
图2敏感性试验结果
Fig.2 Sensitivity test results of the duplex real-time PCR

A.ARV普通PCR敏感性试验;B.MS普通PCR敏感性试验;M.DNA 标准;1.阴性对照;2~9.2×101拷贝~2×108拷贝
A.Sensitivity test of conventional PCR for ARV;B.Sensitivity test of conventional PCR for MS;M.DNA Marker;1.Negative control;2-9.2×101copies-2×108copies
图3 ARV和MS的普通PCR敏感性试验
Fig.3 Sensitivity test of conventional PCR for ARV and MS

表4 重复性试验结果

表5 临床病料的检测结果
3 讨论
ARV和MS在鸡群及其他禽类中可引起混合感染,造成防控难度加大,鸡群感染损伤更严重,往往经济损失更惨重。而且,由于二者引起的临床症状相似,单凭临床症状和剖检病变难以确诊,常常不能准确做出判断,可能会误诊或错过最佳的诊断时机,进而导致病毒的迅速扩散,感染范围不断扩大,感染损失加剧,因此必须借助实验室检测进行早期确诊和鉴别。
现有的针对ARV和MS的实验室检测方法主要有病毒分离鉴定、血清学检测、普通PCR、多重PCR、ELISA等,但这些检测方法大多存在操作繁琐、技术及试验条件要求高、周期长等缺点,不能满足快速诊断的需要[8-9]。虽然PCR较其他传统方法具有较高的灵敏性和特异性,但仍然存在检测流程长、费时、灵敏度不高的缺陷,尤其是在发病早期,机体内病毒含量相对不高时,PCR有可能发生漏检现象,不能对病原体的早期感染做出准确诊断,会给病毒有可乘之机,随着动物及其产品的流通而传播,造成不良影响[10-11]。本研究旨在建立二重荧光定量PCR,以用于快速、灵敏和准确地鉴别检测并定量ARV和MS。
本研究建立的检测方法的最大优点就是能够同时检测并定量ARV和MS。通过采用针对ARV和MS高度保守序列的特异性引物和探针,可以在一次反应中完成对病原体的检测和定量。而且,这个检测方法是可选的,即可根据实际情况,应用于单项反应或组合成二重反应,且对结果没有影响。特别是该检测方法减少了试剂成本,缩短了反应时间,可用于单项/二重反应。这些优点给临床应用带来了极大的便捷和实用性,这是判断一个诊断方法是否适用于疫病早期监控的重要评判标准之一[12]。
灵敏度是临床诊断方法的一个很重要的判断标准。本研究中,该二重荧光定量PCR反应的敏感性高达20拷贝,均高于Sprygin报道的二重荧光定量PCR反应和Reck建立的多重PCR,灵敏度大大增加,这对发病早期机体内病原含量较低时的快速诊断具有积极意义[11,13]。而且,特异性试验结果和临床病料检测结果表明,该real-time PCR的检测结果和传统的病原分离鉴定及血清学试验的结果高度相符,证明了该方法的检测结果可靠,准确性高。因此,该方法适用于ARV和/或MS早期感染时的临床鉴别诊断,对于早期发现、早期确诊、早期控制,降低发病率和病死率,都具有重要意义。
该方法的另一优点就是反应时间短,检测结果可以在2 h内可以获得,而且,荧光信号可以通过与荧光定量PCR扩增仪连接的电脑实现直接的实时观察。与普通PCR或多重PCR相比,该反应不需要PCR扩增后处理,如电泳跑胶、紫外光下观察等,节省时间,操作简便,对于疫病的早期诊断,尤其是突发疫情时大量样品的监测显得更为重要[14-16]。
综上所述,本研究建立的ARV和MS二重荧光定量PCR具有快速、敏感、特异、准确、定量和实时性好等特点,能满足大批量、快速鉴别检测禽呼肠病毒和鸡滑液囊支原体的要求,对及早快速确诊这两种病原感染,有效防控疫病的发生,防止病原传播扩散,促进养禽业的健康发展等具有重要意义。
[1] Lockaby S B,Hoerr F J,Lauerman L H,et al.Pathogenicity ofMycoplasmasynoviaein broiler chickens[J].Vet Pathol,1998,35:178-190.
[2] Hinz K H,Blome C,Ryll M.Virulence ofMycoplasmasynoviaestrains in experimentally infected broiler chickens[J].Berl Munch Tierarztl Wochenschr,2003,116:59-66.
[3] 黄 莉,谢芝勋,蓝元喜,等.禽呼肠孤病毒感染后Toll样受体在SPF鸡不同器官中的表达变化[J].中国兽医科学,2017(2):202-206.
[4] 黄 莉,谢芝勋,蓝元喜,等.禽呼肠孤病毒感染后SPF鸡关节中Toll样受体的mRNA转录水平变化[J].中国兽医学报,2017(3):433-437.
[5] Troxler S,Marek A,Prokofieva I,et al.TaqMan real-time reverse transcription-PCR assay for universal detection and quantification of avian hepatitis E virus from clinical samples in the presence of a heterologous internal control RNA[J].J Clin Microbiol,2011,49:1339-1346.
[6] Wittwer C T,Herrmann M G,Gundry C N,et al.Real-time multiplex PCR assays[J].Methods,2001,25:430-442.
[7] Mackay I M,Arden K E,Nitsche A.Real-time PCR in virology[J].Nucleic Acid Res,2002,30:1292-1305.
[8] Ortiz A,Kleven S H.Serological detection ofMycoplasmasynoviaeinfection in turkeys[J].Avian Dis,1992,36:749-752.
[9] Noormohammadi A H,Markham P F,Markham J F,et al.Mycoplasmasynoviaesurface protein MSPB as a recombinant antigen in an indirect ELISA[J].Microbiology,1999,145(Pt8):2087-2094.
[10] Reck C,Menin A,Canever M F,et al.Rapid detection ofMycoplasmasynoviaeand avian reovirus in clinical samples of poultry using multiplex PCR[J].Avian Dis,2013, 57:220-224.
[11] Mardassi B B,Mohamed R B,Gueriri I,et al.Duplex PCR to differentiate betweenMycoplasmasynoviaeandMycoplasmagallisepticumon the basis of conserved species-specific sequences of their hemagglutinin genes[J].J Clin Microbiol,2005,43:948-958.
[12] Heidenreich A,Bellmunt J,Bolla M,et al.EAU guidelines on prostate cancer.Part 1:screening,diagnosis,and treatment of clinically localised disease[J].Eur Urol,2011,59:61-71.
[13] Sprygin A V,Andreychuk D B,Kolotilov A N,et al.Development of a duplex real-timeTaqMan PCR assay with an internal control for the detection ofMycoplasmagallisepticumandMycoplasmasynoviaein clinical samples from commercial and backyard poultry[J].Avian Pathol,2010,39:99-109.
[14] Jindal N,Chander Y,Patnayak D P,et al.A multiplex RT-PCR for the detection of astrovirus,rotavirus,and reovirus in turkeys[J].Avian Dis,2012,56:592-596.
[15] Xie Z,Fadl A A,Girshick T,et al.Amplification of avian reovirus RNA using the reverse transcriptase-polymerase chain reaction[J].Avian Dis,1997,41:654-660.
[16] Liu C,Chang L,Jia T,et al.Real-time PCR assays for hepatitis B virus DNA quantification may require two different targets[J].Virol J,2017,14(1):94.

