金银花超微粉与普通粉重复给药的安全性比较研究
向 韵,雷 昌,黄 丹,蔡 川,孟 盼,张秀丽,赵洪庆,蔡光先,王宇红
(湖南中医药大学/湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,湖南长沙 410208)
金银花为忍冬科(Caprifoliaceae)忍冬属(Lonicera)植物忍冬(L.japonicaThunb)及同属多种植物的干燥花蕾,为中医常用药物,具有清热解毒,凉风散热之功,主治痈肿疔疮、丹毒、喉痹、风热感冒、热毒血痢、温病发热[1-2]。因其良好的药理作用,广泛应用于临床。
超微中药是在传统中医药理论的指导下,运用现代科学技术研制而成一类新型中药[3-4]。中药材经过超微粉碎后,粒度均匀细密,并可使细胞壁破碎,增加了药材的比表面积,提高了生物利用度[5-6],有利于药物有效成分的溶出,进而增强了药效[7-8]。但由于超微细胞破壁,使得毒性成分的溶出也有所增加[9-11]。因此,对超微粉碎后中药材成分的稳定性及其是否产生新的毒性成分的研究,有助于解决超微中药临床用药的安全性问题[12-14],促进其进一步推广应用,传承并发扬中医药的特色与优势[15]。因此,为考察金银花超微粉重复给药的安全性,本试验拟通过大鼠重复给药的毒性试验[16],对金银花超微粉与普通粉重复给药的安全性进行比较研究,旨在进一步完善金银花超微粉的研究内容,为确定其安全剂量范围及临床用药安全性提供参考依据。
1 材料与方法
1.1 材料
1.1.1 药物 金银花超微粉与普通粉均由由湖南省中医药研究院提供,批号分别为080706、080707。试验前将金银花超微粉与普通粉分别用90℃的水浸泡2次,每次30 min,过滤,滤液浓缩至相当于生药量为0.8 g/mL。金银花超微粉D50=12.21 μm、D90=48.73 μm;金银花普通粉D50=53.27 μm、D90=112.68 μm。
1.1.2 实验动物 SPF级Wistar大鼠,上海西普尔-必凯实验动物有限公司提供,合格证号:SCXK(沪)2003-0002。动物饲养室温为20℃~24℃,相对湿度为45%~60%。实验动物环境设施合格证号:SYXK(湘)2003-0001。全价颗粒饲料由上海西普尔-必凯试验动物有限公司提供。
1.1.3 试剂 凝血酶原时间(PT)测定试剂盒(批号1050821)、活化部分凝血活酶时间(APTT)测定试剂盒(批号:106005),购自上海太阳生物技术公司;钾测定试剂盒(批号:2008041)、钠测定试剂盒(批号:2008014)、氯测定试剂盒(批号:2008025),购自长春汇丽生物技术有限公司;总蛋白(TP)试剂盒(批号:060741)、γ-谷氨酰基转移酶(GGT)试剂盒(批号:080351)、总胆固醇(CHO)试剂盒(批号:080661)、尿素(Urea)试剂盒(批号080461)、天门冬氨酸氨基转移酶(AST)(批号:080421)、N58l-丙氨酸氨基转移酶(ALT)(批号:080951)、碱性磷酸酶(ALP)(批号:080331)、肌酐(Crea)(批号:081191)、葡萄糖(GLU)试剂盒(批号:081481)、总胆红素(BIL)试剂盒(批号:080401)、白蛋白(ALB)试剂盒(批号:080811)、G-甘油三酯试剂盒(批号:082501),购自北京中生北控生物科技股份有限公司。
1.1.4 主要仪器 CA-500血液分析仪,山东兰桥医学科技有限公司产品;16导生理记录仪,美国BIOPAC公司产品;RT-1904C半自动生化分析仪,深圳雷杜生命科学股份有限公司产品;MC-4000血凝分析仪,德国美创公司产品。
1.2 方法
参照国家食品药品监督管理局2006年发布的“中药、天然药物稳定性研究技术指导原则(国食药监注[2006]678号)”的方法进行。
1.2.1 动物分组、给药及抽样
1.2.1.1 分组、给药 取SPF级Wistar大鼠140只,体重100 g±20 g,雌雄各半,按性别、体重分层随机分为7组,每组雌雄各10只,雌雄分开饲养。取其中1组大鼠作为对照给纯净水,取其中6个组分别给金银花超微粉低(4 g/kg)、中(8 g/kg)、高剂量(16 g/kg)各1个组,金银花普通粉低(4 g/kg)、中(8 g/kg)、高剂量(4、8、16 g/kg)各1组,灌胃给药4周,灌胃体积为20 mL/kg。
1.2.1.2 抽样 末次给药后,各组随机取大鼠10只,夜间禁食,自由饮水,次日进行指标检测。剩余大鼠停药观察2周,同法进行指标检测。
1.2.2 指标检测
1.2.2.1 血细胞检测 颈动脉取血,测定血红蛋白(Hb)、红细胞总数(RBC)、白细胞总数(WBC)及分类、血小板(PLT)等血液学指标。
1.2.2.2 血清生化检测 分离血浆测定活化部分凝血活酶时间(APTT)和凝血酶原时间(PT);分离血清,测定总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、总胆红素(Bil)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆固醇(TCH)、碱性磷酸酶(ALP)、尿素氮(BUN)、肌酐(Crea)等10项指标。
1.2.2.3 病理与脏器系数检测 解剖取心、肝、脾、肺、肾、胃、小肠、大肠、脑、垂体、甲状腺、胸腺、胰腺、肾上腺、子宫、卵巢、睾丸、前列腺等做病理学检查,其中对心、肝、脾、肺、肾、脑、肾上腺、垂体、睾丸、子宫、卵巢称重,计算脏器指数。
各组余下10只大鼠,停药2周后(恢复期)同前处理,观察药物的毒性反应、可逆程度及可能出现的延迟性毒性反应。

2 结果
2.1 药物对大鼠凝血指标的影响
给药4周,与对照组比较,金银花超微粉与普通粉各剂量组APTT、PT均无显著差异(P>0.05);停药2周,与对照组比较,金银花超微粉与普通粉各剂量组的APTT和PT与同期对照组比较,均无显著差异(P>0.05)(表1)。
2.2 对大鼠血液学指标的影响
给药4周及停药2周各给药组血液学其他各项指标值均在正常生理范围内,与对照组比较,均无显著差异(P>0.05)(表2和表3)。
2.3 药物对大鼠血液生化指标的影响
给药4周,金银花超微粉低剂量组总蛋白略低于对照组(P<0.05),但其值均在正常生理范围内;停药2周,普通粉中剂量组谷草转氨酶略高于对照组(P<0.05),但其值在正常生理范围内;给药4周及停药2周各给药组其他各项血液生化指标均在正常生理范围内,与对照组比较均无显著差异(P>0.05)(表4~表7)。

表1 金银花超微粉与其普通粉各组凝血指标的比较

表2 给药4周金银花超微粉与其普通粉对大鼠血液学指标的影响
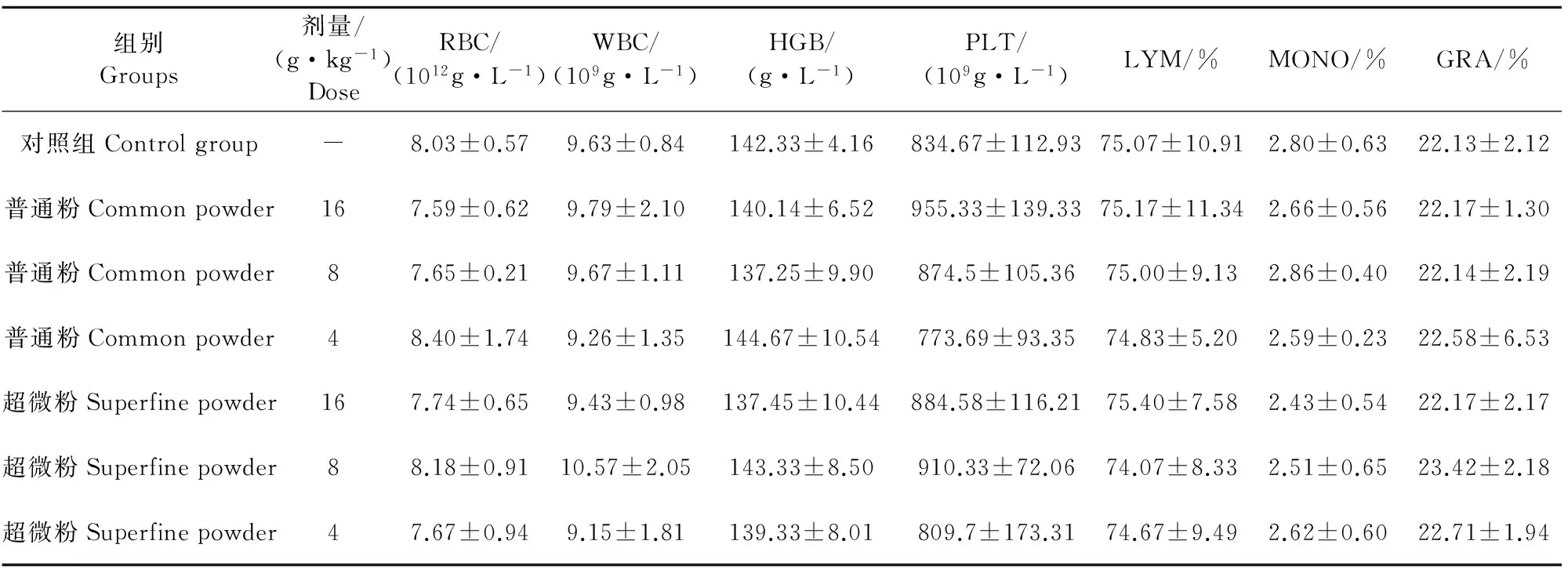
表3 停药2周金银花超微粉与其普通粉对大鼠血液学指标的影响

表4 给药4周金银花超微粉与其普通粉对大鼠生化指标的影响
注:与正常对照组比较,aP<0.05。
Note:Compared with the normal control group,aP<0.05.
2.4 药物对大鼠心电图的影响
给药4周及停药2周各给药组标准Ⅱ导联心电图PR间期、QRS间期、QT间期、T波波幅、心率等指标与对照组比较均无显著差异(表8和表9)。
2.5 药物对大鼠脏器指数的影响
给药4周及停药2周解剖大体观察各给药组动物脏器均未发现异常变化,各组脏器指数均在正常生理范围内,与对照组比较均无显著差异(表10~表13)。

表5 给药4周金银花超微粉与其普通粉对大鼠生化指标的影响
注:与正常对照组比较,aP<0.05。
Note:Compared with the normal control group,aP<0.05.

表6 停药2周金银花超微粉与其普通粉对大鼠生化指标的影响
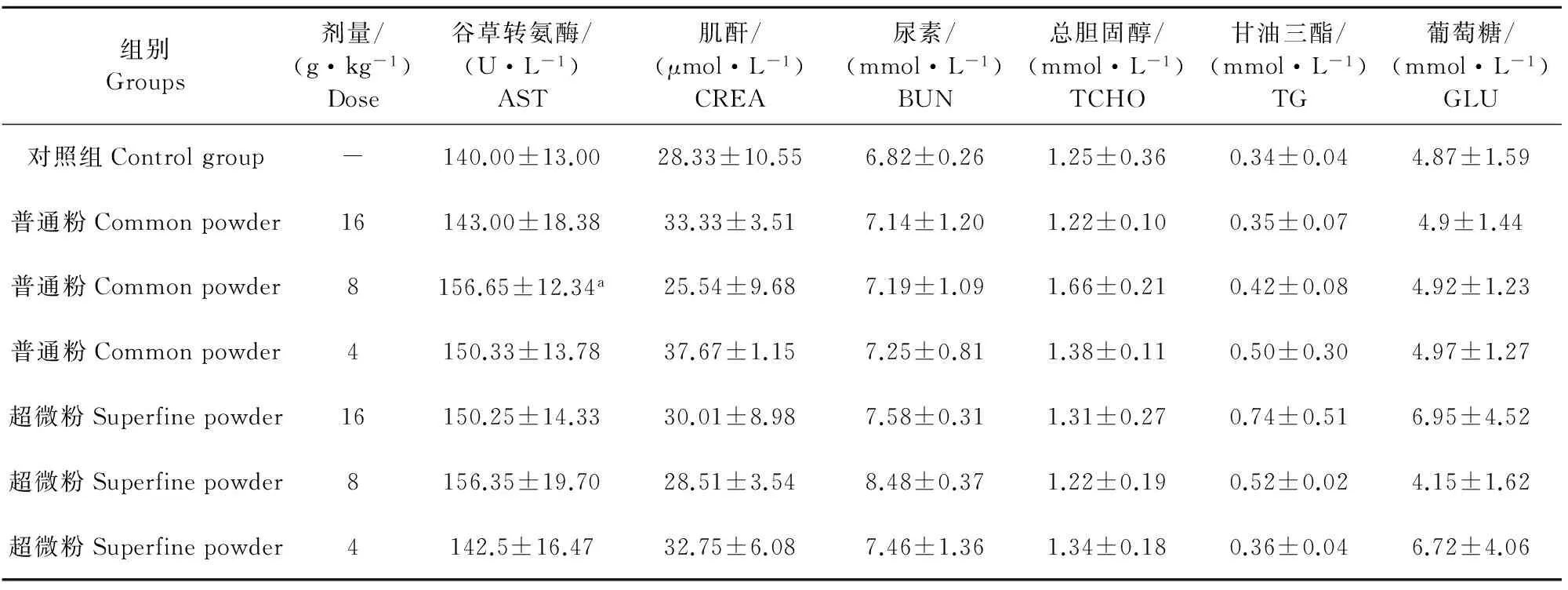
表7 停药2周金银花超微粉与其普通粉对大鼠生化指标的影响
注:与正常对照组比较,aP<0.05。
Note:Compared with the normal control group,aP<0.05.
2.6 金银花超微粉与其普通粉重复给药后病理学检查结果
金银花超微粉与其普通粉各给药组连续给大鼠灌胃给药4周及停药2周后,解剖时大体观察可见,所有脏器表面光滑,色泽正常,各组间差异不显著。显微镜下并拍照观察,金银花超微粉和金银花普通粉各给药组的心、肝、脾、肺、肾、肾上腺、胃、小肠、结肠、十二指肠、胰腺、脑、睾丸、前列腺、卵巢、子宫、胸腺、垂体、甲状腺、膀胱等脏器形态与对照组基本一致,均未见明显中毒性病理变化,本试验未见金银花超微粉与普通粉存在明显的毒性反应。

表8 给药4周金银花超微粉与其普通粉对大鼠心电图的影响

表9 停药2周金银花超微粉与其普通粉对大鼠心电图的影响
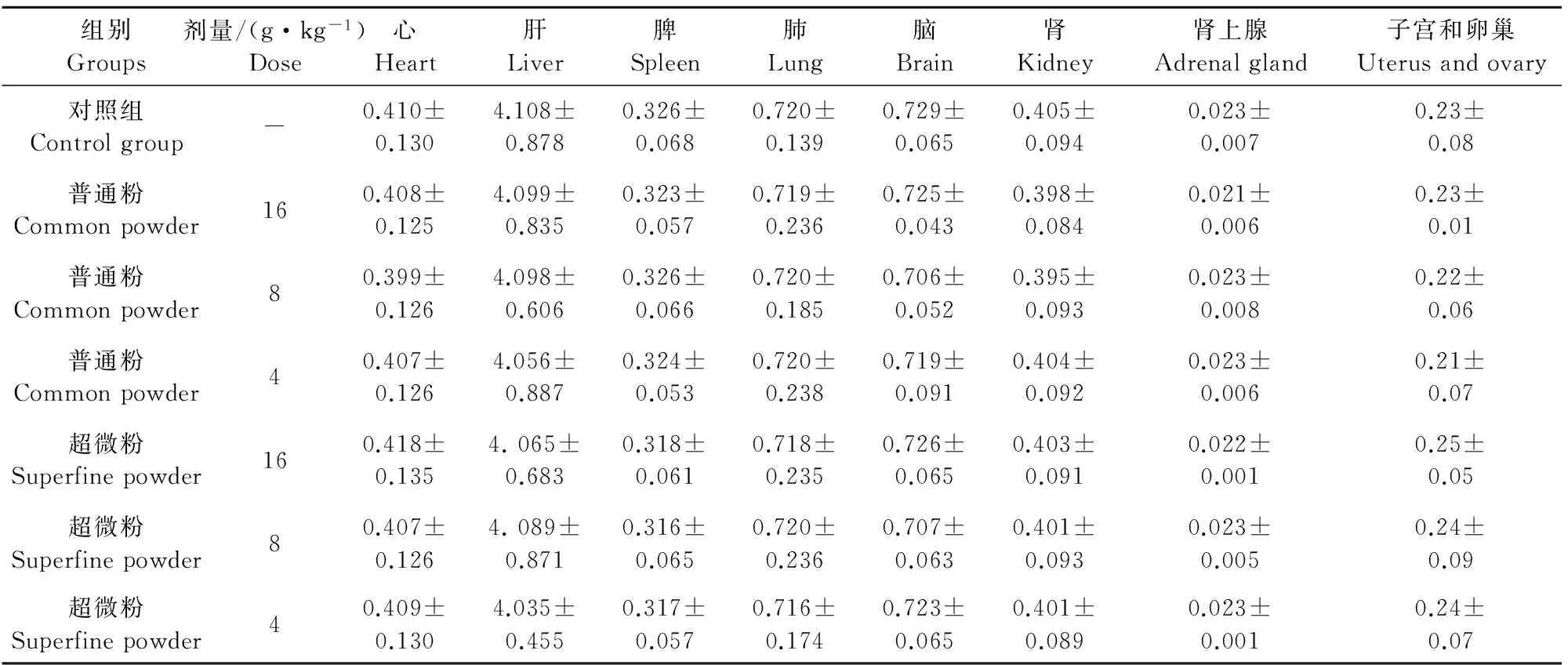
表10 给药4周金银花超微粉与其普通粉对雌性大鼠脏器指数的影响

表11 给药4周金银花超微粉与其普通粉对雄性大鼠脏器指数的影响

表12 停药2周金银花超微粉与其普通粉对雌性大鼠脏器指数的影响

表13 停药2周金银花超微粉与其普通粉对雄性大鼠脏器指数的影响
3 讨论
金银花超微粉与其普通粉各种剂量组大鼠连续灌胃给药4周及停药2周后,其精神状态、体重、摄食量、心电图、凝血时间、血液学、血液生化指标、脏器指数等均无明显异常,个别数据与对照组比较有统计学差异,但均在正常生理范围内。大体病理变化及镜下检查各脏器均未见明显中毒性病理改变。表明金银花超微粉与其普通粉均无严重毒性反应。
本试验研究结果表明,金银花超微粉与传统粉重复用药对大鼠未见明显毒性反应,长期服用安全,为临床用药安全性提供参考依据。
[1] 白文荣.金银花的药理作用及应用[J].中国卫生产业,2016,13(34):132-134.
[2] 赵梦姣.金银花的有效成分及药理学研究进展[J].世界最新医学信息文摘,2016,16(79):33-34.
[3] 蔡光先,杨永华,李跃辉.超微粉体技术与中药饮片改革[J].世界科学技术,2004,6(2):67-70,87.
[4] 王鹏军.单味中药超微饮片的研制与开发探讨[J].当代医药论丛,2014,12(13):179.
[5] 张红刚,汪 妮,李顺祥,等.超微粉碎技术对中药有效成分提取效果影响研究[J].广州化工,2013,41(16):63-65.
[6] 申玲玲,杜 光,郭俊浩.超微粉碎对中药活性成分溶出度的影响[J].中国医院药学杂志,2011,31(14):1213-1214,1230.
[7] 马喜军.超微饮片与传统饮片保和丸治疗小儿厌食症效果对比研究[J].社区医学杂志,2014,12(2):11-13.
[8] 张祥伟.中药超微饮片与传统饮片化学成分及药效学剂量对比研究[D].广东广州:南方医科大学,2010.
[9] 袁 超.中药超微饮片的成分组成与原药材成分的差异分析[J].中国医药指南,2013,11(12):79-80.
[10] 汪文涛.中药超微饮片质量控制与安全性探讨[J].世界科学技术,2004,6(3):37-40,54-86.
[11] 谭 文.黄连超微饮片的成分组成与原药材成分的差异分析[J].求医问药,2012,10(11):838-839.
[12] 彭安堂,张桂侠,赵玉斌,等.超微粉碎中药的安全性思考[J].中国医院药学杂志,2015,35(21):1973-1976.
[13] 蔡光先.超微中药的临床有效性与安全性研究及其思考[J].中华中医药学刊,2010,28(9):1801-1804.
[14] 蔡光先,李勇敏,郑 兵,等.中药超微饮片量效关系及安全性初探[J].中国新药杂志,2007,16(9):682-684.
[15] 蔡光先.超微中药的研究与应用及前景展望[J].世界中医药,2011,6(01):78-81.
[16] 谢云亮.五味子有效成分分离纯化及对记忆障碍模型小鼠学习记忆的影响[D].吉林长春:吉林大学,2013.

