以急腹症为首发症状的华氏巨球蛋白血症1例
冯晓宁,国 巍,白 鸥
(吉林大学第一医院 血液科,吉林 长春130021)
华氏巨球蛋白血症(WM)是一类少见的由小B淋巴细胞、浆细胞样淋巴细胞和浆细胞组成的惰性非霍奇金淋巴瘤(NHL)。该病年发病率为3.8/100万,占所有血液恶性肿瘤的2%,占B细胞淋巴瘤的2.3%[1]。好发于60岁以上的老年男性。其临床表现呈多样性,以血象异常、肝脾淋巴结肿大、高黏滞综合征及周围神经病变为主。以急腹症发病的患者少见,现将本院收治的1例以急腹症为首发症状的 WM 患者的诊断、鉴别及治疗情况分析报道如下。
1 临床资料
患者男性,66岁,因脾大5年、腹痛1周于2015年11月30日以急腹症入我院普通外科。5年前体检发现脾大,未在意,未曾治疗。入院查血常规WBC 102.69×109/L,LY 90.94×109/L,RBC 3.07×1012/L,HGB 74 g/L,PLT 168×109/L。给予输血及骨髓穿刺后以“白细胞增高待查”转入血液科,查体:重度贫血貌,浅表淋巴结未触及明显肿大,腹膨隆,轻压痛,以下腹部为主,无反跳痛及肌紧张,脾肋下8 cm,质韧,边缘光滑,无压痛,心肺查体未见明显异常,双下肢无浮肿,神经系统查体未见异常。转入后血常规:WBC 42.72×109/L,LY 37.60×109/L,HGB 51 g/L,MCV 79.9fL,PLT 140×109/L;凝血及溶血相关检查均为阴性;免疫五项:Ig M 8.70 g/L;蛋白电泳M片段15.9%;血清免疫固定电泳 IgM λ 阳性;β2微球蛋白4.85 mg/L。腹部彩超:血性腹水,深度11 cm。PET-CT:全身多发淋巴结肿大(双侧颈部、颌下、双侧锁骨上、双侧肺门及纵隔、肝门区、胃小弯侧、胰腺周围、肠系膜、双侧腹股沟等)伴代谢轻度增高,SUV最大值1.9-5.8,考虑淋巴瘤,其中门腔间隙区域较大病灶考虑其内伴出血。脾大,代谢增高,SUV值6.1,考虑淋巴瘤浸润。全身骨骼代谢不均匀增高,CT未见异常。骨髓涂片:淋巴细胞比例增高,占65%,均为成熟阶段的淋巴细胞(图1)。骨髓活检及病理:HE及PAS染色:骨髓增生较活跃(70%),一类异型淋巴细胞片状分布,胞体小,胞浆少,核圆形或略不规则,染色质粗,偏成熟阶段粒红系细胞散在分布,巨核细胞不少,分叶核为主。IHC:CD20+、PAX5+、CD38部分细胞+、CD138部分细胞+、CD19弱+、CD56-、CD5-、CD10-、BCL6-、CD23-、CyclinD1-、CD103-、CD25-、CD11c-、CD3-。诊断:CD5-CD10-小B细胞淋巴瘤侵犯骨髓,待除外淋巴浆细胞淋巴瘤后考虑脾脏B细胞边缘区淋巴瘤伴浆样分化(图2)。骨髓流式细胞仪检测:异常细胞群占76.68%。干祖细胞标记CD38-,CD34+。淋系标志:CD19+,CD22+,CD20+,CD200+,CD23+,CD79b+,Lambda str+。CD5-,CD10-,FMC7-,Kappa-,CD103-,CD25-,CD7-。髓系标志:CD33-。其他标志:HLA-DR+,CXCR4+,cKi67-,cBcl-2-。为异常单克隆成熟B淋巴细胞(图3)。MYD88(L265P)阳性(PCR扩增法)(图4)。共引流出腹水约850 ml,给予腹水流式检测,结果与骨髓流式结果相一致。
综上,该患者临床诊断为华氏巨球蛋白血症/淋巴浆细胞淋巴瘤IV期A(WM-IPSS评分4分,高危组)。腹痛症状经腹腔穿刺引流好转后,给予R-COP方案(环磷酰胺600 mg,d1-2;长春地辛2 mg,d1-2;强的松50 mg 2/日,d1-5;美罗华600 mg,d3-4)化疗2疗程,1疗程后脾脏缩小为肋下6 cm,血常规WBC 4.47×109/L,HGB 67 g/L,PLT 61×109/L,疗效评价SD。2疗程后骨髓涂片及流式检查未见异常细胞,但Ig M下降不明显(Ig M 8.92 g/L),左侧腋窝出现38 mm×17 mm大小淋巴结,疗效评价PD,更换为VD方案(硼替佐米1.3 mg/m2,d1,8,15,22;地塞米松20 mg,d1-2,8-9,15-16,22-23)化疗1疗程,复查腋窝淋巴结较前缩小55%,Ig M 5.57g/L(降低37.56%),脾脏进一步缩小,2疗程后腋窝淋巴结消失,Ig M 2.62g/L(降低70%),脾脏缩小58%,疗效评价PR。后因经济原因口服沙利度胺2月后结束治疗,随访至今患者处于疾病稳定状态。
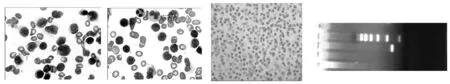
图1骨髓涂片(瑞氏染色,10×100倍镜)图2骨髓活检(HE染色,10×40倍镜)图3MYD88阳性(PCR扩增法)
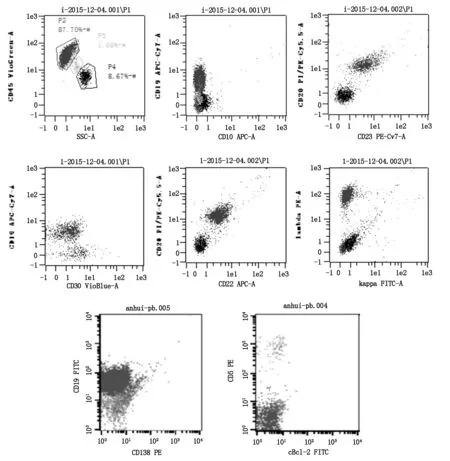
图4 流式细胞检测
2 讨论
华氏巨球蛋白血症是一种少见的惰性成熟B细胞淋巴瘤,来源于向浆细胞分化的外周B淋巴细胞,表达B细胞抗原。发病机制目前尚不明确,近期国外几项研究考虑与肝炎病毒C感染有关。分子遗传学方面,约42%的患者伴有6q21 缺失,但不是该疾病的特异性改变[2,3]。
WM最常侵犯骨髓、淋巴结和脾脏,约20%的患者出现脾脏肿大,但因病变侵犯脾脏导致癌性腹水,以急腹症为首发症状的病例并不常见。本例患者因癌性腹水导致急腹症入院,发现血常规中白细胞及淋巴细胞异常增高、脾大而转入血液科诊治。根据NCCN指南及中国专家共识中提出的WM诊断标准[4],该疾病诊断的核心包括血清中存在单克隆IgM型免疫球蛋白、骨髓内可以见到典型的淋巴浆细胞及存在相关的临床症状3方面,该患者相关检查提示,血清中单克隆IgM型免疫球蛋白明显升高,骨髓免疫病理提示CD5-CD10-小B细胞淋巴瘤侵犯骨髓,流式结果为异常单克隆成熟B淋巴细胞(CD5-CD10-),表型不似典型B-CLL、FL、HCL、MCL。该例患者临床表现及辅助检查缺乏特异性,需与其他B细胞淋巴瘤鉴别。不存在CD23与CD5同时阳性,可除外慢性淋巴细胞白血病[5];CyclinD1阴性可除外套细胞淋巴瘤;CD10、bcl-6阴性可除外滤泡细胞淋巴瘤。但与脾边缘区淋巴瘤(SMZL)的鉴别诊断存在一定的难度。SMZL原发于脾脏,部分患者存在血清免疫球蛋白升高,且主要为Ig M型,但骨髓病理中CD21+、CD23+FDC网作为生发中心初步或者部分形成的标志是SMZL的常见表现,而在WM中十分少见;CD138阳性的浆细胞是WM的特点。本例患者骨髓中CD138部分细胞阳性、CD23-且MYD88阳性;MYD88阳性虽不是WM的特征性分子标志物,但90%以上的患者存在MYD88 L265P 基因突变[6],可作为诊断WM的重要辅助手段,综合以上检查最终诊断为WM。
WM属于惰性淋巴瘤,临床上约25%-30%患者无症状,对于无临床症状的患者可随访观察;就诊时已有症状或疾病进展时应立即治疗[7]。本例患者需要治疗。WM的治疗方法包括血浆置换、放化疗及造血干细胞移植。因兼顾CD20+肿瘤细胞及浆细胞特征,在利妥昔单抗基础上联合化疗仍为目前主要的治疗方案,尤其对WM相关的血细胞减少或器官肿大患者,可尽快达到降低肿瘤负荷的目的。方案包括利妥昔单抗联合使用烷化剂、嘌呤类似物等。虽然R-CHOP方案仍是被推荐方案,但近几年蒽环类药物在WM中的治疗地位受到了质疑,有研究结果显示R-CVP(环磷酰胺,长春新碱,泼尼松)或R-CP(环磷酰胺,泼尼松)方案与R-CHOP疗效相当,不良反应发生率更低[8]。利妥昔单抗和氟达拉滨治疗 WM 有良好的疗效,有效率高达95.3%,中位时间至51.2个月,有研究提示再增加环磷酰胺反而增加不良反应的发生[9]。因此利妥昔单抗联合化疗的最优一线方案仍需继续研究与探索。本例患者以腹痛、脾脏肿大入院,诊断后立即给予R-COP治疗,1疗程后患者腹痛症状缓解,脾脏较前缩小。2疗程后出现新发肿大的淋巴结,且检验提示血清Ig M 仍偏高,疾病进展。以硼替佐米或氟达拉滨为主的方案可降低IgM水平,遂给予该患者2疗程硼替佐米联合地塞米松治疗,获得PR。对于复发难治患者,梅奥诊所的研究提示对于一线治疗2年后复发的患者,可继续应用原一线方案,而2年内复发的患者,应选择其他一线治疗方案[10]。对MYD88阳性的WM复发难治患者,也可给予BTK抑制剂依鲁替尼。研究数据显示,使用依鲁替尼的总体缓解率达90%,其中主要缓解率达到70%以上[11,12]。另外研究发现自体干细胞移植能够明显提高患者的OS和EFS[13],是WM挽救治疗的重要选择之一。一项探讨自体及异体干细胞移植在治疗WM临床作用的研究提示,自体干细胞移植治疗WM可获得良好的效果,但异体干细胞移植治疗WM仅在多次复发难治且一般状况较好的患者中选择性进行[14]。达到疾病平台期即可结束治疗或进入维持治疗,该患者因经济原因化疗4疗程后给予沙利度胺维持治疗,目前病情稳定。
综上,华氏巨球蛋白血症临床上少见,多起病缓慢,临床表现常不典型,容易漏诊。恶性程度较低,但仍不可治愈,在利妥昔单抗的基础上联合烷化剂和(或)嘌呤类似物是目前初治患者的标准诊疗方案,但中位反应时间较长。复发难治患者可应用新药依鲁替尼。本例以急腹症起病,症状缺乏特异性,诊治中体会:① 脾脏肿大、淋巴细胞增高的急腹症患者,切勿盲目手术治疗,该患者入我科后,快速完善MICM分型,明确诊断,避免延误病情;②WM无特异的形态学、免疫表型及遗传学改变,本例结合骨髓免疫表型、血清单克隆IgM型免疫球蛋白及MYD88阳性明确诊断; ③本例患者给予一线R-COP方案治疗后疾病进展,给予硼替佐米联合地塞米松治疗,获得PR。对疾病进展伴IgM升高WM患者的治疗有参考价值。
[1]Gertz MA.Waldenstrom macroglobulinemia:2015 update on diagnosis,risk stratification,and management.[J].Am J Hematol,2015,90(4):346.
[2]Vitolo U,Ferreri A J,Montoto S.Lymphoplasmacytic lymphoma-Waldenstrom's macroglobulinemia[J].Critical Reviews in Oncology/hematology,2008,67(2):172.
[3]易树华,邱录贵.淋巴浆细胞淋巴瘤/华氏巨球蛋白血症发病机制研究进展[J].中华血液学杂志,2014,35(6):568.
[4]中国抗癌协会血液肿瘤专业委员会,中华医学会血液学分会白血病淋巴瘤学组,中国抗淋巴瘤联盟.淋巴浆细胞淋巴瘤/华氏巨球蛋白血症诊断与治疗中国专家共识(2016年版)[J].中华血液学杂志,2016,37(9):729.
[5]陈文明,黄晓军.血液病学[M].北京:科学出版社,2012:367.
[6]Treon S P,Xu L,Yang G,et al.MYD88 L265P somatic mutation in Waldenstrom's macroglobulinemia[J].New England Journal of Medicine,2012,367(9):826.
[7]Anderson K C,Alsina M,Bensinger W,et al.Waldenstrom's macroglobulinemia/lymphoplasmacytic lymphoma,version 2.2013[J].Journal of the National Comprehensive Cancer Network Jnccn,2012,10(10):1211.
[8]Treon SP.How I treat Waldenstrom macroglobulinemia[J]Blood,2009(12):2375.
[9]Treon S,Branagan A L,Soumerai J,et al.Long-term outcomes to fludarabine and rituximab in Waldenstrom macroglobulinemia[J].Blood,2009,113(16):3673.
[10]Ansell SM,Kyle RA,Reeder CB,et al.Diagnosis and Management of Waldenstrom Macroglobulinemia:Mayo Stratification of Macroglobulinemia and Risk-Adapted Therapy (mSMART) Guidelines[J].Mayo Clinic Proceedings,2010,85(9):824.
[11]Treon SP,Tripsas CK,Meid K,et al.Ibrutinib in previously treated Waldenstrom's macroglobulinemia[J].N Engl J Med,2015,372:1430.
[12]Dimopoulos M A,Trotman J,Tedeschi A,et al.Ibrutinib for patients with rituximab-refractory Waldenstrom's macroglobulinaemia (iNNOVATE):an open-label substudy of an international,multicentre,phase 3 trial[J].Lancet Oncology,2017,18(2):241.
[13]Usmani S,Sexton R,Crowley J,et al..Autologous stem cell transplantation as a care option in Waldenstrom’s macroglobulinemia[J].Clin Lymphoma Myeloma Leuk,2011,11(1):139.
[14]Gertz MA,Reeder CB,Kyle RA,et al.Stem cell transplant for Waldenstrom macroglobulinemia:an underutilized technique[J].Bone Marrow Transplant,2012,47(9):1147.

