围小丛壳菌山茶专化型与葡萄座腔菌复合侵染引致茶褐枯病
张永乐,刘会香*,许永玉,何邦令*,郑金柱
围小丛壳菌山茶专化型与葡萄座腔菌复合侵染引致茶褐枯病
张永乐1,刘会香1*,许永玉1,何邦令1*,郑金柱2
1. 山东农业大学植物保护学院/山东省林业有害生物防控工程技术研究中心, 山东 泰安 27018; 2. 徂徕山林场,山东 泰安 271027
在山东日照东港区茶园茶树叶部发现一种新病害。感病部位缢缩,畸形,病斑褐色,坏死,命名为茶褐枯病。取病健交界处采用组织分离法共获得两种微生物,编号为RC4、RC3,分离率分别为67.1%和32.9%。结合微生物形态学、培养学、多基因序列分析和柯赫氏法则验证,明确该病害由围小丛壳菌山茶专化型(f.sp.)和葡萄座腔菌()复合侵染引起。这也是首次在茶树叶部发现的危害。
茶树;葡萄座腔菌;围小丛壳菌山茶专化型;复合侵染;鉴定
茶为山茶科木本植物茶的芽叶,具有降压、提神、保健等功效[1]。山东省自1959年实施“南茶北引”计划以来,现已成为我国最北的茶树种植区[2]。据报道,全世界茶树病害有380余种,我国发生普遍的约30余种[3]。常见危害叶部的病害有茶云纹叶枯病()、茶芽枯病(Chen et Hu sp)、茶轮斑病()、茶炭疽病(sp.)、茶赤叶斑病(Petch)、茶灰星病(Hara)[4-6]等。随着茶树栽植面积的不断扩大和品种更换,茶树叶部病害及病原出现新的变化。作者在山东省日照东港茶区茶树叶部发现一种新病害,病害田间发病率达20%,对茶叶的产量和品质造成一定的影响,本文在病害症状描述的基础上,重点对病原菌进行了分离、鉴定及致病性测定,明确了病原菌的分类地位,研究结果为病害的科学防控提供理论依据。
1 材料与方法
1.1 症状观察
2016年8月,在日照东港区厉家顶子村瑜山茶场(35°46′N,119°42′E)调查茶褐枯病危害,记录病害症状,观察病斑危害部位,颜色、形状,测量病斑大小[7]。并将具典型症状的病叶采集,用于室内分离。
1.2病原菌分离纯化
参照方中达组织分离法[8]分离病健组织,置于PDA培养基28℃下进行黑暗培养。样品重复30次,统计分离出的两种微生物比例,并编号为RC4和RC3,相同条件下继续纯化培养。
1.3 病原菌鉴定
1.3.1 培养学和形态学观察
逐日观察微生物在PDA培养基上菌落形态及颜色变化,在3、5、8 d时用十字交叉法测定菌落直径,计算生长速度。
待RC4培养4 d后回接到叶片,继续培养10 d至产生橘红色孢子堆,镜检其显微特征,无菌水将分生孢子配成悬浮液,取60 μL悬浮液滴于凹载玻片上28℃黑暗条件下培养12 h后[9],观察附着孢的形态和大小。
待培养7 d后,在RC3菌落边缘取直径为7 mm的菌饼转接至松树煎汁培养基[10],培养至产生子实体,显微观察分生孢子器和分生孢子形态特征。
1.3.2菌丝收集及DNA的提取
取PDA培养6 d的菌丝,采用2×CTAB[11]法提取菌株总DNA。
1.3.3 PCR扩增与序列测定
以RC4总DNA为模板,对和基因进行PCR扩增,以RC3总DNA为模板,对和基因进行PCR扩增。所用引物序列、退火温度见表1。每个反应体系总体积均为40 μL,PCR产物经纯化后送华大基因科技股份有限公司进行双向测序。
1.4 多基因系统发育树的构建
从NCBI的BLAST程序GenBank数据库中下载模式菌株序列为参考,与供试菌株采用Mega5.1中ClustalW进行比对,菌株RC3以[16]为外源序列,各基因序列剪切后以的顺序拼接。选择作为菌株RC4的外源序列,以的顺序首尾拼接,自展法(Bootstrap)检测,重复1 000次,构建邻接树(Neighbor- Joining Tree)。
1.5 致病性测定
对两株真菌分别接种和混合接种。选取新鲜的成熟健康茶树叶片,用75%酒精表面消毒,叶基部用脱脂棉保湿。单接直接选取直径7 mm菌丝块进行刺伤和无伤接种[17]。混合接种选取贴有纤维素膜培养7 d的菌落,揭膜剪碎菌丝等比例混合,用7 mm打孔器分割后,分别接种于主脉两侧,作为有伤接种点和无伤接种点,叶尖部接种PDA培养基作为对照,其余部位接种供试菌株,每个处理重复8个叶片。处理后的叶片置于内有2层纱布的无菌培养皿中,于28℃、湿度95%、12 h光暗交替的人工培养箱中培养[18],定期观察病斑扩展特点。待发病后再次进行组织分离、培养,观察菌落形态及子实体特征,并与原菌株进行对比。
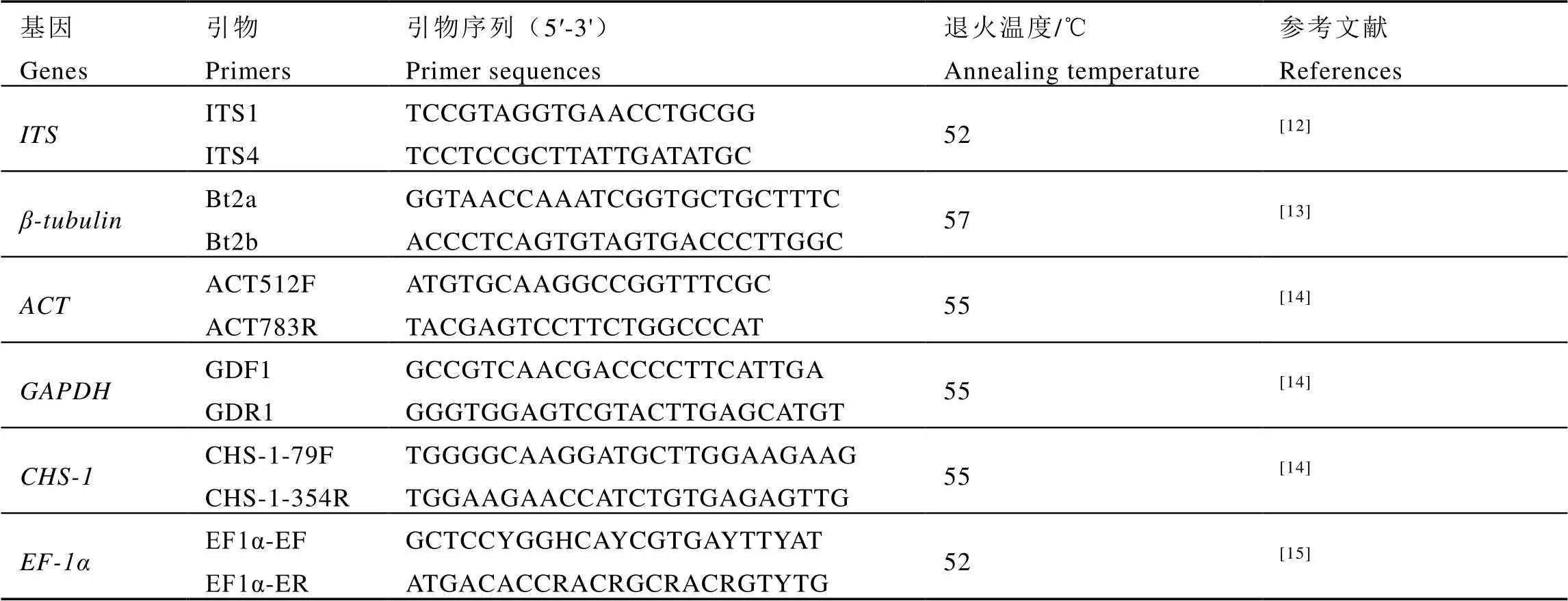
表1 本研究所用的引物及扩增条件
2 结果与分析
2.1 病害症状观察
该病害发病初期,病斑部位呈褐色点状,后病斑扩大成片,病健交界明显,病斑部位明显缢缩(图1-A、图1-B),畸形。病斑蔓延迅速,最后导致叶片坏死(图1-C)。
2.2 病原菌分离结果
共分离到2种微生物,编号分别为RC4(分离率67.1%)和RC3(分离率32.9%)。
2.3 病原菌鉴定
2.3.1 菌落和子实体形态特征
菌株RC4在PDA培养基上菌丝呈绒毛状,边缘白色,中间隆起并有黑色素沉积,背面可见灰色环状物,生长速度12.3 mm·d-1(图2-A,图2-B)。分生孢子盘状埋生于叶片表皮下,黑褐色或无色,盘状,底部扁平或稍凹陷,周生黑色刚毛。分生孢子梗无色短线状,单根,顶生一个分生孢子。分生孢子圆柱形,两端钝圆,大小为(19.7±0.7) μm×(5.4±0.6) μm(图2-C,图2-D)。附着胞黑褐色,椭圆形或不规则形,大小为(8.7±0.7) μm×(5.8±0.8) μm(图2-E)。根据菌落形态及子实体特征,初步鉴定其为炭疽菌(sp.)。
分离纯化的菌株RC3在PDA培养基上培养,菌丝初为白色,5~6 d变为灰色,15 d后变为黑色,菌丝生长迅速(24.3 mm·d-1),气生菌丝发达,呈棉絮状(图3-A)。在松树煎汁培养基上培养29 d后,产生黑色圆球形分生孢子器,单腔室(图3-B)。分生孢子纺锤形或长椭圆形,单胞,无色(图3-C),大小为(15.1~28.1) μm×(4.7~7.9) μm。根据菌落形态及子实体特征,初步鉴定其为葡萄座腔菌。
2.3.2 病菌分类地位及系统树构建
多基因系统树显示(图4),RC4菌株与炭疽菌有性阶段围小丛壳菌山茶专化型(f. sp.)模式株ICMP10643聚为一枝,且支持率为87%,外源序列独立成族。
供试菌株RC3与参考菌株分为三大族(图5),和供试菌株遗传距离较近,组成第Ⅰ族,RC3与模式菌株DA21111、CMW9075聚为一枝,置信率为99%;第Ⅱ族由与组成;外源序列独立成簇,形成第Ⅲ族。
结合形态学鉴定结果,从茶树病叶上分离的真菌菌株RC3为葡萄座腔菌()。RC4为围小丛壳菌山茶专化型(G.f. sp.)。

注:A:早期正面症状,B:早期背面症状,C:晚期症状。
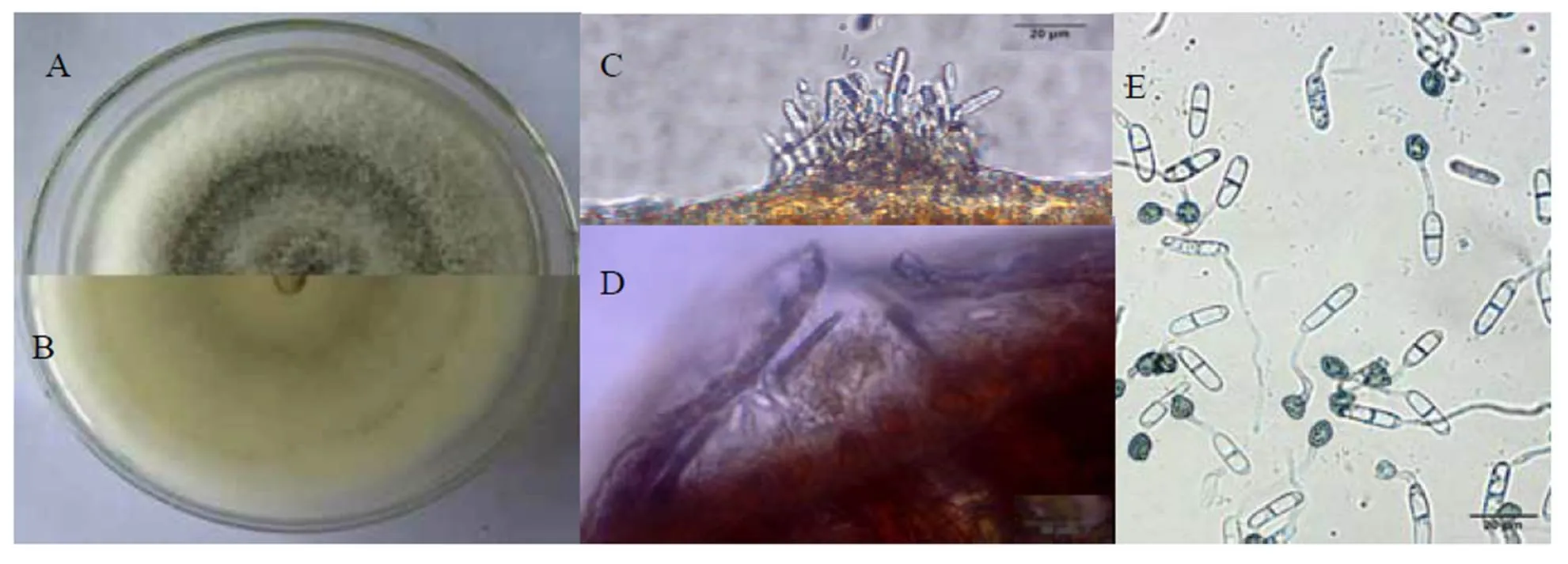
注:A:菌落正面特征,B:菌落背面特征,C~D:分生孢子器结构,E:分生孢子和附着胞形态。
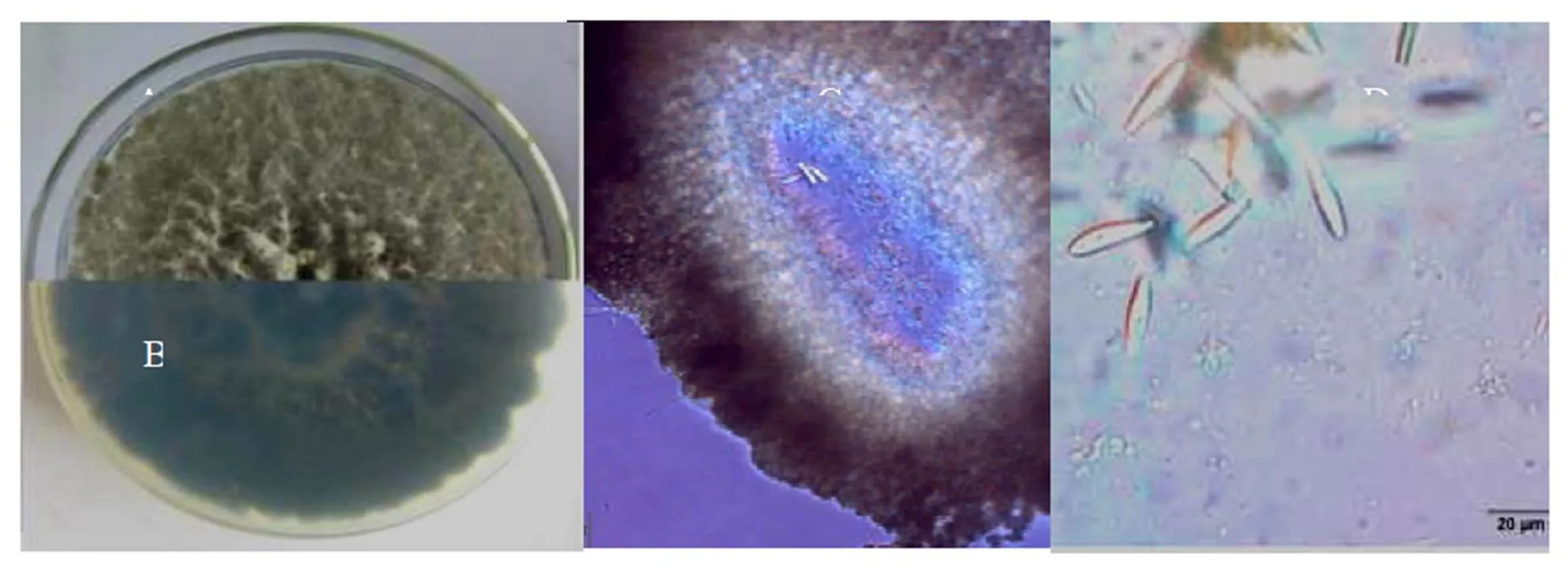
注:A:PDA 上菌落正面特征,B:菌落背面特征,C:子实体结构,D:分生孢子形态。

图4 RC4基于ITS-CHS-1-GAPDH-ACT-β-tubulin基因合并序列NJ炭疽菌系统发育树
2.4 致病性测定
菌株RC3伤口接种发病率达86.7%。叶片接种第5天开始发病,第8天时测得病斑直径为0.6~1.7 cm(图6-a2,图6-b2)。接种RC4的有伤口接种点第3天开始发病,第8天时发病率达100%,病斑直径2.1~2.8 cm,并产生橘红色孢子堆。混合接种的30个接种点,伤口接种发病率同为86.7%,第8天病斑直径2.1~3.0 cm。继续进行接种感病组织的分离培养,获得和原接种相同的病菌。而无伤接种(图6-a1,图6-b1)和对照(图6-c1,图6-c2)均未发病,说明葡萄座腔菌和炭疽菌可通过伤口侵染茶树叶片,符合柯赫氏法则,说明茶叶褐枯病由葡萄座腔菌和炭疽菌复合侵染所致。
根据病原菌的分离率和回接发病历程,炭疽菌RC4侵染能力强,在茶树叶片上优先定殖于寄主组织,是引起病害的主要病原。葡萄座腔菌RC3致病性较弱,病斑扩展慢,是次要病原菌。
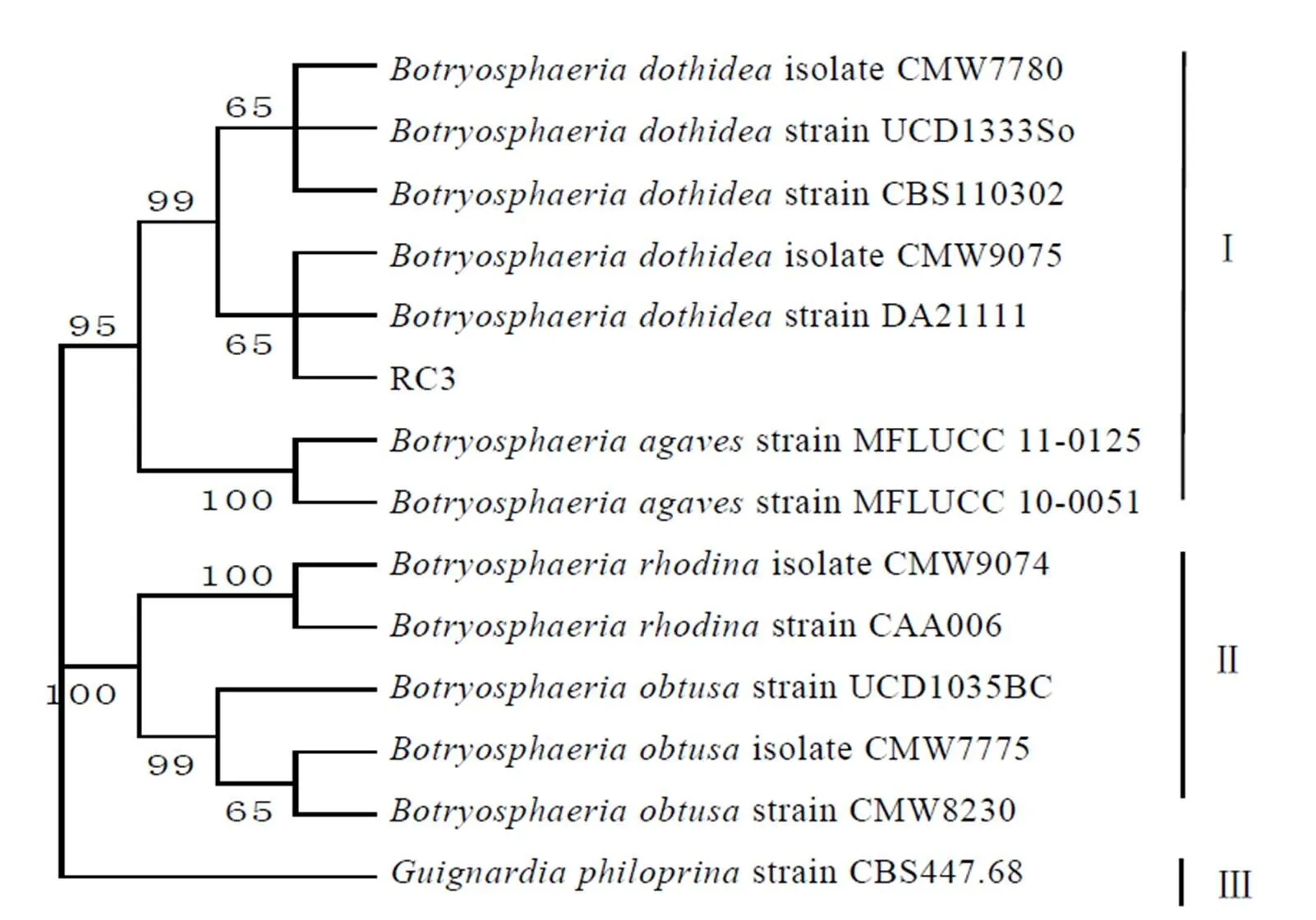
图5 RC3 基于ITS-EF-1α-β-tubulin 基因合并序列NJ 葡萄座腔菌系统发育树
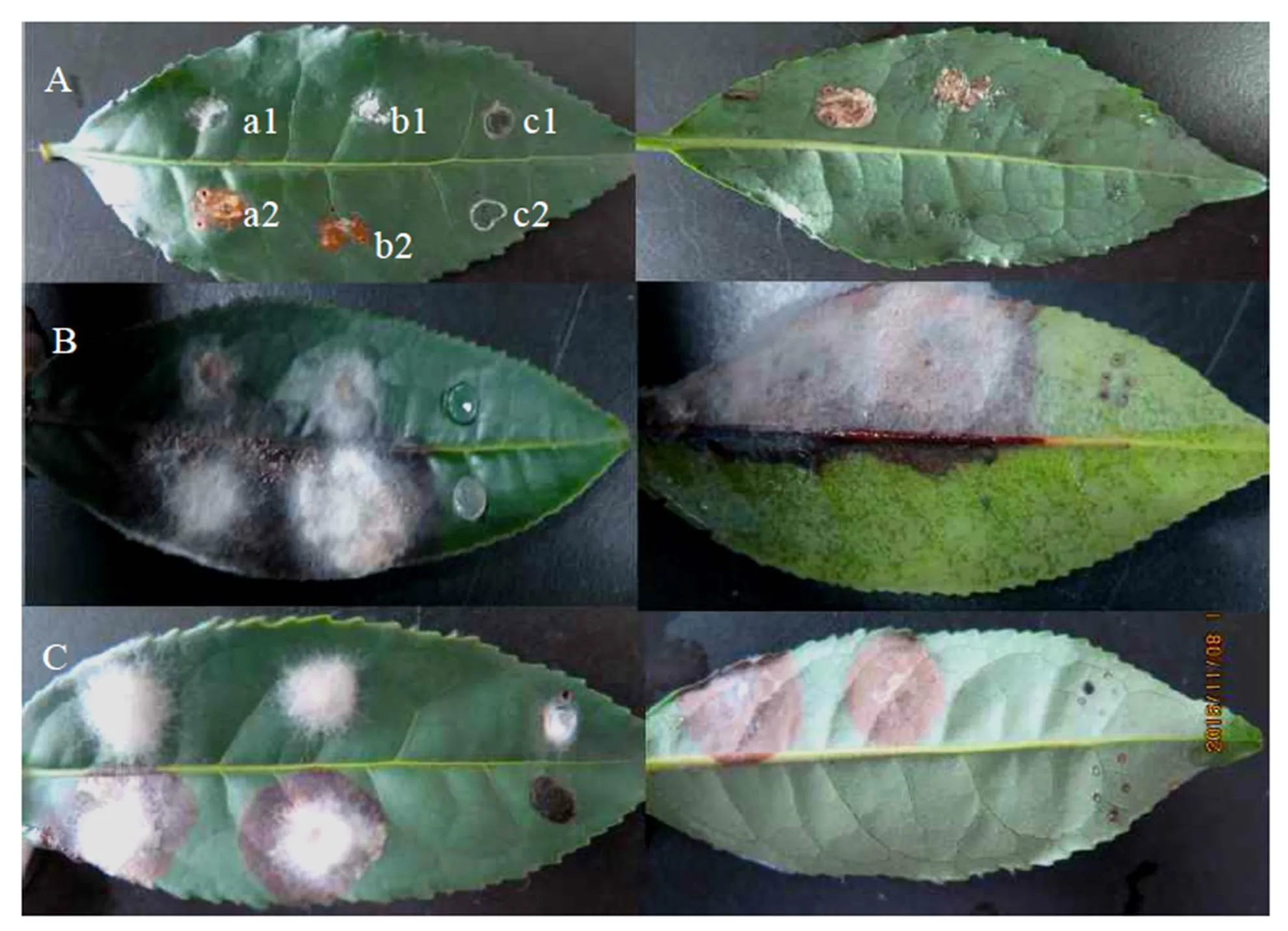
注:A:接种RC3,B:接种RC4,C:同时接种;a1、b1:无伤接种病原菌,a2、b2:有伤口接种病原菌,c1:无伤接种PDA,c2:有伤接种PDA。
3 结论与讨论
由围小丛壳菌山茶专化型和葡萄座腔菌复合侵染引起的茶褐枯病目前尚未见报道。本研究从日照东港区瑜山茶场疑似褐枯病的茶树叶片中分离到两种真菌,采用培养学、形态学、多基因序列分析和柯赫氏法则,证实围小丛壳菌山茶专化型与葡萄座腔菌复合侵染引致茶叶褐枯病。炭疽菌危害寄主广泛,为害茶树叶部已有很多研究[1],但与葡萄座腔菌复合侵染茶树叶部为首次报道。
葡萄座腔菌是一类全球性分布的农林业重要病原菌[19-20],又可作为内生菌寄生于植物组织内部,同时可寄生于一些衰弱的植物组织上引起枝干溃疡、干腐、流胶及果实腐烂等症状,如杨树溃疡病、苹果轮纹病和桃流胶病等[21-25],但危害茶树叶部为首次发现。
本次调查的瑜山茶场管理粗放,杂草较多,病株残体未及时清理,可作为葡萄座腔菌的寄主来源;炭疽病发生普遍,成为该病害主要侵染源。另外,植株种植密度较大,通风不良,高温高湿,为两种病原菌的侵染提供了合适的生态环境条件。两种病原菌通过机械伤口侵入,雨水传播,因此在修枝整形时要避免雨季,对伤口实施必要的防护。炭疽病菌作为一个优势菌,其与葡萄座腔菌在病害中的各自作用机制尚需继续探讨。实际生产中,病原复合侵染的现象普遍,复合侵染过程与病原菌种类和致病力强弱、寄主植株生理阶段、抗感性和环境条件密切相关[26],正确认识病原菌间的相互作用规律,对病害的综合防治具有重要指导意义。
[1] 肖强. 茶树病虫害绿色防控技术与专业化防治模式[J]. 中国茶叶, 2012(5): 20-23.
[2] 谢思惠, 张丽霞, 刘峰, 等. 山东茶叶发展现状及研究进展[J]. 山东林业科技, 2007, 170 (3): 104-107.
[3] 孙晓玲.中国重要茶树叶部病害的研究现状及展望[J].中国茶叶,2016, 12(12): 12-15.
[4] 詹三良. 皖南茶区三种主要病害发生及防治初探[J]. 茶叶通报, 2016(4): 175-176.
[5] 张强, 杨云祥, 唐方圆, 等. 茶树主要病害及防治措施研究[J]. 中国农业信息, 2015, 6: 80-81.
[6] 戚利潮, 张叶大. 茶树主要病害及其防治[J]. 茶叶, 2016, 42(1): 10-12.
[7] 蒲国涛, 张锡友, 胡春学, 等. 汉中市城固县茶园病害调查及防治对策[J]. 陕西农业科学, 2014(7): 82-85.
[8] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 122-145.
[9] 汤铱泠, 周国英, 李河, 等. 多基因序列鉴定油茶炭疽病原新种[J]. 热带作物学报, 2015, 36(5): 972-977.
[10] 姚晟伟, 谢悦, 李兴红. 葡萄溃疡病病菌的诱导产孢方法评价[J]. 中外葡萄与葡萄酒, 2011(9): 4-7.
[11] 刘威, 陈玉森, 刘伟, 等. 茶树炭疽病的病原鉴定及其生物特性的研究[J]. 宁德师范学院学报(自然科学版), 2013, 25(1): 1-5.
[12] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M]//Innis M A, Gelfand D H, Sninsky J J, et al. PCR Protocols, A Guide to Methods and Applications. New York: Academic Press, 1990: 315-322.
[13] Glass NL, Donaldson GC. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes [J]. Appl Environ Microbiol, 1995, 61: 1323-1330.
[14] Weir B S, Johnston P R, Damm U. Thespecies complex [J]. Studies in Mycology, 2012, 73(1): 115-180.
[15] Carbone I, Kohn LM. A method for designing primer sets for speciation studies in filamentous ascomycetes. Mycologia, 1999, 91: 553-556.
[16] 王璠. 桃流胶病菌spp.鉴定、分布、遗传多样性及PCR快速检测技术研究[D]. 武汉: 华中农业大学, 2012.
[17] 刘威, 袁丁, 叶乃兴, 等. 茶树炭疽病病原鉴定[J]. 南方农业报, 2017, 48(3): 448-453.
[18] 姜晓龙, 金磊磊, 陈辉辉, 等. 1株侵染蓖麻的葡萄座腔菌菌株鉴定[J]. 江苏农业科学, 2015, 43(2): 319-322.
[19] Slipper B, Wingfield M J.as endophytes and latent pathogens of woody Plants:diversity, ecology and impact [J]. Fungal Biological Reviews, 2007, 21: 90-106.
[20] 徐成楠, 迟福梅, 冀志蕊, 等. 蓝莓葡萄座腔菌枝枯病研究进展[J]. 中国果树, 2014(5): 71-74.
[21] 朱琪丽, 赵会长, 谢甲涛, 等. 葡萄座腔菌侵染柑橘果实的报道[J]. 植物病理学报, 2017, 44(9): 1-6.
[22] 李文英, 李夏, 解开治, 等. 葡萄座腔菌科真菌的系统性和多样性探讨[J]. 生物多样性, 2017, 25(8): 874-885.
[23] 程燕林. 中国部分真菌的系统发育及模式菌的遗传多样性研究[D]. 北京: 中国林业科学研究院, 2012.
[24] 马翔, 迟文娟. 木棉干腐病病原鉴定及发病因素[J]. 中国森林病虫, 2014, 33(6): 1-4.
[25] 王璠, 黄俊斌, 李国怀, 等. 葡萄座腔菌属引起的果树病害及研究进展[J]. 植物保护, 2013, 39(6): 7-13.
[26] 周如军, 孙建潮, 薛彩云, 等. 花生褐斑病菌和网斑病菌混合侵染对侵染概率和潜育期的影响[J]. 中国农业科学, 2015, 48(21): 4264-4271.
The Tea Brown Blight Disease Caused by Co-infection off.sp.and
ZHANG Yongle1, LIU Huixiang1*, XU Yongyu1, HE Bangling1*, ZHENG Jinzhu2
1. Shangdong Agricultural University/Shandong Research Center for Forestry Harmful Biological Control Engineering and Technology, Taian 27018, China; 2. Forestry Station of Culai Mountain, Tai′an 271027, China
s:A new leaf disease of tea plant was found in Donggang district of Rizhao, Shandong Province. The infected parts wereshrunken and malformed,turned brown, necrotic and named brown blight of tea. Two microorganisms were isolated from the edge of infected parts through tissue separation, and named as RC4and RC3.Their separation rates were 67.1% and 32.9% respectively. According to morphology, culture characteristics, multi- sequence analysis and Koch's Postulates test,f.spandwere found to be the cause of disease. This was the first report thatdamaged the leaves of tea plant.
tea plant,,., co-infection, identify
S435.711
A
1000-369X(2018)01-087-07
2017-09-03
2017-10-20
山东省茶产业技术体系(SDAIT-19-04)
张永乐,女,硕士,主要从事茶树病害病原鉴定及绿色防控技术研究。*通讯作者:hxliu722@126.com,hebangling@126.com

