茶树CsPAL3基因cDNA全长克隆及其表达分析
唐秀华,周喆,唐琴,陈佳佳,谢凤,洪瑶新,黄诗林,陈志丹,3,4*,孙威江1,,3,4*
茶树3基因cDNA全长克隆及其表达分析
唐秀华1,3,4,周喆1,3,4,唐琴1,3,4,陈佳佳1,3,4,谢凤1,3,4,洪瑶新1,3,4,黄诗林2,陈志丹2,3,4*,孙威江1,2,3,4*
1. 福建农林大学园艺学院,福建 福州 350002;2. 福建农林大学安溪茶学院,福建 泉州 362400;3. 福建省茶产业工程技术研究中心,福建 福州 350002;4. 福建茶产业技术开发基地,福建 福州 350002
苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)由多基因家族编码,是花青素等多酚物质合成途径的起始酶,对其合成具有调控作用。本研究以紫化茶树武夷奇种C18茶树为材料,采用RACE技术克隆获得基因cDNA,命名为3(登录号为KY865305),分析其生物信息学特征,并检测不同叶色茶树品种(系)中的花青素总量及茶树PAL家族成员基因的表达情况。结果表明,获得3基因全长cDNA为2 518 bp,包含一个完整的2 130 bp开放阅读框(Open Reading Frame,ORF),编码709个氨基酸。序列分析表明,该基因编码的蛋白质为稳定亲水性蛋白,预测分子量为77.40 kD,理论等电点为6.26;Blast分析序列发现3与芒果的相似性最高,为87%。而在同源进化树分析中与芍药的亲缘关系较近。紫化茶树的花青素总量和a、c、3(e)基因表达量均高于常规绿叶茶树和白化茶树。这表明茶树a、c、3(e)基因上调表达可能促进茶树花青素合成积累,使得茶树叶片呈现紫色。
茶树;3基因;克隆;相对表达量;花青素
花青素()属于水溶性色素,不稳定,需要与糖苷配基组成花青苷,以糖苷的形式存在于液泡中。花青素合成途径,第1阶段以苯丙氨酸为底物,由、和4上游结构基因共同催化完成;第2阶段以香豆酰CoA为底物,由、、中游结构基因共同催化完成;第3阶段以二氢黄酮醇为底物,由、()和下游结构基因共同催化完成[1]。其中是花青素合成的起始酶,也是限速酶,即代谢过程中催化反应速度最慢的酶,亦可改变代谢方向。基因是由多基因家族编码,合成中间产物4-香豆酰辅酶A,参与植物形成次级代谢产物,如花青素、儿茶素、木质素等多种类黄酮化合物。
近年来,对植物基因的研究从酶提取、测定活性过渡到抗逆性、基因克隆和表达量分析等方面。目前,多种植物中的基因已被鉴定并进行更深入的研究。2011年以来,相继从水稻[2]、甘蔗[3]、美洲南瓜[4-5]、鸭梨[6]、小麦[7]、李子[8]等经济作物中克隆基因cDNA全长并进行生物信息学分析。在茶树()上,从生理生化、分子生物学等不同水平上对武夷奇种紫化茶树进行相关研究[9-11],表明紫红色的嫩梢中花青素总量显著高于绿色的成熟叶,且基因表达量显著高于成熟绿叶,但茶树基因cDNA全长克隆及其序列分析还未见报道。
芽叶紫化茶树作为一种优异茶树种质资源而广为人知,在生产实际中也因独特的功能性和品质特征而有较大的应用价值。茶树基因与芽叶紫化性状调控显著相关,发掘和鉴定茶树基因对研究茶树芽叶色泽形成和高花青素含量的调控机制具有重要意义。本研究首次克隆了茶树L3基因的全长序列,对L3基因的基本生物信息学特征进行分析,并探究花青素总量和茶树PAL家族成员基因在不同叶色茶树叶片中的表达规律,为进一步研究L3基因调控高花青素的芽叶紫化茶树的分子机制奠定理论基础。
1 材料与方法
1.1 试验材料
试验材料取自武夷星茶业有限公司种质资源圃,于2016年秋季采摘紫化茶树武夷奇种C18的第1叶位叶片,按照五点采样法混合均匀后迅速用液氮冷冻,置–80℃冰箱保存,用于基因克隆。于2017年夏季采摘常规绿叶茶树朝阳、水仙和武夷奇种83,紫化茶树武夷奇种和武夷奇种73,白化茶树白鸡冠和御金香,共7份,取各茶树品种(系)生长发育良好、形状大小一致的第2叶位叶片,每个品种(系)设置3个生物学重复,样品用液氮速冻,用于实时荧光定量PCR检测,如图1。
1.2 茶树总RNA的提取及cDNA的合成
参考OMEGA植物总RNA提取试剂盒的说明书提取上述各茶树品种(系)样品的总RNA,采用RNase-Free DNase I Set试剂盒(OMEGA)消除基因组DNA,采用超微量分光光度计(赛默飞,NanoDrop 2000c)测定各RNA浓度,采用1%的琼脂糖凝胶电泳检测各RNA的完整性,于–80℃冰箱保存备用。采用Promega GoScript反转录试剂盒合成cDNA。
1.3 茶树CsPAL3基因的全长cDNA克隆及验证
参照SMARTer®RACE 5′/3′Kit(Clontech)试剂盒说明书的方法分别合成5′/3′RACE-Ready cDNA。参考GenBank上已登录的茶树、葡萄、荷花、胡萝卜、枣等基因的保守序列,使用DNAMAN设计引物(表1)。根据试剂盒说明书进行加样和5′/3′RACE的巢式PCR扩增,切胶回收,连接至载体pMD19-T(TaKaRa),转化大肠杆菌感受态细胞JM109(TaKaRa),37℃培养过夜。通过蓝白斑筛选与菌落PCR鉴定,挑取阳性单菌落,送至华大基因测序。
根据上述3段序列进行拼接,在其编码区的两端设计引物-F和-R,用高保真酶Prime STAR® GXL DNA Polymerase进行PCR扩增编码区片段,反应条件为:98℃预变性4 min;98℃、10 s,56℃、15 s,68℃、135 s,共30循环;最后68℃延伸10 min。切胶回收,连接至载体pEASY-Blunt Zero(全式金生物),转化大肠杆菌DH5α (TaKaRa),于37℃过夜培养,鉴定阳性克隆,送至华大基因测序,验证3的cDNA全长序列。
1.4 茶树CsPAL3基因的生物学信息分析
通过ProtParam软件预测茶树3蛋白的一级结构,GOR IV软件预测其二级结构,SWISSMODEL软件预测其三级结构;通过TMHMM和TMPred软件进行蛋白质跨膜结构的预测;通过SignalP 4.1 Server软件预测茶树3基因编码氨基酸的信号肽;通过FoldIndex软件预测该蛋白无序化程度;通过NetPhos 3.1 Server对3进行磷酸化位点进行预测;通过ProtScale进行预测其疏水性/亲水性;通过PSORT II Prediction软件预测茶树3基因的亚细胞定位;运用MEGA6.0软件中的近邻相接法(Neighbor-Joining, NJ)(1000 BootStrap)构建3基因同源进化树。

注:1:朝阳,2:水仙,3:武夷奇种83,4:武夷奇种C18,5:武夷奇种73,6:白鸡冠,7:御金香。
1.5 不同叶色的茶树品种(系)花青素总量的检测
参照文献[9]方法提取不同叶色的茶树品种(系)花青素总量。在紫外分光光度计下分别检测530 nm和657 nm处的吸光度值,根据公式计算茶树花青素总量(干物重),OD/g=(OD530-0.25×OD657)/M。
1.6 茶树PAL基因家族成员的表达分析
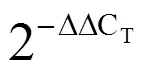
表1 引物序列
2 结果与分析
2.1 茶树CsPAL3基因的全长cDNA克隆
采用SMART RACE技术,扩增得到1 580 bp的中间产物、1 696 bp的5′RACE产物和1 388 bp的3′RACE产物。通过拼接得到2 518 bp的茶树3基因的全长cDNA序列。经过高保真酶扩增,克隆测序,得到大小为2 130 bp的ORF片段,编码709个氨基酸,见图2和图3。
2.2 茶树CsPAL3基因的生物学信息分析
该蛋白含有保守功能结构域PLNO2457,属于PLNO2457超级家族。通过ProtParam在线软件预测其理化性质,结果显示,该蛋白质的相对分子量为77.40 kD,等电点6.26,说明该蛋白为酸性蛋白质。709个氨基酸中,Leu(11.0%),Ala(8.6%),Gly(8.2%),Glu(7.9%)的频率较高。带负电荷的氨基酸数(Asp+Glu)为80个,正电荷的氨基酸数(Arg+Lys)为73个。消光系数(M-1cm-1 γ=280 nm)为48 360,其不稳定系数仅为35.34,故属于稳定类蛋白。其半衰期在体外哺乳动物网织红细胞内为30 h,在酵母细胞内大于20 h,在大肠杆菌内大于10 h。由GOR IV软件预测结果可知,茶树3蛋白二级结构主要由无规则卷曲、α-螺旋和延伸链3种常见结构组成。其中无规则卷曲占45.13%的比例,α-螺旋占44.43%的比例,延伸链占10.44%的比例,预测结果显示该蛋白缺失β-螺旋结构。通过SWISSMODEL软件预测3蛋白的三级结构,该模型与欧芹()的蛋白匹配度最高,为83.83%。
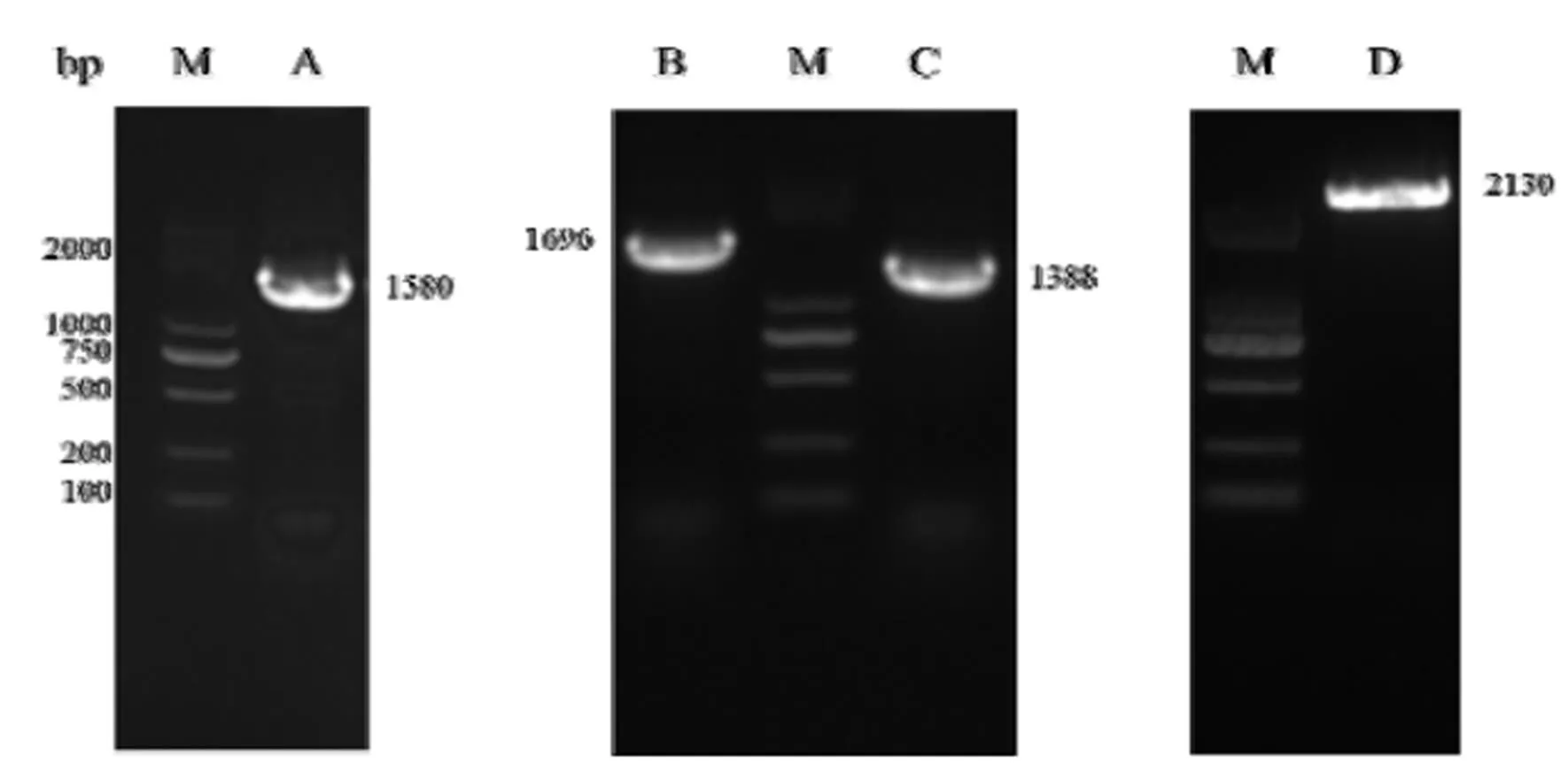
注:M:DL2000,A:中间产物的菌落PCR,B:5′RACE产物的菌落PCR,C:3′RACE产物的菌落PCR,D:ORF扩增。

注:下划线为起始密码子ATG和终止密码子TAG,阴影部分为PAL酶特征序列。
用在线软件TMHMM Server v.2.0和TMpred预测3蛋白的跨膜螺旋区,该蛋白在膜外,不是膜蛋白,无跨膜螺旋区。用SignalP 4.1软件预测,表明蛋白无信号肽,不是分泌蛋白。对3的ORF区域编码的蛋白进行FoldIndex预测,结果显示,仅有7.89%的氨基酸(56个位点)组成的结构为无序结构,说明3不是无序蛋白。在NetPhos 3.1 Server中对3进行磷酸化位点预测,如图4显示,该序列含有58个磷酸化位点,其中18个Thr(苏氨酸)位点,34个Ser(丝氨酸)和6个Tyr(酪氨酸)位点。磷酸化位点约占全序列的8.2%,主要能够被蛋白激酶C(PKC),蛋白激酶A(PKA),cdc2蛋白(cdc2)和酪蛋白激酶Ⅱ(CKII)等蛋白激酶磷酸化。通过ProtScale软件预测分析,根据“正值为疏水性,负值为亲水性,负值越大说明亲水性越高”的原理,由图5可知,3氨基酸残基在整个区域中所表现的亲水性要大于疏水性,而且大部分分值都处于较为低的位置,故3蛋白是偏向亲水性的,为亲水性蛋白。通过PSORT II Prediction在线软件对3基因的亚细胞定位进行预测分析,结果显示,其亚细胞定位主要分布在细胞质中。
2.3 茶树CsPAL3蛋白的系统进化树分析
通过3的氨基酸同源序列比对,发现与最新登录的e(登录号为KY615672)相似性为99%,与芒果(,登录号为KF956009)的相似性为87%,与早年登录的1(登录号为D26596)和2(登录号为AY694188)相似性为80%。将茶树3与已报道的茶树及其他植物的蛋白序列,构建PAL氨基酸的系统进化树(图6)。结果显示,这些植物PAL可以分为A、B两大类,其中两条茶树都聚类在A类中,且与芍药()的关系较近。
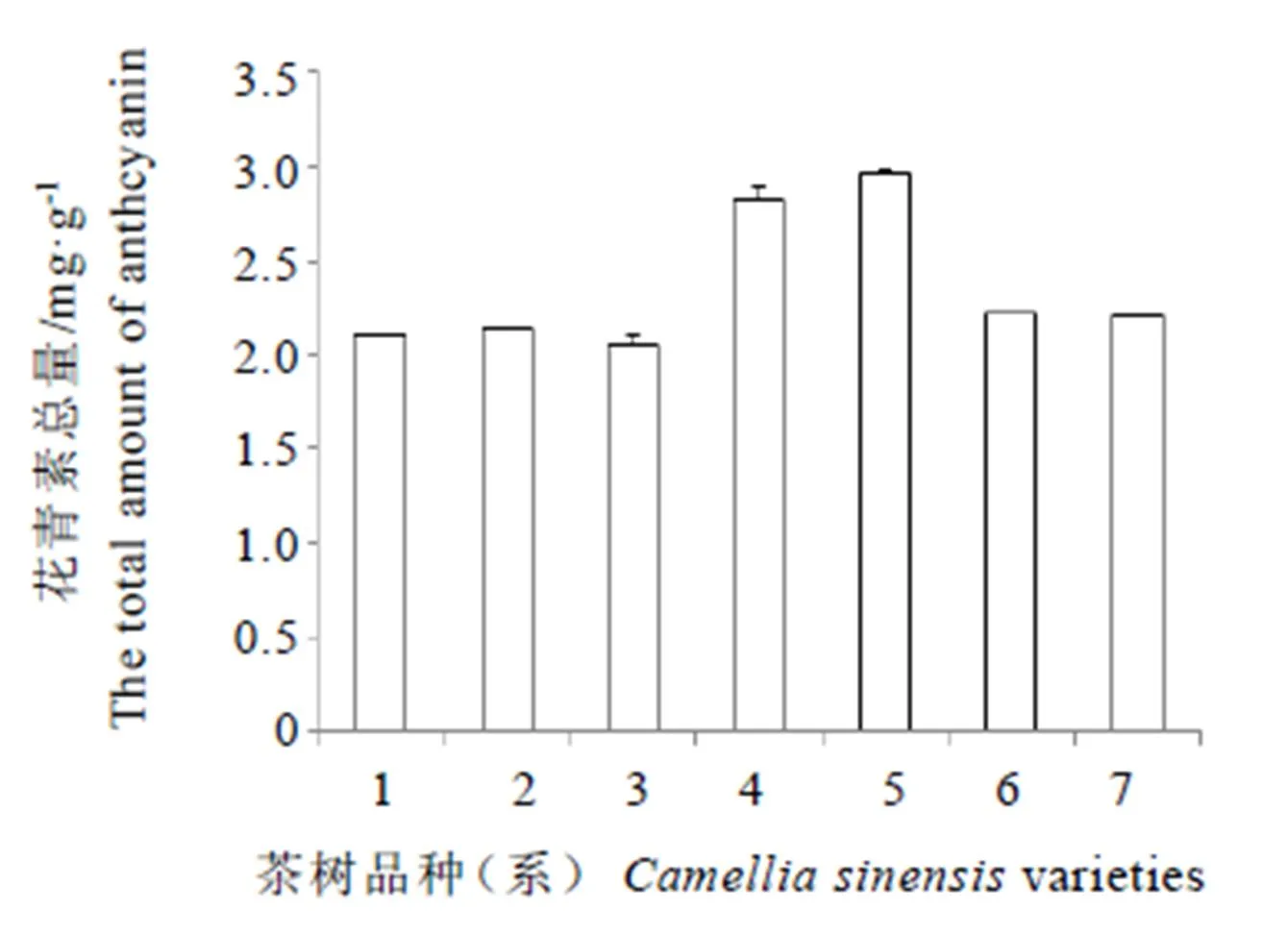
2.4 不同叶色的茶树品种(系)花青素总量分析
图7表明,紫化茶树第2叶位叶片的花青素总量均显著高于常规绿叶茶树和白化茶树。可见,高花青素是茶树呈紫化现象的主要原因。
2.5 茶树PAL基因家族成员的表达分析
采用实时荧光定量PCR技术,分析茶树基因家族成员在不同叶色茶树品种(系)的表达差异。图8显示,朝阳和武夷奇种73中的b基因表达量均明显高于其他品种;水仙中的d基因表达量最高;朝阳中的f基因表达量最高。紫化茶树(武夷奇种18)a、c、3(e)基因表达量均显著高于常规绿叶茶树和白化茶树,且叶片越紫,相对表达量越高。可推测a、c、3(e)基因上调表达可能促进茶树花青素合成与积累。
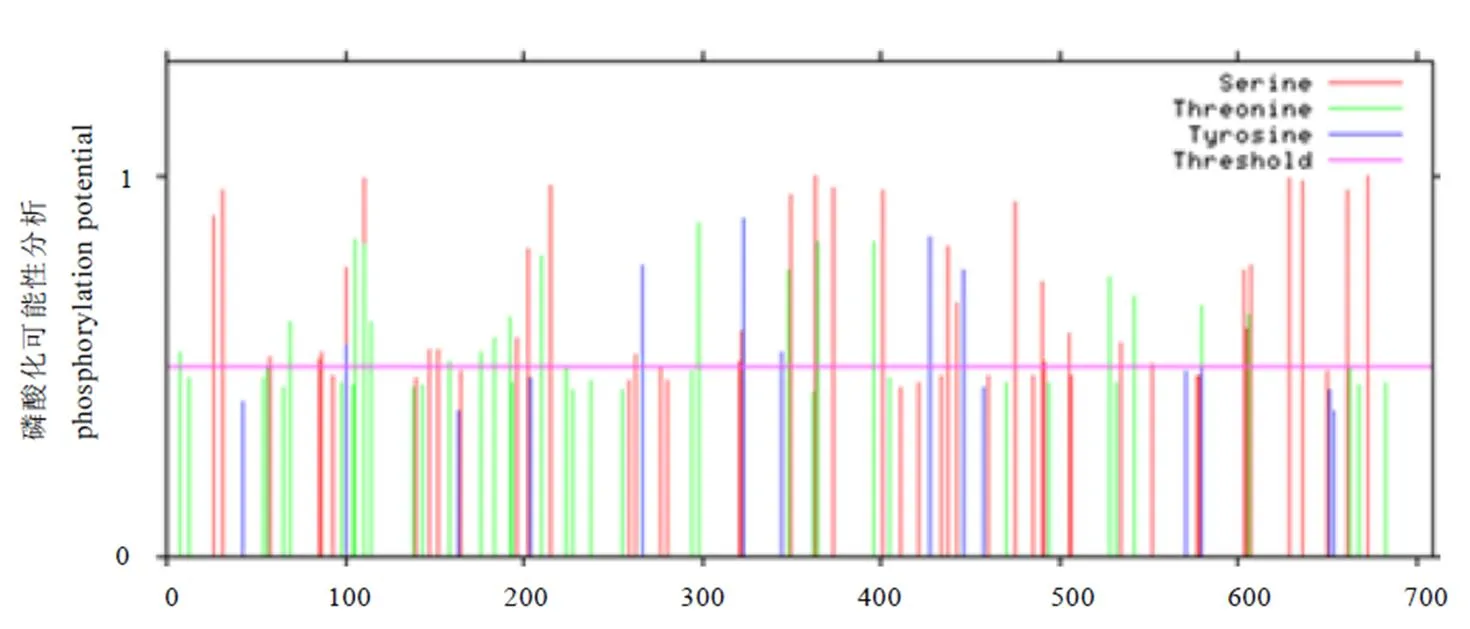
图4 CsPAL3 磷酸化位点预测
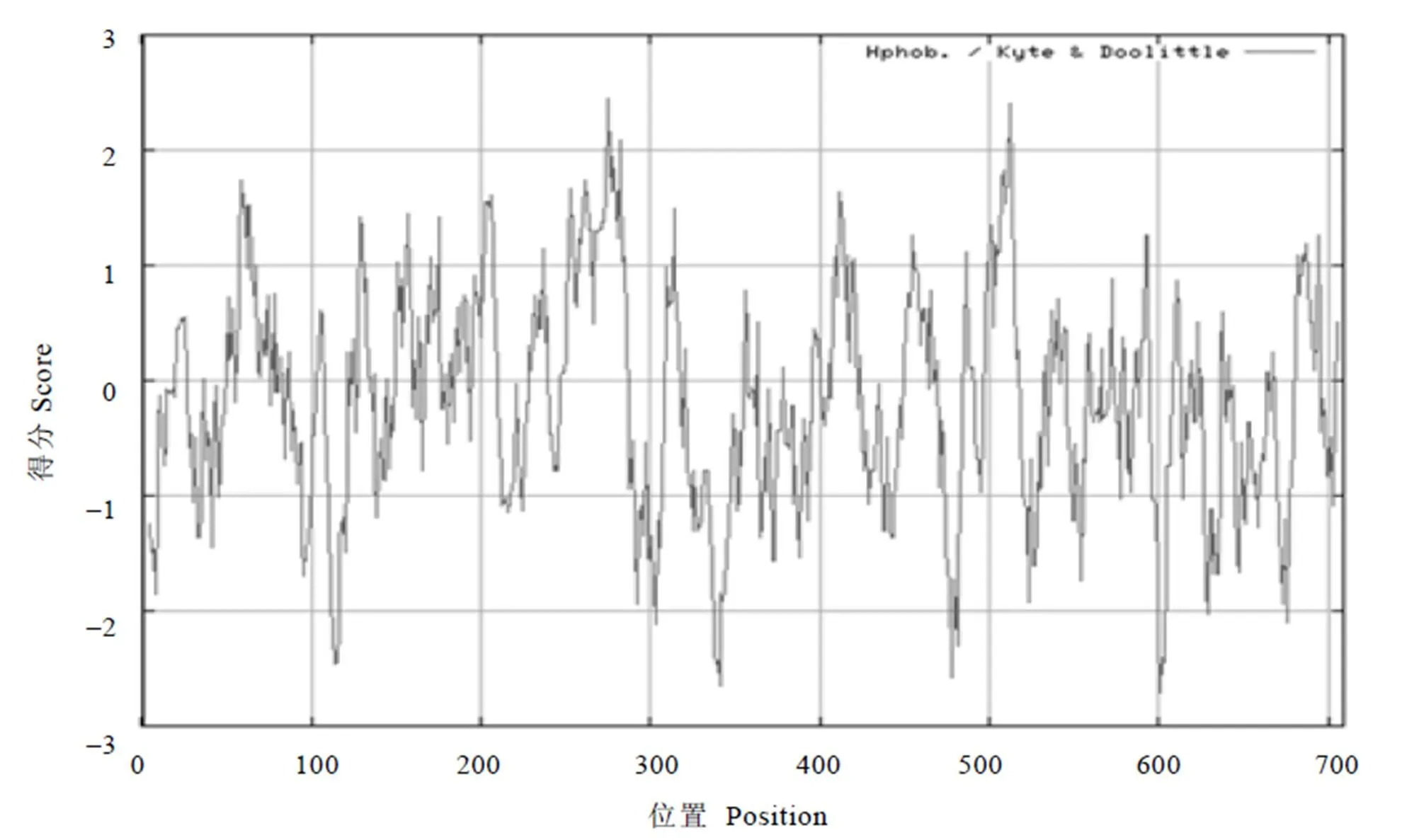
图5 CsPAL3 氨基酸序列亲/疏水性分析
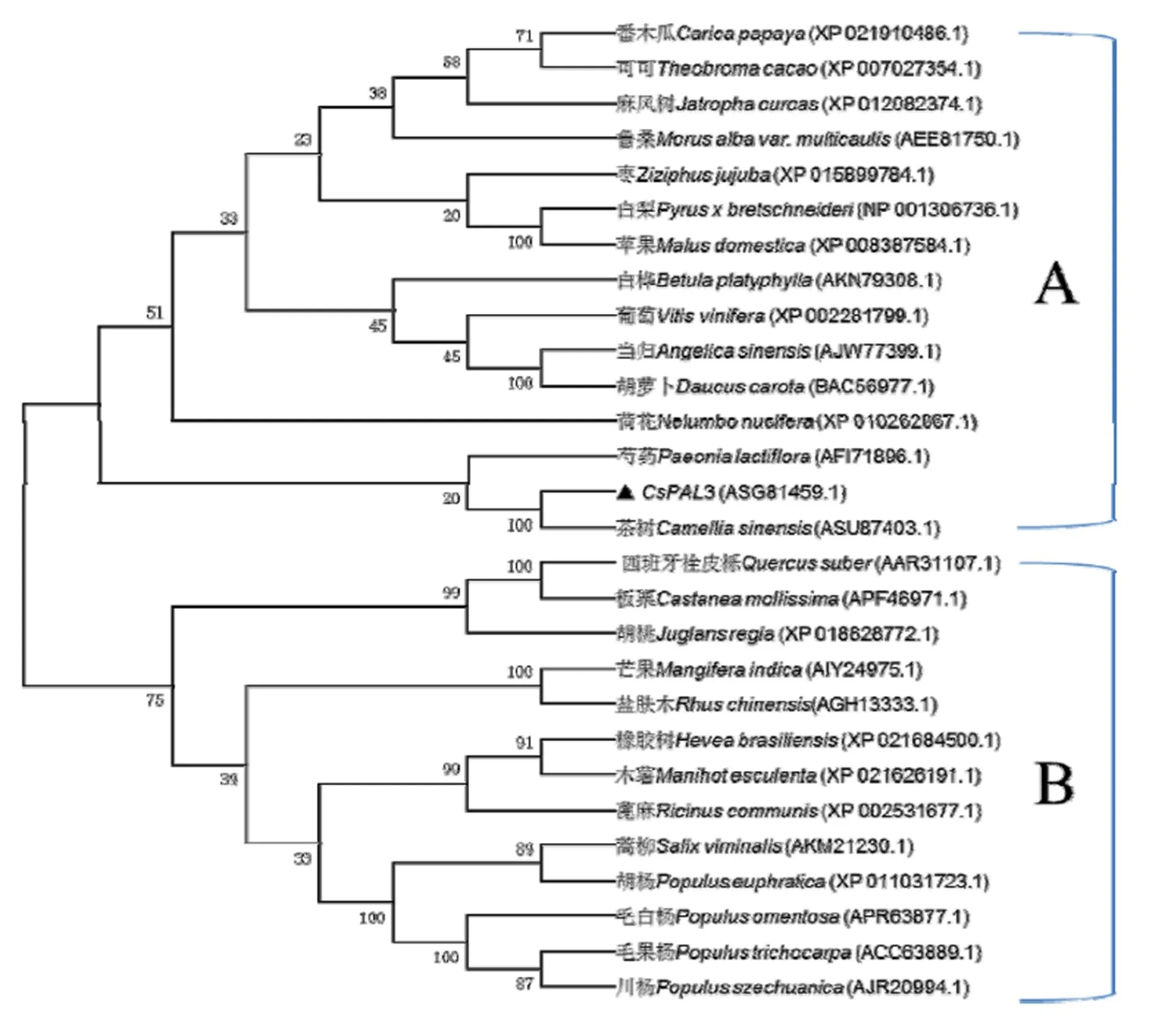
图6 CsPAL3 氨基酸序列进化树分析
注:1:朝阳,2:水仙,3:武夷奇种83, 4:武夷奇种C18,5:武夷奇种73, 6:白鸡冠,7:御金香。下同。
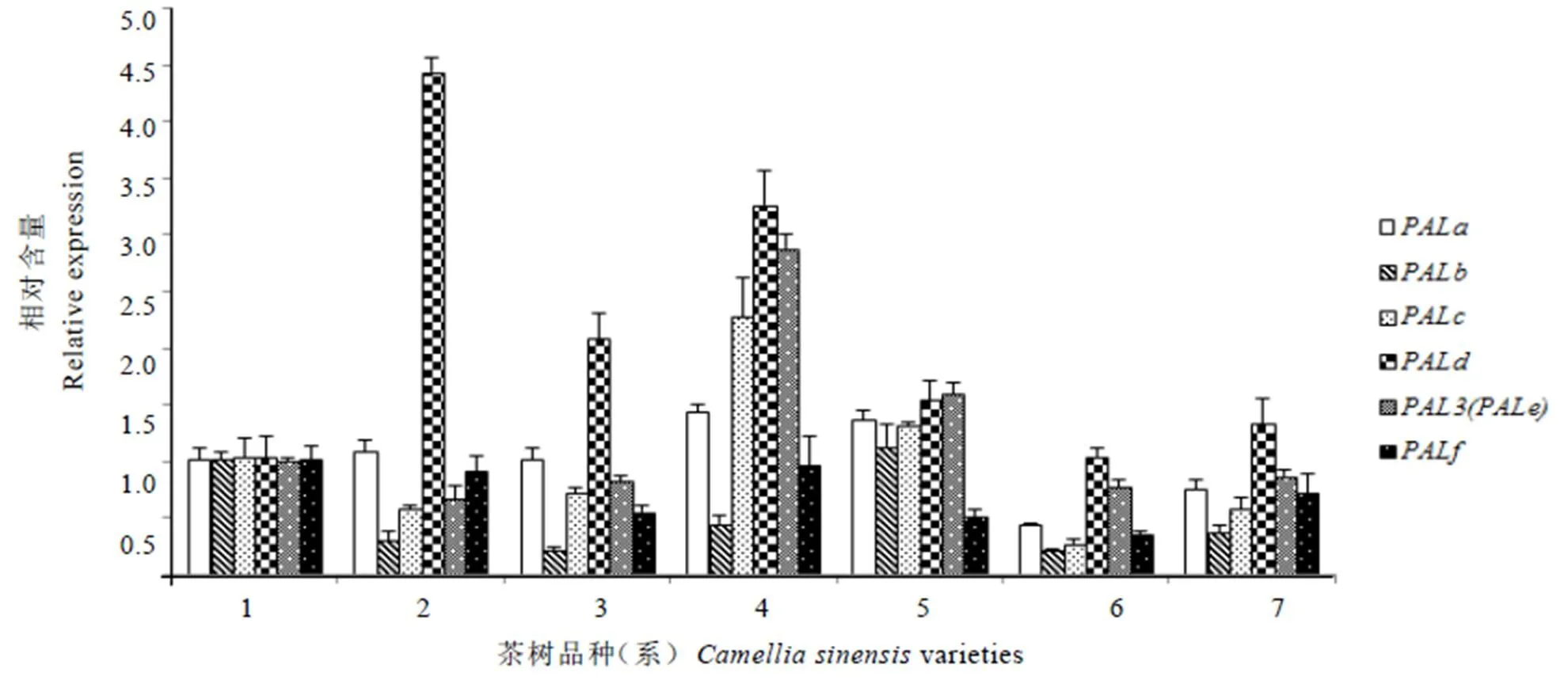
图8 CsPAL 家族成员在不同叶色茶树品种(系)的表达
3 讨论
芽叶紫化茶树作为一种特异的茶树种质资源,叶色呈现紫红色和富含花青素是紫化茶树的特异之处,并且高花青素含量是茶树叶片呈紫红色的主要原因。当、、、、、、、、等结构基因表达量上调时,可促进紫化茶树花青素积累,紫红色变深[1,13-14]。李智[15]研究三年生鸠坑品种茶树在不同光照、温度、氮素处理条件下,其花青素合成结构基因的表达情况、酶活性及花青素含量之间的变化规律。结果显示,强光、适当低温、缺氮诱导等均可正向调控茶树花青素代谢合成关键酶基因的高表达及花青素积累,最有效诱导茶树花青素合成的光质是紫外光。在不同光照处理下,花青素含量与、和的酶活性及相应的基因表达趋势一致;在不同温度处理下,花青素含量与的酶活性及相应的基因表达趋势一致;在缺氮处理下,花青素含量与、、、和的酶活性及相应的基因表达趋势一致,与刘健伟[16]研究结果一致。该研究表明茶树紫化现象受光照、温度和氮素等外界环境因子影响较大,诱导或抑制调控茶树花青素代谢合成,使得茶树呈现不同叶色。
本研究采用RT-PCR和RACE技术,从茶树中成功克隆1个编码酶的3基因,该基因开放阅读框为2 130 bp,编码709个氨基酸,与其他植物的具有较高的相似性,并且含有酶特征序列。该蛋白为亲水酸性蛋白质,无跨膜螺旋区,预测亚细胞定位在细胞质中,这将有助于3结构和功能的进一步研究。花青素总量在紫化茶树品种(系)中含量最高,更充分证明高花青素含量是茶树叶片呈紫红的主要原因。采用qPCR技术,检测茶树家族成员基因在不同叶色茶树品种(系)中的表达规律。结果表明,a、c、3(e)基因表达量在紫化茶树中表达量显著高于常规绿叶茶树和白化茶树,其中富含花青素的武夷奇种C18最高。由此可推测,a、c、3(e)基因表达量与花青素含量呈正相关,可能调控茶树花青素合成,其他家族成员的基因表达情况未发现规律。这与周琼琼等[9]研究基因在幼嫩紫叶中相对表达量显著高于成熟绿叶的结果一致,与周天山等[17]研究紫化茶树各叶位中花青素含量均显著高于对照绿叶茶树,且基因均呈现上调趋势的结果一致。聂庆娟等[18]研究不同叶色的美国红栌叶片,发现红色叶片中,花青素含量高,酶活性高;王海伟等[19]研究不同粒色小麦籽粒,发现有色小麦在不同时期籽粒花青素含量与活性变化趋于一致,且呈显著正相关,表明是有色小麦籽粒花青素合成的关键酶;赵莹等[20]通过低质量浓度T-2处理马铃薯可提高酶活性,增强苯丙烷代谢,进而促进花青素的积累。由此可推测,茶树花青素含量可能与酶活性呈正相关的关系。张泽煌等[21]研究不同颜色果肉杨梅,发现是花青素合成密切相关的关键酶,在红果肉中明显上调表达;Li等[22]研究秋海棠分别在强光和低温处理下,花青素含量均显著上升,但在低温处理2天时,显著上调,之后呈下调趋势,与强光处理的结果一致。
花青素是植物呈色的主要色素,含量高低是茶树叶色不同的主要原因。是花青素合成的上游基因,还参与其他类黄酮物质合成,不同于仅控制花青素合成的下游基因。因此后续应该进一步克隆该基因的全长基因组序列,并获得启动子序列,预测启动子核心元件及调控花青素合成相关顺式元件。借助过表达或基因敲除等分子生物学技术进一步转化验证3的基因功能,以期培育高花青素茶树品种,提高经济效益。
[1] 唐秀华, 孙威江, 唐琴. 紫化茶树生理生化及其花青素调控机理研究进展[J]. 天然产物研究与开发, 2017, 29(6): 1077-1083.
[2] 方长旬, 王清水, 余彦, 等. 不同胁迫条件下化感与非化感水稻多基因家族的差异表达[J]. 生态学报, 2011, 31(16): 4760-4767.
[3] 宋修鹏, 黄杏, 莫凤连, 等. 甘蔗苯丙氨酸解氨酶基因()的克隆和表达分析[J]. 中国农业科学, 2013, 46(14): 2856-2868.
[4] 刘佳. 美洲南瓜苯丙氨酸解氨酶()基因克隆、表达分析及品种抗灰霉病研究[D]. 兰州: 甘肃农业大学, 2013.
[5] 刘佳. 美洲南瓜()种皮苯丙氨酸解氨酶基因克隆与表达分析[J]. 中国农业科学, 2014,47(6): 1216-1226.
[6] 闫洪波, 程玉豆, 何近刚, 等. 鸭梨克隆及其在果实发育和机械伤害过程中的表达[J]. 中国农业科学, 2014, 47(21): 4341-4348.
[7] 虞光辉, 王桂平, 王亮, 等. 小麦基因的克隆及赤霉菌诱导下的表达分析[J]. 植物遗传资源学报, 2015, 16(5): 1055-1061.
[8] Irisarri P, Zhebentyayeva T, Errea P, et al. Differential expression of phenylalanine ammonia lyase () genes implies distinct roles in development of graft incompatibility symptoms in Prunus [J]. Scientia Horticulturae, 2016, 204: 16-24.
[9] 周琼琼, 孙威江. 茶树芽叶紫化的生理生化分析及其关键酶基因表达的研究[J]. 生物技术通报, 2015, (1): 1-7.
[10] Zhou Q Q, Sun W J, Lai Z X. Differential expression of genes in purple-shoot tea tender leaves and mature leaves during leaf growth [J]. Journal of the Science of Food and Agriculture, 2016, 96:1982-1989.
[11] 金琦芳, 陈志丹, 孙威江, 等. 茶树CsANS基因及其启动子的克隆与生物信息学分析[J]. 茶叶科学, 2016, 36(2): 219-228.
[12] 孙美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量PCR分析中内参基因的选择[J]. 植物学报, 2010, 45(5): 579-587.
[13] 金琦芳, 孙威江, 陈志丹. 光照对紫色芽叶茶花青素合成的调控机理[J]. 生物技术通报, 2015, 31(6): 20-27.
[14] 李健. ‘紫娟’茶树紫叶花青素积累机理的转录组分析[D]. 福州: 福建农林大学, 2016.
[15] 李智. 不同环境因子调控茶树紫色芽叶形成的分子机制研究[D]. 泰安: 山东农业大学, 2014.
[16] 刘健伟. 基于组学技术研究氮素对于茶树碳氮代谢及主要品质成分生物合成的影响[D]. 北京: 中国农业科学院, 2016.
[17] 周天山, 王新超, 余有本, 等. 紫芽茶树类黄酮生物合成关键酶基因表达与总儿茶素、花青素含量相关性分析[J]. 作物学报, 2016, 42(4): 525-531.
[18] 聂庆娟, 史宝胜, 孟朝, 等. 不同叶色红栌叶片中色素含量、酶活性及内含物差异的研究[J]. 植物研究, 2008, 28(5): 599-602.
[19] 王海伟, 王振林, 王平, 等. 灌浆期遮光对不同粒色小麦籽粒花青素积累与相关酶活性的影响[J]. 作物学报, 2011, 37(6): 1093-1100.
[20] 赵莹, 薛华丽, 毕阳, 等. 低质量浓度T-2处理对马铃薯块茎苯丙烷代谢活性的诱导[J]. 食品科学, 2015, 36(6): 232-235.
[21] 张泽煌, 陈义勇, 钟秋珍, 等. 红果肉与白果肉杨梅花青苷和糖代谢途径的差异蛋白研究[J]. 园艺学报, 2013, 40(12): 2391-2400.
[22] Li Y M, Zhang K M, Jin H H, et al. Isolation and expression analysis of four putative structural genes involved in anthocyanin biosynthesis in Begonia semperflorens [J]. Journal of Horticultural Science & Biotechnology, 2015, 90(4): 444-450.
Cloning and Expression Analysis of a Full Length cDNA of3 Gene in Tea Plant ()
TANG Xiuhua1,3,4, ZHOU Zhe1,3,4, TANG Qin1,3,4, CHEN Jiajia1,3,4, XIE Feng1,3,4, HONG Yaoxin1,3,4, HUANG Shilin2, CHEN Zhidan2,3,4*, SUN Weijiang1,2,3,4*
1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2. College of Tea, Fujian Agriculture and Forestry University, Quanzhou 362400, China; 3. Tea Industry Engineering Technology Research Center of Fujian Province, Fuzhou 350002, China; 4. Tea Industry Technology Development Base of Fujian Province, Fuzhou 350002, China
The phenylalanine ammonia-lyase (PAL) belongs to a multi-gene family. PAL is the first enzyme in theflavonoid biosynthetic pathway, which plays a key role in regulating flavonoid biosynthesis. The full length cDNA sequence of one phenylalanine ammonia-lyase () gene was obtained from purple tea cultivar Wuyi Qizhong C18 () by rapid amplification of cDNA ends PCR(RACE-PCR) and named as3 (GenBank accession no. KY865305). The full-length cDNA ofwas 2 518 bp, with an ORF of 2 130 bp, which encodes a protein of 709 amino acids.Bioinformatics analysis showed it is a stable hydrophilic protein, withthe predict molecular and theoretic isoelectric points of 77.40 kD and 6.26. Blast analysis indicated that3 had the highest similarity (87%) with homologue gene in, and had the closest genetic relationship with homologue gene inaccording to phylogenetic tree analysis. The total anthocyanin contents and the expressionofa,c,3 in the purple shoots of tea plants were significantly higher than the green and white tea plants. It suggests that the enhanced expression levels ofa,c,3 genesmight promote the accumulation of anthocyanins, therebylead to the purple color in tea plants.
tea plant,3 gene, cloning, relative expression, anthocyanins
S571.1;Q52
A
1000-369X(2018)01-033-10
2017-10-16
2017-11-09
紫化芽叶茶树种质资源的挖掘保存与创新利用(2015N5008)、福建省科技重大专项专题项目(2015NZ0002-1)、福建省科技重大专项专题(2017NZ0002-1)
唐秀华,女,硕士研究生,主要从事茶树分子生物学研究。*通讯作者:swj8103@126.com; asbulletdan@163.com.

