基于SCoT标记的福建茶树品种(系)遗传多样性分析
林伟东,陈志丹,孙威江1,*,杨如兴
基于SCoT标记的福建茶树品种(系)遗传多样性分析
林伟东1,2,4,陈志丹2,3,4,孙威江1,2,3,4*,杨如兴5
1. 福建农林大学园艺学院,福建 福州 350002;2. 闽台特色作物病虫生态防控协同创新中心,福建 福州 350002;3. 福建农林大学安溪茶学院,福建 福州 350002;4. 福建省茶产业工程技术研究中心,福建 福州 350002;5 福建省农业科学院茶叶研究所,福建 福安 355015.
利用SCoT标记对福建茶树资源进行分析,构建适用于福建茶树资源SCoT-PCR扩增体系。从38条SCoT引物中筛选出的16条多态性引物,构建了55份茶树品种(系)的SCoT标记指纹图谱。对55份材料共扩增出219条条带,多态性条带为216条,平均每条引物扩增出13.8条,多态性比率PPB为93.15%,55份供试材料的遗传相似系数(Genetic similarity, GS)介于0.49~0.85,平均为0.67。SCoT标记分析55份供试材料共两个群体的观测等位基因数Na为1.93,有效等位基因数Ne为1.54,Nei基因多样性为0.32,香农指数Shannon为0.48,遗传分化Gst为0.067,基因流Nm为7.01。在遗传相似系数为0.64处,将55份茶树资源分成2大类。
茶树;SCoT;遗传多样性;亲缘关系
福建省气候温暖,雨量充沛,适合各类茶树生长,素有“茶树品种宝库”之称。福建有国家级、省级茶树良种50余种,为福建茶产业发展提供了宝贵的物质基础,也为育种工作者选育新品种奠定了物质基础。福建种植茶树历史悠久,经过历代茶人的栽培,长期以来茶树之间发生复杂的杂交、自交,形成丰富多样的茶树资源。随着茶树种质资源的日益增加,以及对资源创新利用的日益加深,找到高效、快速的鉴定茶树种质资源的方法十分重要。
DNA分子标记技术作为鉴定作物品种的主要方法之一,在茶树指纹图谱构建、遗传关系鉴定中应用较为成熟。SCoT标记也叫目标密码子多态性标记,是Collard等[1]在2009年开发的一种基于单引物扩增的新型分子标记。依据植物基因中起始密码子(ATG)侧翼序列设计单引物,扩增的序列与性状基因相关或与基因相近。SCoT与ISSR、RAPD标记相似,具有充当上下游的单引物;但又有不同之处,SCoT标记的单引物与方向相反的相邻基因ATG翻译起始位点相结合,扩增获取目的基因或与之相近的DNA片段[2],再根据植物侧翼区域保守性翻译起始位点的位置,假设A、T、G 3个碱基分别标为+1、+2、+3起始密码子碱基,则固定G、A、C、C 4个碱基在+4、+7、+8、+9的位置,这几个碱基的位置是固定不变的,而在-3、-6、-9的位置偏好碱基G[3],其余位置可根据碱基的序列不同呈现丰富的多态性而进行碱基的填充。引物长度一般为18 bp,可以保证标记的重复性,设计引物时应尽量避免二聚体和发夹结构的出现,应保证引物GC含量在50%~70%之间。
目前已在多种植物中对SCoT的扩增体系进行了优化,例如柿子、玫瑰、荔枝、牡丹、大豆、葡萄等[4]。SCoT标记在多种植物中得到应用,并优化了在各植物中扩增时的反应体系;但在茶树上的应用较少,目前只在陕西茶树资源多样性上有研究,而在福建茶树资源中的研究尚未发现。本研究利用SCoT标记对福建55份茶树品种(系)进行分析,旨在建立和优化SCoT-PCR扩增体系并构建55份福建茶树品种(系)的SCoT分子指纹图谱,为茶树种质鉴定工作提供理论参考。
1 材料与方法
1.1 供试材料
实验材料主要为福建省已经认定的茶树品种及部分地方茶树品系,共计55个茶树样品(表1)。采样地点分别为武夷星茶业有限公司品种园(武夷山)与福建省农业科学院茶叶研究所的茶树种质资源圃(福安)。每个样品均随机采摘30个茶树一芽二叶新梢,混合均匀后分成3份,锡箔纸包装后,放入液氮中固样保存,尽快带回实验室后保存于-80℃冰箱中。
1.2 试验方法
1.2.1 茶树基因组DNA提取
茶树基因组DNA提取采用Biospin试剂盒方法提取,按照生物学重复提取DNA,操作方法做适当修改,用1%的琼脂糖凝胶检测茶树DNA质量,利用核酸测定仪检测DNA的纯度与浓度。
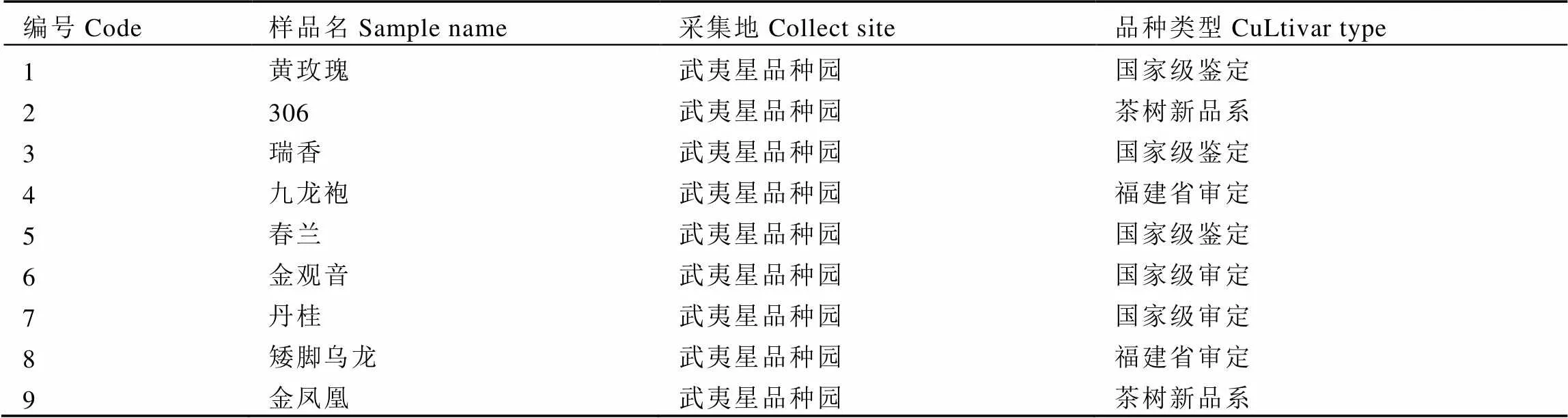
表1 供试材料与来源
续表1

编号Code样品名Sample name采集地Collect site品种类型CuLtivar type 10毛猴武夷星品种园茶树新品系 11白牡丹武夷星品种园茶树新品系 12大红袍武夷星品种园福建省审定 13黄观音武夷星品种园国家级鉴定 14金牡丹武夷星品种园国家级鉴定 15铁观音武夷星品种园国家级审定 16本山武夷星品种园国家级审定 17杏仁茶武夷星品种园福建省审定 18黄旦武夷星品种园国家级审定 19八仙武夷星品种园国家级审定 20梅占武夷星品种园国家级审定 21毛蟹武夷星品种园国家级审定 22肉桂武夷星品种园福建省审定 23水仙武夷星品种园国家级审定 24软枝乌龙武夷星品种园茶树新品系 25大红武夷星品种园茶树新品系 26大叶乌龙武夷星品种园国家级审定 27凤圆春武夷星品种园福建省审定 28福云6号武夷星品种园国家级鉴定 29金玫瑰武夷星品种园茶树新品系 30紫玫瑰武夷星品种园福建省审定 31紫牡丹武夷星品种园国家级鉴定 32福鼎大白茶福安茶科所国家级审定 33福鼎大毫茶福安茶科所国家级审定 34悦茗香武夷星品种园国家级鉴定 35九龙大白茶福建省农业科学院茶叶研究所福建省审定 36早春毫福建省农业科学院茶叶研究所福建省审定 37福安大白茶福建省农业科学院茶叶研究所国家级鉴定 38福云7号福建省农业科学院茶叶研究所国家级鉴定 39黄奇福建省农业科学院茶叶研究所国家级鉴定 40霞浦元宵茶福建省农业科学院茶叶研究所福建省审定 41福云10号福建省农业科学院茶叶研究所国家级鉴定 42朝阳福建省农业科学院茶叶研究所福建省审定 43绿芽佛手福建省农业科学院茶叶研究所福建省审定 44福云20号福建省农业科学院茶叶研究所福建省审定 45政和大白茶福建省农业科学院茶叶研究所国家级审定 46霞浦春波绿福建省农业科学院茶叶研究所国家级鉴定 47红芽佛手福建省农业科学院茶叶研究所国家级鉴定 48白芽奇兰福建省农业科学院茶叶研究所福建省审定 49金锁匙武夷星品种园茶树新品系 50半天妖武夷星品种园茶树新品系 51向天梅武夷星品种园茶树新品系 52老君眉武夷星品种园茶树新品系 53胭脂柳武夷星品种园茶树新品系 54留兰香武夷星品种园茶树新品系 55鬼洞白鸡冠武夷星品种园茶树新品系
1.2.2 引物来源
本试验所用引物均来自植物研究中已公布的SCoT引物,详见表2。
1.2.3 SCoT扩增体系优化与引物筛选
(1)SCoT扩增体系优化。SCoT扩增体系参考陈熙[5]所用体系,稍作优化。设计基础体系为:总体积15 μL,全式金2xEasy Taq PCR Super Mix 7.5 μL,50 ng·μL-1DNA 1 μL,浓度为100 μmol·L-1的引物1 μL,ddH2O补足。在此基础上参照表3进行单因素实验,筛选出最适SCoT-PCR扩增体系。SCoT-PCR扩增程序为94℃预变性180 s;94℃变性60 s,退火60 s,72℃延伸60 s,重复35个循环;72℃再延伸600 s,以此程序筛选出最适的SCoT-PCR扩增体系。
(2)SCoT引物及退火温度筛选。SCoT-PCR引物为通用引物,在植物研究中不同物种可以交叉使用,做进一步筛选,找到适合福建茶树扩增的引物。以7个有代表性样品基因池为模板,以引物合成时显示的为中心,+4℃和–4℃为最高和最低温度,以优化后的体系进行扩增,进行最适退火温度的筛选。
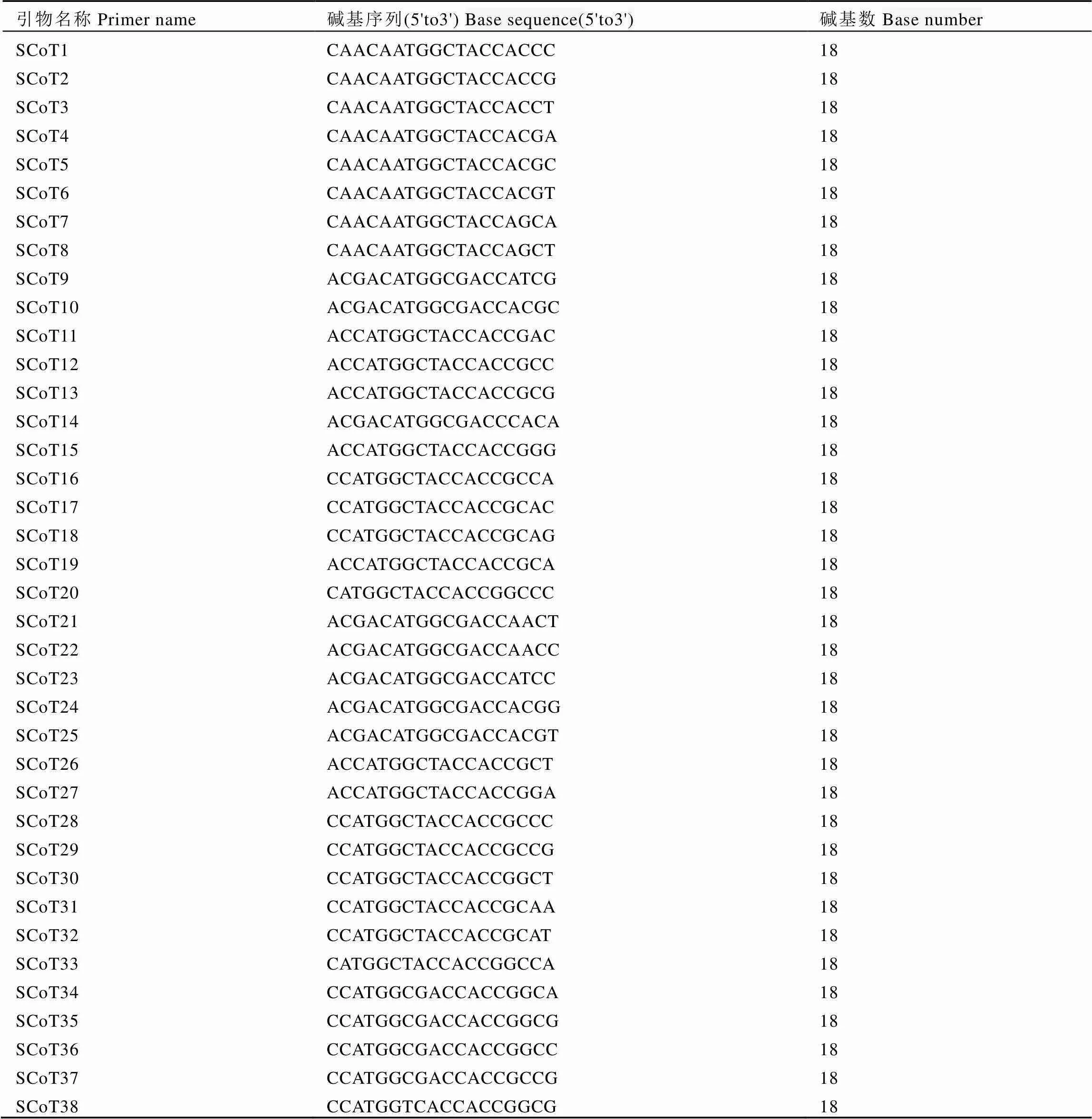
表2 引物名称
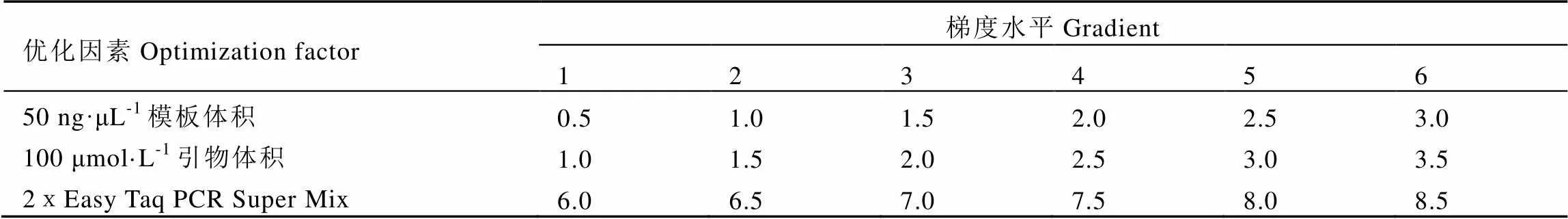
表3 SCoT-PCR反应体系的优化参数
1.2.4 数据统计
(1)根据电泳图谱的条带分布,电泳图中每个条带都是1个位点,是引物与DNA的结合点。将PCR电泳图中的位点与DNA Maker进行对比,显示有条带标为1,而相对位置没有条带的标为0,建立(0,1)矩阵表。
(2)对Excel表中所统计的(0,1)矩阵进行统计,并计算多态性条带百分比(PPB, Percentage of bands)和多态性位点百分率(PPL, Percentage of polymorphic loci)。PPB指所有供试材料的全部扩增位点中多态性位点占总带数的百分数(PPB=多态性位点/扩增总带数);PPL指每个引物扩增结果全部条带中多态性位点占这引物跑出总位点数的百分比(PPL=该引物多态性条带/该引物扩增全部条带)。
(3)利用Popgene 32软件,可计算香农指数(Shannon, Shannon’s information index)、基因多样性指数(Nei’s gene diversity index)、观测等位基因数(Na, Oberved number of alleles)、有效等位基因数(Ne)、Nei遗传一致度和Nei遗传距离等参数。
(4)应用Splittree 4.0软件计算出样品之间的无根进化树,分析样品之间相对进化顺序。
(5)根据Ntsys 2.10e聚类,得到GS遗传相似系数。用于分析两材料间遗传差异大小。依据SHAN程序按照UPGMA法构建样品资源(系)间聚类图。
2 结果与分析
2.1 DNA浓度与质量检测结果
吸取茶树总DNA 3 μL在凝胶中经电泳和凝胶成像拍照,结果显示基因组DNA条带清晰、亮度较好(图1),几乎没有杂质残留在点样孔附近,表明提取的DNA较为完整,纯度较高,可满足后续实验要求。
使用微量核酸测定仪检测DNA浓度和纯度,由表4可看出A260/A280值均在1.79~2.10之间,表明DNA纯度较高,检测DNA浓度值最高达到2 709.6 ng·μL-1,最小值95.3 ng·μL-1,浓度较好,可以满足后续实验。
2.2 扩增体系优化分析
本试验PCR扩增使用了全式金的2xEasyTaq PCR SuperMix,其中包含了Taq酶、dNTPS、Mg2+离子,因此对扩增体系的优化主要对DNA模板、引物和Mix反应液这3个因素进行单因素实验,通过扩增条带的多少与清晰度判断最适用量。图2为DNA的6个加样量梯度筛选实验,图2中条带清晰度相当。对比图中各泳道条带,确定SCoT扩增体系加50 ng·μL-1的DNA模板用量为2.0 μL时扩增效果最佳。
同样以单因素实验法对扩增体系中的Mix用量进行试验,试验为Mix用量的6个梯度实验,分别为15 μL总体积中加入6.0、6.5、7.0、7.5、8.0、8.5 μL 6个梯度。从图3可看出,6个泳道的清晰度相当,综合对比各泳道条带,确定在SCoT-PCR扩增体系中所加2xEasyTaq PCR SuperMix的量为8.5 μL,可以使SCoT-PCR扩增效果达到最佳。
使用单因素法对浓度为100 μmol·L-1引物进行梯度试验,筛选最适引物用量(图4),设置6个梯度,加样量分别为1.0、1.5、2.0、2.5、3.0、3.5 μL。从图4中对比各个泳道的条带数和清晰度,最终选定100 μmol·L-1引物的加样量为2.0 μL时,可以使SCoT-PCR扩增效果达到最优。综合以上对50 ng·μL-1DNA模板用量、2xEasyTaq PCR SuperMix用量和100 μmol·L-1引物用量的梯度实验,最终确定SCoT-PCR扩增体系为:50 ng·μL-1DNA模板用量为2.0 μL、2xEasyTaq PCR SuperMix用量为8.5 μL、100 μmol·L-1引物用量为2.0 μL,由此体系扩增的SCoT-PCR扩增图谱效果最佳。
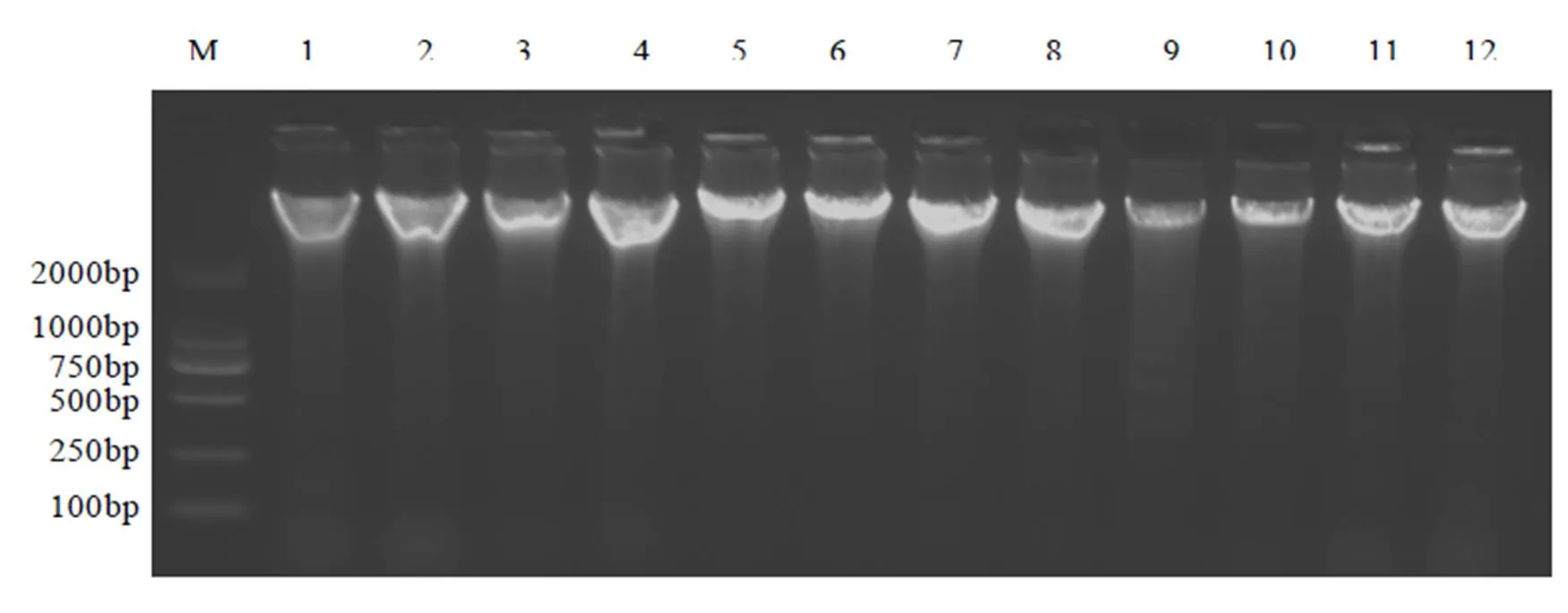
注:M:DL 2000 DNA Marker;1~12为表1前12个样品。
表4 DNA质量检测
注:M: DL 2000 DNA Marker;0.5~3.0 代表所加DNA 的量。
2.3 筛选出的SCoT引物及多态性分析
利用优化的体系对38条引物进行扩增效果筛选(图5)。在选择DNA模板时选择7个有代表性的茶树DNA基因组,组成基因池模板DNA。对比各泳道之间条带,选择清晰度好、条带数多、条带重复出现的引物。最终获得16条扩增条带数多、条带清晰、扩增稳定的引物,详见表5。对16条引物进行最适退火温度筛选,以引物合成时显示的为中心,+4℃和–4℃为最高和最低温度,根据PCR仪自动分布温度梯度进行最适退火温度的筛选。以电泳图谱中有清晰条带,多态性好的泳道对应温度为最适退火温度,最后得到16条引物的最适退火温度,如图6为部分引物S6、S7、S8、S9、S10、S11的退火温度电泳图。综合上述结果,得到16条引物的最适退火温度(表5)。对55个茶树样品进行PCR扩增,得到16份55个茶树样品的扩增图谱。16条引物的扩增情况详见表5。从表中可知,16条引物共扩增出219个位点,其中多态性位点204个,多态性比率PPB为93.15%。其中引物SCoT11扩增位点数最多,达17个位点,多态性条带17条;引物SCoT1扩增位点数最少,为10条,多态性条带9条;16条引物平均扩增条带数为13.69条,平均多态性条带为12.75条,位点平均多态性比率为93.15%。综合16条SCoT引物对55个茶树样品扩增结果可知,供试茶树样品资源的遗传背景较为丰富。
2.4 根据SCoT分析的55份实验样品的多样性分析
对SCoT分析的55个茶树样品的0、1矩阵表进行分析,获取55份茶树样品的遗传相似系数GS。共获得1 485个相似系数数据,相似系数在0.49~0.85,均值为0.67。相似系数最大的两材料为品系306和春兰品种,相似系数为0.85,表明二者亲缘关系较近;相似系数最小的两个样品是老君眉和软枝乌龙。原产地来自安溪的铁观音、黄旦、毛蟹、本山两两之间的相似系数介于0.72~0.81,具有较高的相似性,这与它们都产自相同地理位置息息相关。以黄旦和铁观音为亲本的几个子代之间的相似系数大多集中在0.72~0.76区域,相似系数较高,其主要原因是子代得到了亲本相同或相近的遗传信息,所以表现出较近的亲缘关系。同是引种自武夷山武夷星品种园的7个品系,金锁匙、半天妖、老君眉、胭脂柳、留兰香、鬼洞白鸡冠两两之间的相似系数在0.68~0.78之间,相似系数较高,出现这一现象的很大原因在于它们种植地理位置相同,受到的环境因素、作用因子相近,出现了近似的性状和遗传背景。将1 485个GS以0.036为间距,分成10组,分析GS的频数频率条形、折线图(图7),55个茶树样品遗传相似系数在0.670~0.706区域数量最多;两侧不成对称分布,左侧GS数目明确多于右侧GS数目;大部分趋于0.598~0.742区域,个数为1 157,占77.91%。
注:M:DL 2000 DNA Marker;6.0~8.5代表所加Mix的量。
注:M:DL 2000 DNA Marker;1.0~3.5代表所加引物的量。
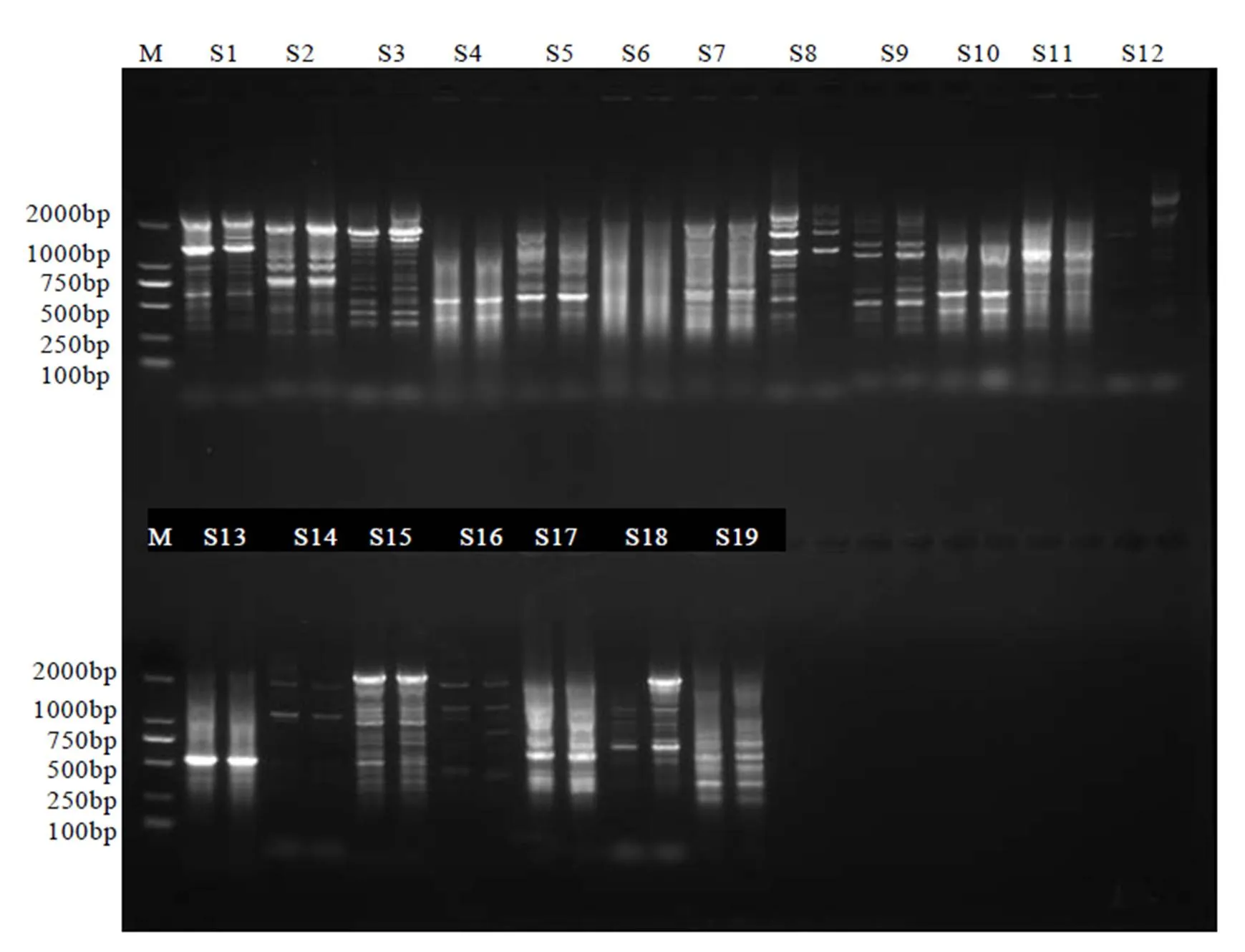
注:M:DL 2000 DNA Marker;S1~S19 代表引物1~19。
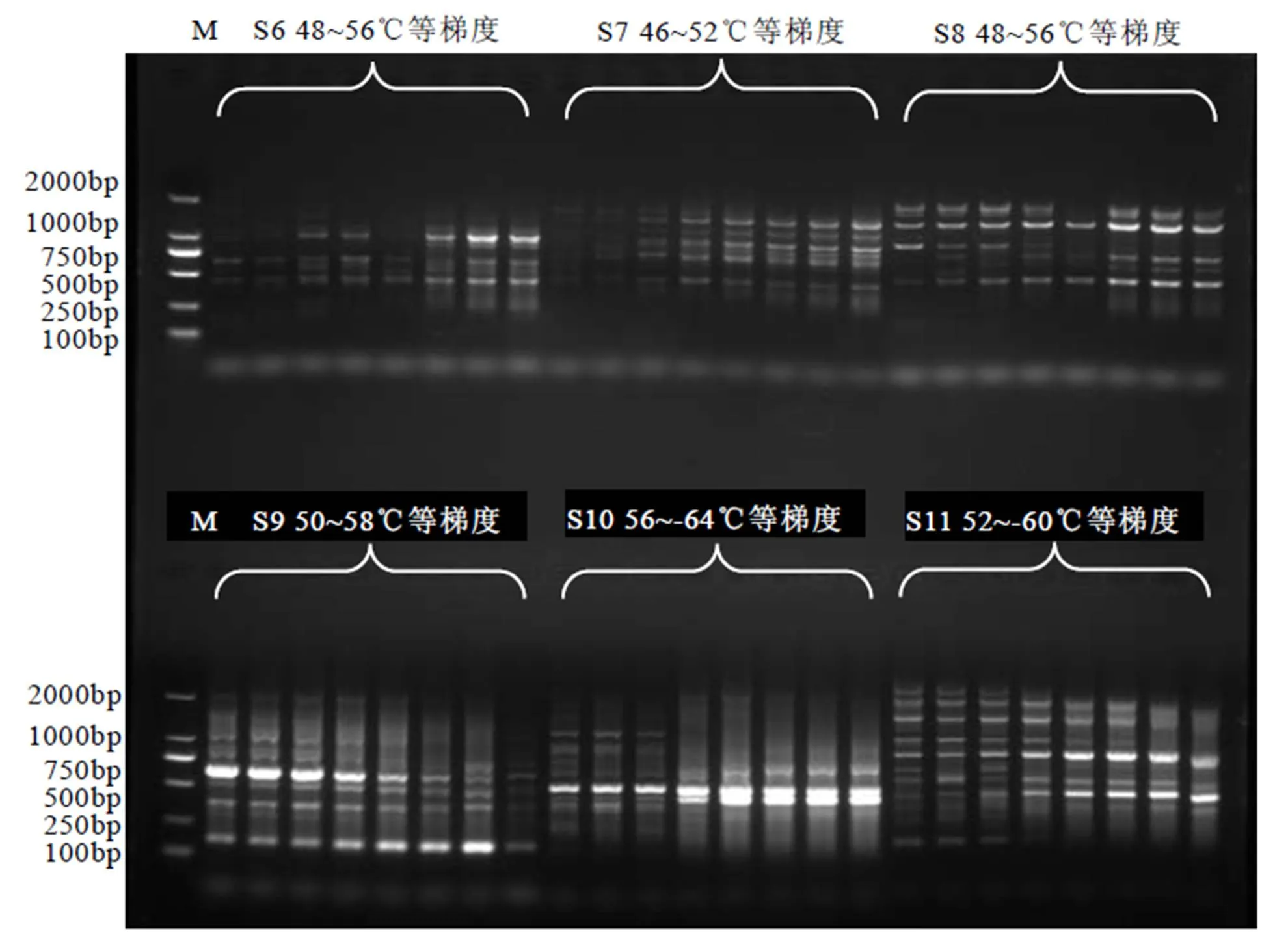
图6 引物S6、S7、S8、S9、S10、S11 退火温度电泳图
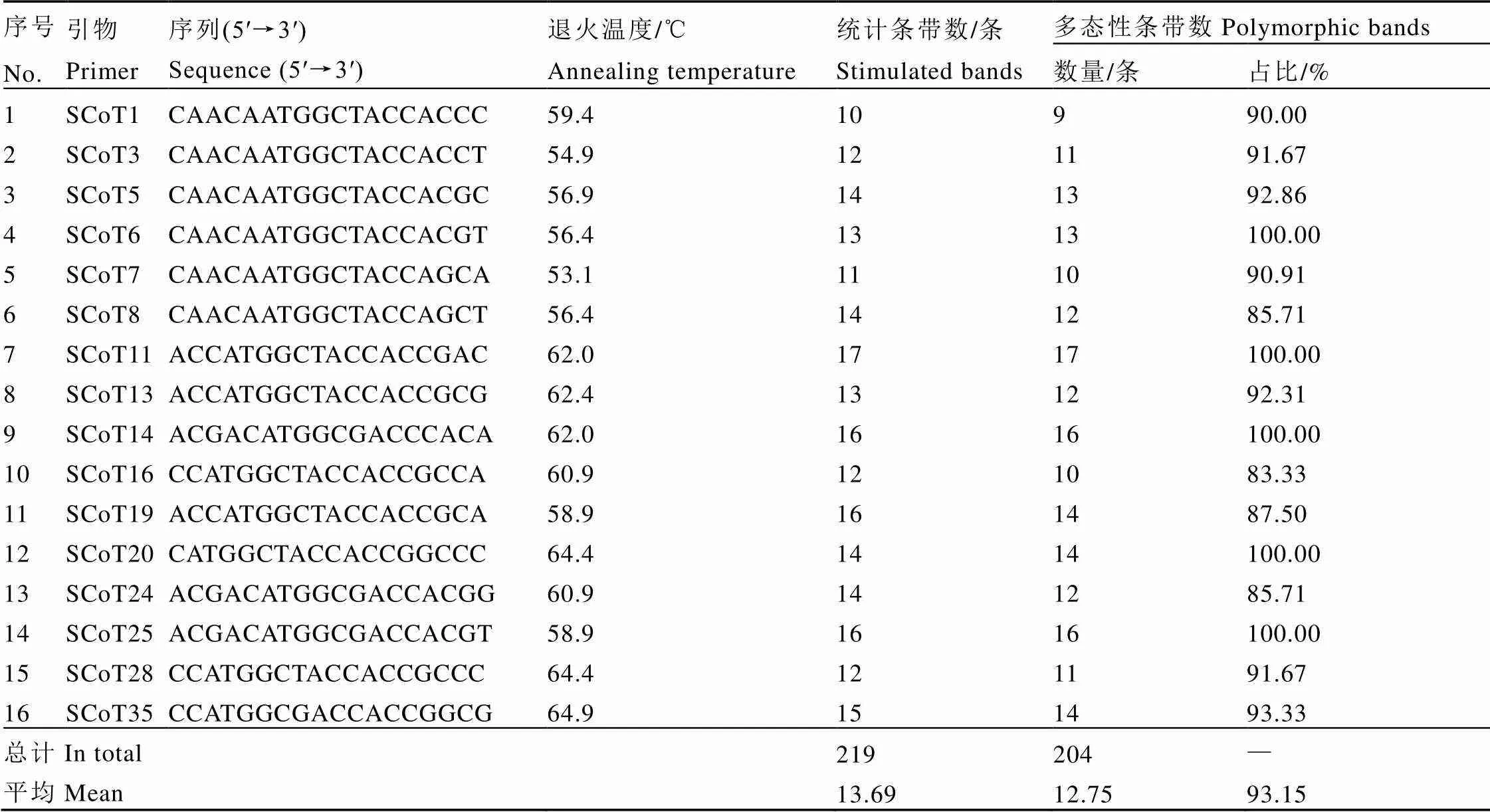
表5 55个茶树品种(系)SCoT引物及其扩增结果
对55个茶树资源的0/1数据转化格式后,应用Popgene 32软件处理。获得观测等位基因数Na为1.93,有效等位基因数Ne为1.54,Nei基因多样性为0.32,香农指数Shannon为0.48。遗传分化Gst为0.067,意味着茶树品种间的遗传变异发生情况较少。两种群间遗传物质的传递变化,主要是通过花粉和种子为途径进行[6]。当Nm>1时,群体间基因交流起到较好的均质作用,较高的基因交流可增加不同种间遗传物质的传递,减小两群体间遗传分化的发生[7];分析得到55个茶树样品间的Nm为7.01,Nm>1,表明种间遗传物质传递较为丰富,这主要由于茶树间种植地相隔较近,加强了各品种间遗传物质的交流。同时,茶树花期大部分在10—11月,此时雨水较少,有利于花粉的传播,增强了花粉在种间的交流。采自武夷山武夷星品种园和福建省农业科学院茶叶研究所品种园两群体间的Nei遗传距离为0.05,Nei遗传一致度为0.95。
2.5 55个样品材料的聚类分析
利用软件Ntsys 2.10e对SCoT标记的55个茶树品种(系)聚类分析,建立55份供试材料之间的聚类树状图(图8)。当相似系数GS在0.64时,55个供试品种(系)可以分成2大类群,两大类群又分成若干亚群,第一大类群包含44个品种(系),第二大类群包含11个品种(系)。第一大类群中聚在了一起,说明这两个品种间相似性较高,具有较近的亲缘关系。第一大类群中包含原产地来自安溪的几个品种(铁观音、黄旦、毛蟹、本山),以及黄旦和铁观音的自交、杂交后代,306品系和春兰品种在相似系数0.85时主要包括黄玫瑰、黄观音、金观音、金牡丹、春兰、306、瑞香等。同是佛手的红芽与绿芽佛手在GS为0.74时被聚在了一起,主要因为在芽性状上表现差异较大。第二大类中只有11个品种(系),分成两个亚类,第一亚类是引自武夷山武夷星品种园的7个品系,它们被聚在一起很大因素来自长期拥有相同的种植环境,变异条件相同,也就有了较近的亲缘关系。而第二大类的第二亚类4个材料是同是取自福建省农业科学院茶叶研究所品种园的材料,拥有数十年的种植历史,受相同环境作用,而表现为较近的关系。
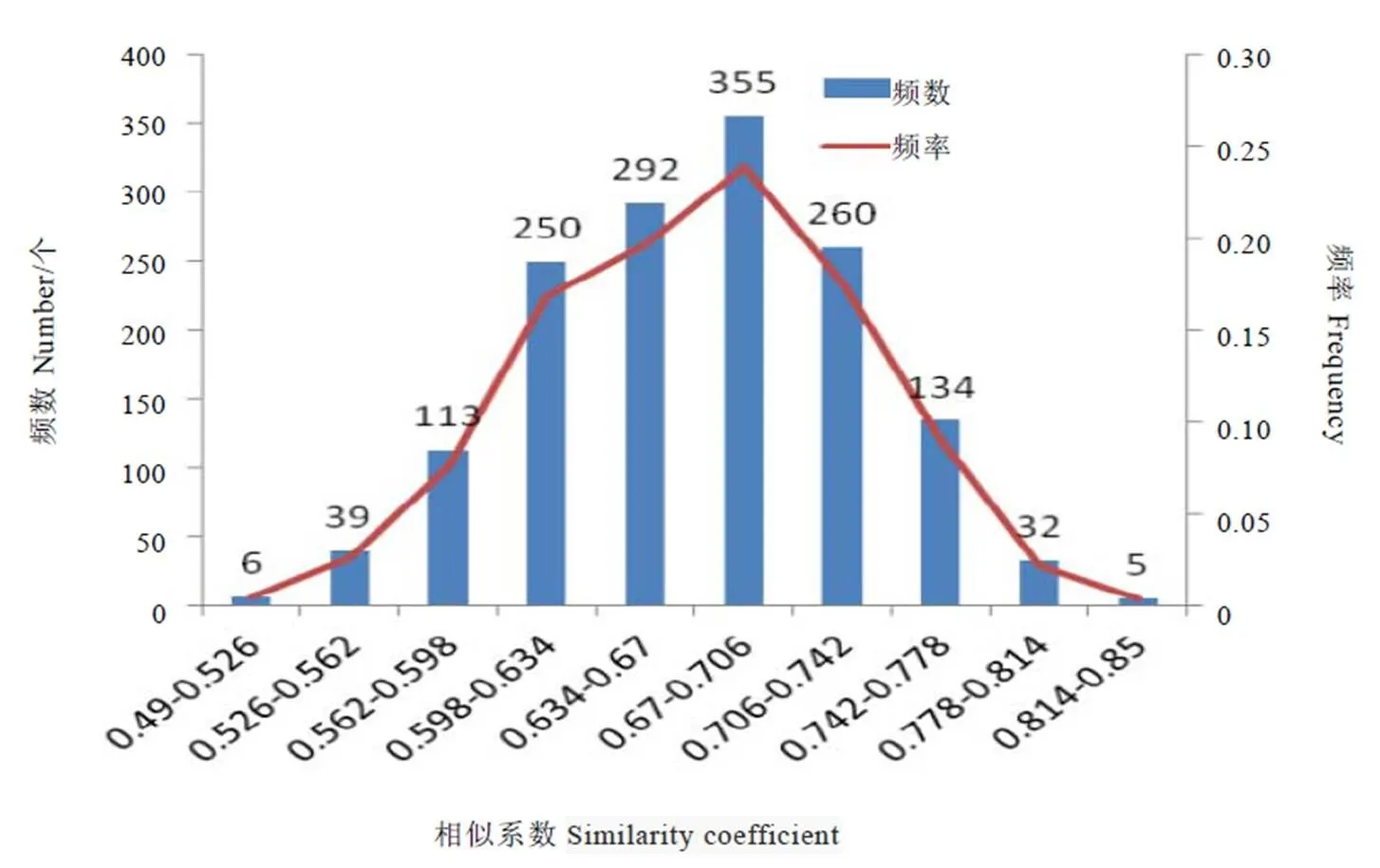
图7 基于SCoT标记的供试材料间遗传相似系数的频数分布直方图
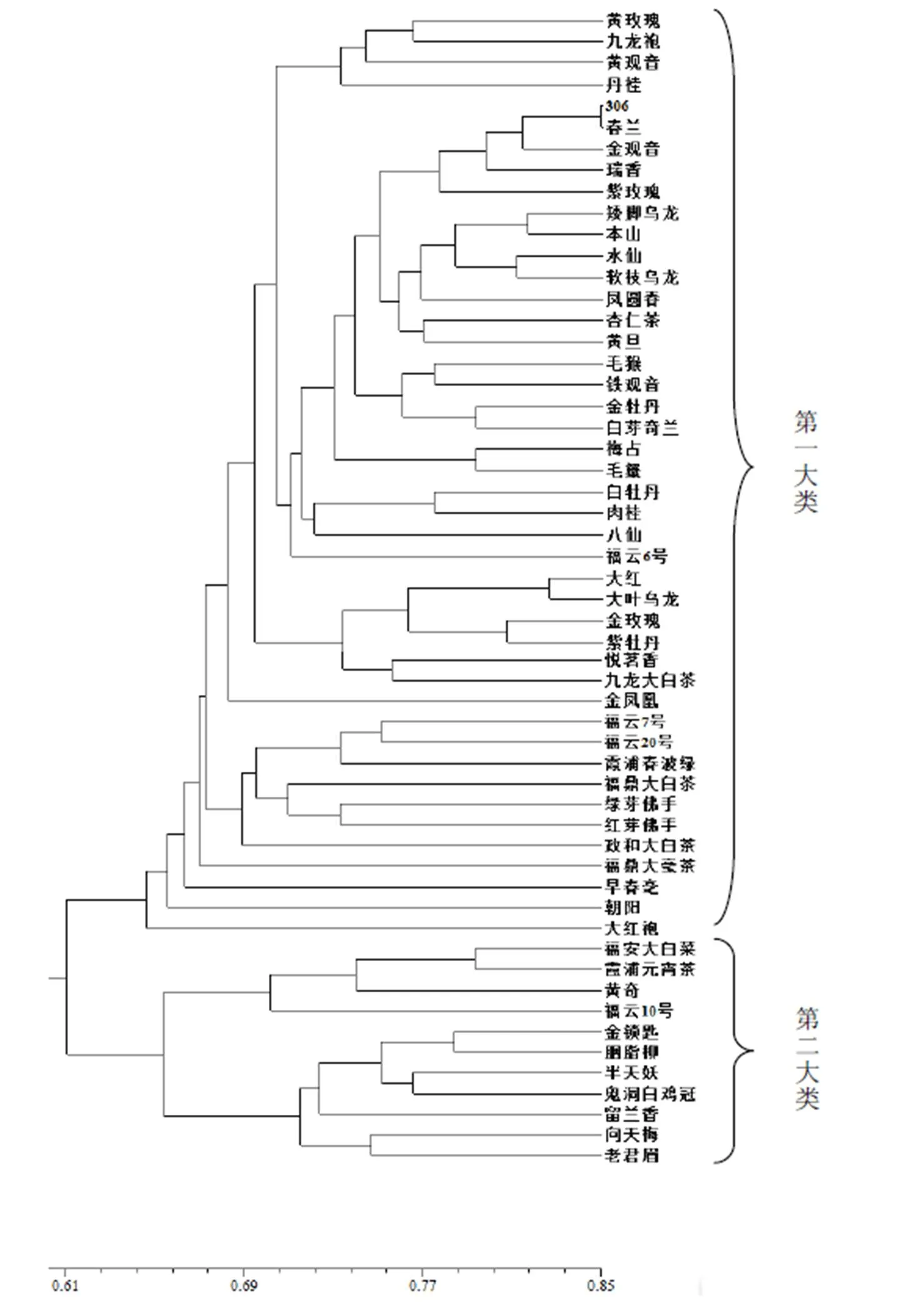
图8 基于SCoT 分子标记的茶树聚类图
2.6 供试品种(系)进化树分析
应用软件Splittree 4.0对SCoT标记的55份供试材料进行无根进化树分析(图9),基于SCoT标记所构建的55份供试材料的无根进化树分成3簇,每大簇中又分成若干小簇。图中绿色区域小簇中留兰香、鬼洞白鸡冠、胭脂柳、老君眉、向天梅、半天妖、金锁匙7个品系被分在了一起,这与聚类图结果相同,具有相同进化方向。福云10号是福安大白茶与云南大叶种杂交后代选育而来,图中福云10号与福安大白茶在同一枝干,进化方向与杂交选育结果相符。蓝色区域福云7号与福云20号具有相同进化方向,都来自相同的亲本。其他在亲本上没有亲缘关系的茶树,例如霞浦春波绿、朝阳、政和大白茶、福鼎大白茶、红芽佛手、凤圆春、早毫春、紫玫瑰、福云6号因为种植在相同环境,长期受相似因素作用,出现了相似变异,从而出现相同进化方向。黄色区域306、春兰、金观音、瑞香及黄观音与黄玫瑰具有相同进化方向,这主要是由它们遗传物质的来源相同,亲本均为黄旦与铁观音。铁观音、本山、黄旦、毛蟹、梅占也表现出相同进化方向,这很大因素在于它们间起源地理位置相同,而且在后期的引种过程保持了原有进化关系。SCoT标记除了检测到以上相同亲本或者相同地理来源而出现的进化方向相同外,也有亲缘关系相近但未被分在同一进化方向的茶树资源,例如绿芽佛手与红芽佛手在进化树分布中与进化方向不符,两材料性状不同,虽受相同环境作用,但发生了不同的变异。
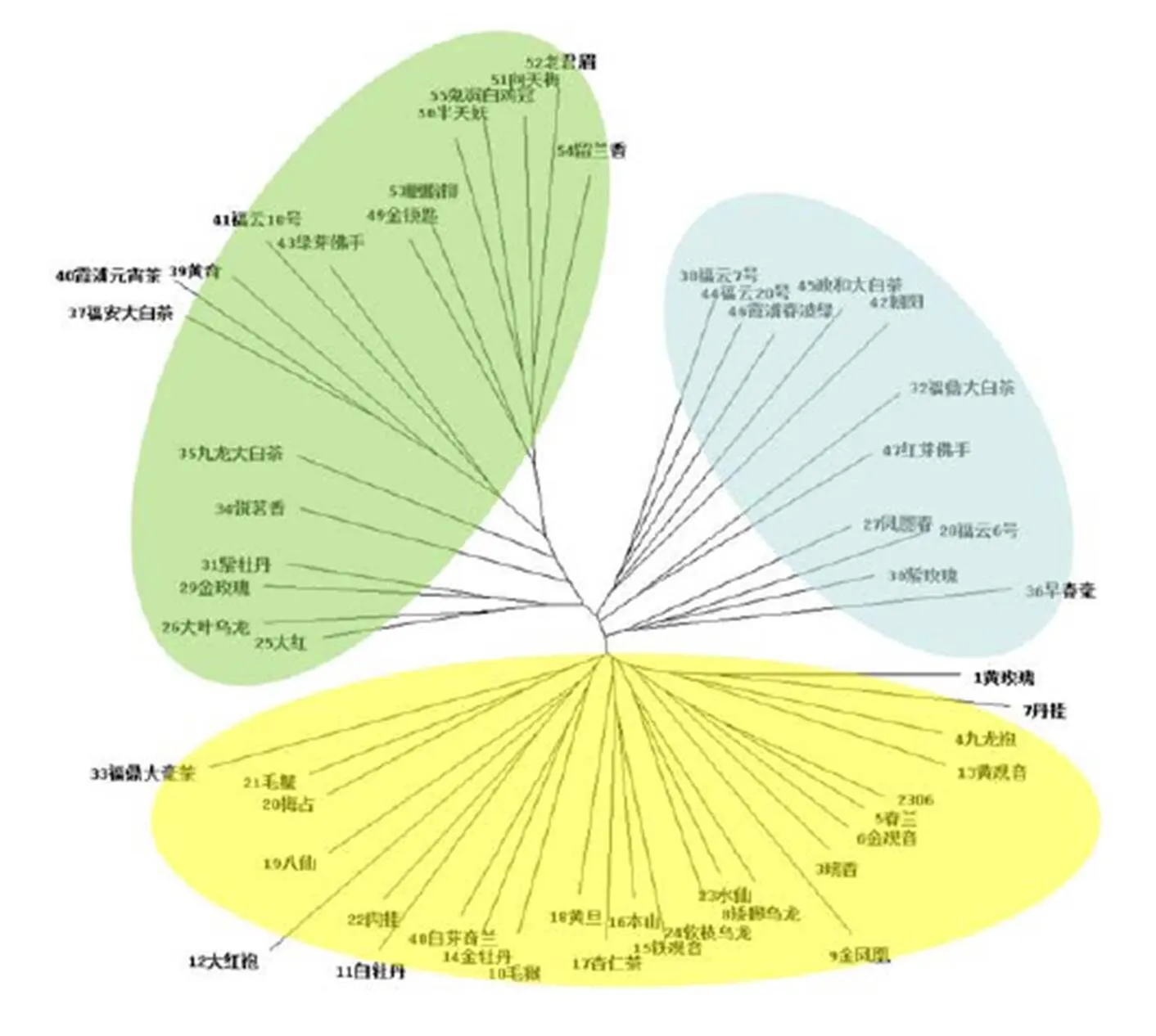
图9 基于SCoT 分子标记的茶树进化树
2.7 SCoT标记构建指纹图谱
根据SCoT扩增图谱条带的有无,采用特殊条带法和不同引物扩增条带相结合的方式,可高效鉴定供试材料。特殊条带法是根据某一位点只存在于某一材料,而在其他材料中未发现此位点为依据,所以特殊条带往往表现出专一性。通过对比扩增图谱,未发现特殊条带,所以构建55份供试材料的指纹图谱只能采用不同引物条带相结合的方式鉴定材料。通过反复对比扩增图谱条带分布情况,最后挑选SCoT1、SCoT3、SCoT5、SCoT6、SCoT7这5条引物扩增谱带中的部分条带,共计15个位点,构建了55份供试材料的DNA分子指纹图谱(图10)。此图谱具有较高的鉴别效果,图谱中的引物SCoT1的5个位点可以鉴别出7个供试材料编号(编号与样品名称同表1),分别为8、20、24、45、50、51、52。引物SCoT3的两个位点结合引物SCoT1的5个位点可以鉴别出12个材料,分别为1、13、28、29、31、35、36、40、41、43、53、55。引物SCoT5的3个位点结合引物SCoT1和SCoT3可鉴别出24个材料。引物SCoT6、SCoT7的5个位点结合SCoT1、SCoT3、SCoT5的10个位点可以鉴别出剩余的12个供试材料。SCoT标记只用15个位点就构建了55份供试材料的指纹图谱,构建效果较高,且每份材料都有不一样的图谱构成。
3 讨论
3.1 扩增体系与多态性
SCoT标记是一种新型分子标记,在茶树研究中的应用比其他类型分子标记少。它是利用单引物充当上下游引物,专门对密码子区域侧翼序列ATG设计引物进行PCR。具有扩增效果好、步骤较少、不同物种间引物通用性强等特点。因为是基于PCR扩增反应,受到各种环境的影响,当应用于不同物种中时,反应体系和条件也会存在一定的差异。因此,使用SCoT方法时,应首先对其扩增参数进行优化。优化PCR扩增反应体系一般有两种方法:一是采用单因素试验法,即对几种因素进行筛选,从而得到最佳扩增体系。夏志强等[8]采用此方法对木薯的PCR扩增各参数水平进行筛选。二是采用正交实验法,设计与分析各因素水平,根据扩增图表各水平得到最佳扩增体系,这种试验方法带有很大的主观意识因素。本试验需优化的因素有DNA模板浓度、引物浓度、2xSuperTaq Master Mix,所以采用单因素法确定最佳扩增体系,本试验中采用此方法可快速高效地确定最佳体系,省去正交法繁杂的过程。

注:序号1-55 和表1 样品对应。Note: No.1-55 Correspond to the sample in table 1.
由于选用材料基因组不同,引物与DNA模板结合位点有所差异,除了需对引物筛选外,最适退火温度也是影响扩增效果的一大因素,实验过程需要对引物最适退火温度进行筛选[9]。Tm较大,条带少而亮,有效条带少会影响多态性,影响最后判定的正确率。退火温度较低时,条带多,弱带也多,差异性就较少,泳道杂乱,可信度降低,也无法有效达到鉴定效果。因此在选定退火温度时要综合考虑泳道扩增图谱清晰度与有效性条带。本研究在保证有效性条带多、泳道条带清晰的前提下,都选用较高退火温度,这样可以使可重复性更好。
本试验将SCoT标记应用在福建茶树样品材料的亲缘关系分析,检测出福建茶树样品资源具有较高的遗传多态性。16条引物对55个茶树样品共扩增到219个位点,其中多态性位点204个,多态性比率PPB为93.15%,略低于陈熙[5]利用SCoT标记分析陕西茶树样品的PPB(96.14%),这是因为不同SCoT引物扩增不同样品资源的结合区域不同造成的。遗传相似系数集中在0.49~0.85之间,宽于陈熙所研究陕西两两材料的遗传相似系数(0.48~0.74)[5]说明福建茶资源间遗传背景较宽,具有较广的茶树遗传物质。结果表明,SCoT标记能够较好地区分供试材料,可用于分析茶树资源间亲缘关系的远近,鉴定遗传关系相同或相近的材料,构建茶树指纹图谱。
3.2 SCoT方法研究的茶树样品多样性研究
茶叶是福建省主要的经济作物,目前福建茶树品种的选育主要依靠传统育种为主,从自然杂交、人工杂交的后代中分离出优良单株,通过几年的性状鉴定、茶叶品质鉴定,性状优良,品质较好的最后认定为新品种,但这种育种工作年限长、进展缓慢。SCoT分子标记是基于茶树基因组的育种辅助手段,可以排除多年田间实验环境影响,客观真实的反应研究材料的遗传基础,达到快速判定品种,减少育种时间。陈熙[5]对陕西的50份供试材料进行分析,得到PPB为96.62%,此方法可以较好地区分各茶树样品,可用于鉴定陕西茶树材料。本研究中55个茶树样品的PPB为93.15%,多态性较好,表明SCoT标记能用于福建茶树样品判定。分析图8中55个福建茶树样品材料的聚类分析图,发现有些茶树样品能够根据地理来源而分在一类中,有些则不能按照地理来源分在一起,可能原因是茶树为异花授粉的植物,在长期生长中花粉的传播使茶树间发生了杂交。有些茶树样品可以与亲本聚在一起,有些则未按照亲本与子代亲缘关系聚在一起,未分在一起的可能原因是子代在长期人工选育、引种过程受当地环境因素的改变发生了变异,还可能与当地的群体种发生基因交流,从而出现基因的丢失。因此在育种工作中还应当注重保护优良品种及当地野生群体种,避免野生群体种优良基因在基因流过程中丢失。
图9的无根进化树与图8的分类存在很大的相似之处,但两种方法的分类方式也有不同之处,造成这种差异可能由于两种方法揭示的背景不尽相同。聚类分析重在将亲缘关系相近或种植环境相同的茶树聚在一起,这种分类受环境因素、人工栽培的影响较大。而图9中的无根进化树重在揭示两两材料间的亲缘关系的远近,茶树演化、进化的先后。聚类分析的结果可以为育种工作者选育亲本时提供直观的参考,对鉴定不同茶树种质具有很大的帮助;而无根进化树可以看出样品间进化先后,也可反映供试样品间的进化或杂交顺序。由6个SCoT扩增效果较好引物,其扩增图谱中的部分位点构建的55个茶树材料的指纹图谱,具有高效的判定效果。SCoT标记的扩增片段是位于目标密码子侧翼区域,扩增片段很可能是某一基因或者接近于某一基因所在的位置。能够真实反应材料的遗传背景,可检测出很小的差异片段,在不同材料的鉴定上优势较大。因此采用SCoT标记组建的分子鉴定图可真实反应材料间差异,为珍惜茶树资源及优异品种的保护提供很好的保障,为品种和品系的鉴定,为茶树种子、苗木检测提供科学的理论指导。
[1] Collard BY , Mackill D. Start codon targeted (SCoT) polymorphism: A simple, novel DNA marker technique for generating gene-targeted markers in plants [J]. Plant MolecuLar Biology Reporter, 2009, 27(1): 86-93.
[2] 张俊丽. 扇脉杓兰遗传多样性的SCoT分析及扇脉组的亲缘地理学研究[D]. 上海: 华东师范大学, 2016: 50-70.
[3] 韩国辉, 向素琼, 汪卫星, 等. 柑橘SCoT分子标记技术体系的建立及其在遗传分析中的应用[J]. 园艺学报, 2011, 38(7): 1243-1250.
[4] 龙治坚, 范理璋, 徐刚, 等. SCoT分子标记在植物研究中的应用进展[J]. 植物遗传资源学报, 2015, 16(2): 336-343.
[5] 陈熙. 陕西茶树种质资源DNA指纹图谱构建[D]. 陕西: 陕西理工学院, 2016: 55-57.
[6] 刘晶. 中国豆梨与川梨的遗传多样性和群体遗传结构研究[D]. 杭州: 浙江大学,2013: 17-19.
[7] 钱鑫, 李全健, 连静静, 等. 濒危植物扇脉杓兰野生居群遗传多样性的AFLP分析[J]. 生态学杂志, 2013, 32(6): 1445-1450.
[8] 夏志强, 邹枚伶, 王文泉. 木薯SRAP扩增体系的建立与优化[J]. 中国农学通报, 2008, 24(9): 457-460.
[9] 李传代. 女贞ISSR分子标记的引物筛选[J]. 热带生物学报, 2010, 14(2): 183-186, 192.
Analysis of Genetic Diversity of Fujian Tea Varieties by SCoT Markers
LIN Weidong1,2,4, CHEN Zhidan2,3,4, SUN Weijiang1,2,3,4*, YANG Ruxing5
1. College of HorticuLture, Fujian AgricuLture and Forestry University, Fuzhou 350002, China; 2. Fujian-Taiwan Joint Centre for Ecological Control of Crop Pest, Fuzhou 350002, China; 3. Anxi College of Tea Science, Fujian AgricuLture and Forestry University, Fuzhou 350002, China; 4. Fujian Tea Industry Engineering Technology Research Center, Fuzhou 350002, China; 5. Tea Research Institute, Fujian Academy of AgricuLtural Sciences, Fu’an 355015, China
SCoT-PCR amplification system is constructed to analyze the tea resources in Fujian. Totally 16 polymorphic primers were screened from 38 SCoT primers to construct fingerprints of 55 tea cultivars (lines). A total of 219 bands were amplified from 55 materials, with 216 polymorphic bands.The average bands amplified by each primer and polymorphic ratio were 13.8 and 93.15%. The Genetic similarity (GS) of 55 tea resources ranged from 0.49 to 0.85, with an average of 0.67. The SCoT marker analysis showed that theobserved number of alleles was 1.93 in these two tea groups.The effective number of alleles, Nei gene diversity, Shannon’s information index, genetic differentiation and the gene flow were 1.54, 0.32, 0.48, 0.067 and 7.01, respectively. When the genetic similarity coefficient was set to 0.64, the tea resources could be divided into two major categories.
tea[(L.)O.Kuntze],SCoT, genetic diversity, genetic relationship
S571.1;Q52
A
1000-369X(2018)01-043-15
2017-06-13
2017-08-24
福建省科技重大专项专题项目(2015NZ0002-1)、福建省区域发展重大项目(2014N3014)、福建高校产学合作项目(2015N5008)、福建省中青年教师教育科研项目(JA15184)
林伟东,男,硕士研究生,主要从事茶树种质资源创新与利用方面的研究。*通讯作者:swj8103@126.com

