代谢组学在研究茶叶品质形成中的应用
虞昕磊,艾于杰,曲凤凤,艾仄宜,刘淑媛,陈玉琼,倪德江
代谢组学在研究茶叶品质形成中的应用
虞昕磊,艾于杰,曲凤凤,艾仄宜,刘淑媛,陈玉琼,倪德江*
园艺植物生物学教育部重点实验室,华中农业大学园艺林学学院 湖北 武汉 430070
代谢组学作为系统生物学的一个重要分支,主要研究生物体系受内外环境扰动后(基因的改变或环境的变化)产生的小分子代谢物的变化,目前已被广泛应用于药理学、植物学、微生物学和食品安全等研究领域。近年茶树的代谢组研究也取得了突破性进展。本文就植物代谢组学技术在茶树生长发育、茶叶加工过程的品质形成、茶叶功能性评价等方面研究中的应用现状进行了综述。认为代谢组学技术将在茶叶品质形成及调控、茶树基因功能注释、茶树良种选育、揭示代谢网络调控机理等研究方面发挥不可替代的作用。
茶树;代谢组学;生长发育;茶叶加工;茶叶功能
代谢组学(Metabolomics或Metabonomics)旨在研究生物体或组织甚至单个细胞中的糖类、脂类、氨基酸、核苷酸等全部小分子代谢物成分及其动态变化[1]。20世纪90年代初Sauter等首次将代谢组分析引入植物系统诊断,最具代表性的是Fiehn等在拟南芥方面的研究工作[2]。根据研究对象和目的的不同,将代谢组学分为代谢物靶标分析(Target analysis)、代谢轮廓(谱)分析(Metabolite profiling)、代谢组学和代谢指纹分析(Metabolic fingerprinting)4个层次,其中代谢物靶标分析为靶向分析方法,而其余3个层次均为非靶向分析方法。非靶向的代谢谱分析和代谢物靶标分析是植物代谢组学近年研究的热点[3-5]。本文简要介绍了植物代谢组学的研究方法,并着重从靶标代谢物检测和非靶标代谢组分析的角度,综述了代谢组学在研究茶叶品质形成中的应用。
1 植物代谢组学研究方法
植物代谢组分析流程(图1)[6]:实验设计及采样—样品制备—代谢物分离及检测—代谢物鉴定及注释—数据分析及建模。
1.1 实验设计和采样
代谢组学的实验设计要求严格标准化:一是控制基本一致的植物生长环境条件,如果不能达到每次实验在完全一致的条件下完成,也要保证同一实验内不同处理或材料的生长环境条件一致[7];二是设置实验重复,一般为4~6次,进一步消除环境和实验操作的误差,获得具有统计意义的数据。采样是最重要的步骤之一,是实验误差的主要来源。为使采样差异最小化,必须严格控制植物的生长状态、优化采样方法、采样时间、采样面积和数量等[8-9]。为准确反映植株体内的真实信息,
采样时须立即阻断内在酶的活性,通常采用冰冻/液氮降温法保存样品。
1.2 样品制备
样品制备主要包括样本冷冻干燥、液氮固定并于-80℃超低温冰箱保存、代谢物浸提、分析前处理等步骤。冷冻干燥是去除样本材料中水分子最常用的方法,代谢物浸提过程要求快速、高效、均一、稳定,最普遍的方法是将植物组织器官用液氮快速冷冻,研磨成粉末后,迅速加入萃取溶剂。一般使用单一有机溶剂或混合溶剂浸提,对于极性代谢物,通常使用甲醇、乙醇、异丙醇、乙腈或水以及不同比例的混合溶剂,而对于亲脂性化合物,常用氯仿来萃取。
靶标代谢物检测和非靶标代谢组分析是两个不同的研究策略,样品的制备方法也不同。在非靶标代谢组研究中,杨亦扬等[10]优化出一种针对茶树鲜叶浸提的快速前处理方法(70%乙醇,球磨机研磨5 min),且发现冷冻干燥法预处理鲜叶能更好地保持茶树叶片中特征代谢产物。许国旺等[11]建立了基于GC-MS和LC-MS的红茶、绿茶、乌龙茶的非靶标代谢组分析方法,研究得出GC-MS提取物的优化条件是体积分数为45%的甲醇水性溶剂超声浸提、N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA)作为衍生化试剂效果最佳;LC-MS提取物的最优条件为体积分数为75%的甲醇水性溶剂加热浸提。使用核磁共振(NMR)分析时,样品的前处理方法将依赖某一类代谢物的提取方法进行选择,如氯仿提取、酸提取、甲醇提取、水提取等,Lee JE等[12]运用1H-NMR技术对茶叶发酵过程进行非靶标代谢谱监测,样品的浸提方法为去离子超纯水提取。在靶标代谢物检测研究中,如利用GCMS检测茶鲜叶中的游离态挥发性产物,萃取方法有顶空法(HSV)[13]、固相萃取(SPE)[14]、固相微萃取(SPME)[15]等。植物代谢物千差万别,其中很多物质稍受干扰,结构就会发生改变,目前还没有适合所有代谢物的一次性提取方法,通常只能根据所要分析的代谢物特性及使用的鉴定手段选择合适的溶剂成分、溶剂比例、浸提时间和浸提温度等。
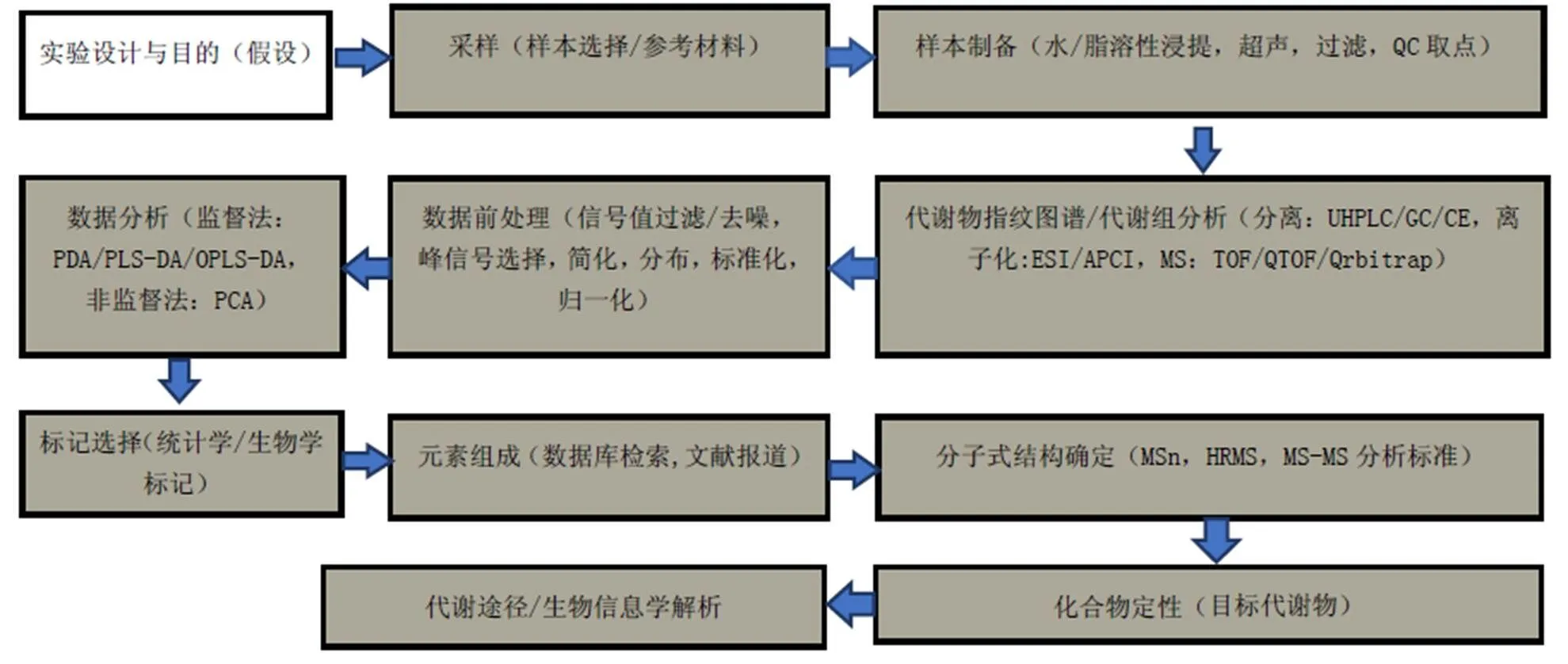
图1 植物代谢组学工作流程图
1.3 代谢物的分离和检测
代谢物的分离和检测是代谢组分析技术的两个核心。分离技术主要采用气相色谱(GC)、液相色谱(LC/HPLC/UPLC)、毛细管电泳(CE)等色谱分离方法,而目前主要的检测技术为质谱(MS/3Q-MS/TOF-MS)和核磁共振波谱技术(NMR)。
气相色谱(GC)本身分辨率高、稳定性强,适用于分析容易气化的低极性、低沸点代谢物,如各类挥发性化合物或衍生化后低沸点的物质,如氨基酸[16]、有机酸、糖类、醇类等,能检测到植物提取物中的部分初生代谢产物。茶叶香气成分或挥发性物质的分析常使用GC-MS、GC-TOF/MS等仪器,早期Wipawee P等[17]运用PYGC-MS对日本的十几种市售绿茶商品绘制了非靶标代谢指纹图谱,Christian S等[18]运用GC-MS和GC-O(气相色谱嗅闻技术)分析大吉岭红茶叶底和茶汤的香气成分,Dong F等[19]运用GC-MS研究了卷叶蛾啃噬引起的茶树鲜叶内源性挥发物的代谢变化,但单独使用GC-MS还不能全面揭示植物所有代谢物的变化。
同GC相比,高效液相色谱(HPLC)/超高压液相色谱(UPLC)相连接的质谱类型较多,如四级杆质谱、串联三重四级杆质谱、离子阱质谱、串联四级杆飞行时间质谱(Q-TOF/MS)等。LC-MS对样品提取要求简单,易于实现高通量和自动化,能检测到植物中大部分的代谢物,尤其对次级代谢产物的检出率相对较高。HPLC在茶叶品质分析中的利用率较高,通常用于靶标检测茶叶中儿茶素和黄酮类[20]、茶黄素、咖啡碱、叶绿素、类胡萝卜素[21]等代谢物,LC-MS也多用于检测糖苷类香气前体物质[22]或萜烯类、花青素、原花青素等次代产物[23]。
核磁共振技术(NMR)是一种非侵入性分析技术,样品前处理简单,可对粗提取液、细胞悬浊液、完整的组织中的代谢物进行分析,测试手段丰富,特别是氢谱(1H-NMR)具有对含氢代谢产物的普适性,缺点是灵敏度低,检测动态范围有限。近年来NMR-MS技术结合液相色谱(LC)、固相萃取(SPE)用于植物代谢物结构的鉴定中[24],Justin等[25]将LC-LTQ-Orbitrap FTMS和LC-TOFMS- SPE-NMR 结合用于分析17种黑茶、绿茶、白茶的结合态酚类物质,经鉴定得到177种酚类化合物,其中多数是3-黄烷醇和黄酮醇的糖基化或酰基化的衍生物。
目前使用单一的分析手段尚不能实现某一植物所有代谢物的全景定性和定量分析,应尽可能依靠多种分析手段,相互取长补短,跟踪监测植物代谢物的变化。
1.4 代谢物数据库
代谢物数据库是联系代谢组学与其他系统生物学分支的桥梁。综合性好且含有代谢途经的数据库有京都基因与基因组百科全书(KEGG),KEGG提供植物代谢途径(碳水化合物代谢、核苷代谢、氨基酸代谢及次生代谢等)查询,并对催化各步反应的酶进行了全面的注释,且包含有氨基酸序列、PDB数据库的链接等。MetaCyc属于BioCyc子数据库,是关于代谢途径和酶的数据库,阐述了超过1 600种生物体中的代谢途径,包含了从大量的文献和网上资源中得到的代谢途径、反应、酶和底物的资料。针对植物也建立了拟南芥、杨树、水稻、高粱等12个物种的PlantCyc数据库和查询系统。除了大型的商业化数据库(如NIST、WILEY)之外,逐渐出现了课题组或研究中心建立的数据库:格勒姆代谢组数据库(GMD)包括代谢产物衍生后的GCMS和GC-TOFMS质谱图库;METLIN数据库包含了人的23 000多种内源性和外源性代谢物、小分子药物及药物代谢物、小肽等,含有各个化合物的LC-MS、MS/MS、FT-MS质谱数据,可通过质量、化学式和结构等检索;MMCD数据库收集了超过2万个小分子代谢物的数据,配置有文本、化学结构、核磁共振数据、质谱学数据等搜索引擎;KNApSAcK数据库是一个涵盖大部分植物物种和代谢物关系的网站,包含了4万多种化合物和8 000多种植物物种的信息;MassBank是日本多所大学和研究机构共同建立的质谱谱图数据库,主要收录高分辨的质谱,包含多种质谱仪,如ESI-Q-TOFMS、GC-EI-TOF-MS、LC-ESI-TOF-MS等产生的数据,参考谱图含有多级质谱的信息,已收集了超过12 000种初生代谢物和次生代谢物在正负离子模式下获得的24 993多张质谱图;Yue Y等[26]在现有研究的基础上建立了茶树代谢产物数据库(TMDB),为收集、检索、标准化茶树代谢物提供了坚实的平台,但仍有待完善。
1.5 代谢物的定性及其生物信息学注释
代谢物的定性是植物代谢组研究的重点和难点。化学分析报告标准根据定性的程度将代谢物分为鉴定了的化合物、推断性注释的化合物、推断性分类的化合物及未知化合物4类。GC-MS鉴定代谢物主要是通过软件解卷积获得纯的质谱峰,在已有的数据库中检索,相似度较大说明可能为该物质,近年来采用保留指数(Kovats)辅助定性,对谱图相似的同分异构体有一定的区分作用,同时标准品比对是最准确的定性方法,例如GC-MS检测茶鲜叶中的挥发性物质,发现芳樟醇氧化物A/B/C/D属于同分异构体的4个物质,反式结构为呋喃型化合物,顺式结构为吡喃型化合物,还有丁香醛A/B/C等,可按ts(保留时间)出峰先后顺序来区分鉴定[15]。而对于LC-MS,没有标准的质谱图数据库,主要根据精确质量和多级质谱树来鉴定。因此,利用高分辨率的质谱仪器来确定化合物的分子量的方法至关重要。
全面注释代谢物,解析代谢途径是获取代谢组生物学信息的关键。植物通过代谢途径合成大量的化合物,在同一途径上的代谢物相互关联,可实现一种或多种生物学功能。目前只解析汇总了小部分代谢途径。一方面可以通过KEGG或PlantCyc数据库检索,将差异代谢物注释到相关代谢途径中,系统地揭示某类生物学功能的代谢基础;另一方面,也可以根据代谢组数据与生物学功能的关联,预测一些代谢途径,加快植物代谢途径的解析。Liu JW等[27]将UPLC-Q-TOF/MS和GC×GC-TOF/ MS结合,分析早/中/晚春的绿茶鲜叶代谢物种类和含量的变化,将其注释到代谢途径后,建立了代谢途径与主要农艺性状的关系。生物的代谢是一个整体,各个代谢途径相互关联,构成复杂的代谢网络。结合基因组学、转录组学和代谢组学信息可以对代谢网络进行注释或重建,拟南芥[28]、玉米[29]、水稻[30]等物种的研究都取得了进步。通过代谢途径的相关性分析,也可以获取代谢物之间的相关信息,Tai Y等[31]研究同属山茶科山茶属的茶树()和油茶()的代谢差异及相关基因差异,通过统计分析,结合转录组数据,建立一些相关的转录RNA和代谢物,发现一些紧密相关的代谢途径。
1.6 代谢组数据的多元统计分析
通过仪器分析得到的代谢组数据是一个庞大的多维矩阵,需将其降维转化成适合多变量分析的数据形式,再采用一些统计分析方法,从中有效挖掘出所需信息。目前数据分析常用的主要手段为模式识别技术,分为非监督(Unsupervised methods)和有监督(Supervised methods)两种。非监督识别是根据数据本身的属性来判断样本是否属于不同类别的方法,如主成分分析(PCA)和系统聚类分析(HCA)。监督识别是将已知类别的样本随机分为两部分(训练集和测试集),利用已知类别的训练集建立模型,通过测试集的正确率来验证模型的可靠度,常见的方法有偏最小二乘法(PLS)和线性判别分析法(LDA)。
代谢组数据的分析流程主要为:原始数据—数据预处理(数据的归一化、谱峰对齐、数据的标度换算等)—多变量分析(PCA、PLS、PLS-DA、OPLS-DA)—模型验证—潜在的生物标记物(群),最后通过数据库检索或查阅文献,分析出差异标志物所涉及的代谢途径,并对其生物学意义进行详尽的解释。软件工具根据开发者和公开程度主要有分析仪器自带的软件包、公开的、可免费下载的软件包及网络代谢组数据分析[32]3种,对现有的代谢组技术比较分析见表1。
2 茶树生长发育过程的代谢组学研究
茶树起源于中国云贵高原,为多年生常绿叶用植物。茶树鲜叶中干物质占总量的25%左右,其化学成分由3.5%~7.0%的无机物和93.0%~96.5%的有机物组成。茶叶中经分离鉴定的已知化合物有700多种,包括蛋白质、糖类、脂肪等初级代谢产物及多酚类、色素、茶氨酸、生物碱、芳香物质、皂苷等次级代谢产物。鲜叶的品质特征及性状表现受多因素(品种、地理状况、季节、栽培条件、栽培设施等)调控,仅对单个基因或信号转导途径的研究无法阐明这些性状的生理学或生物化学基础,而利用代谢组学手段,研究不同茶树品种的风格特征及栽培育种过程中代谢产物的动态变化,能揭示茶树品质形成的代谢基础,为茶树遗传改良提供新思路。
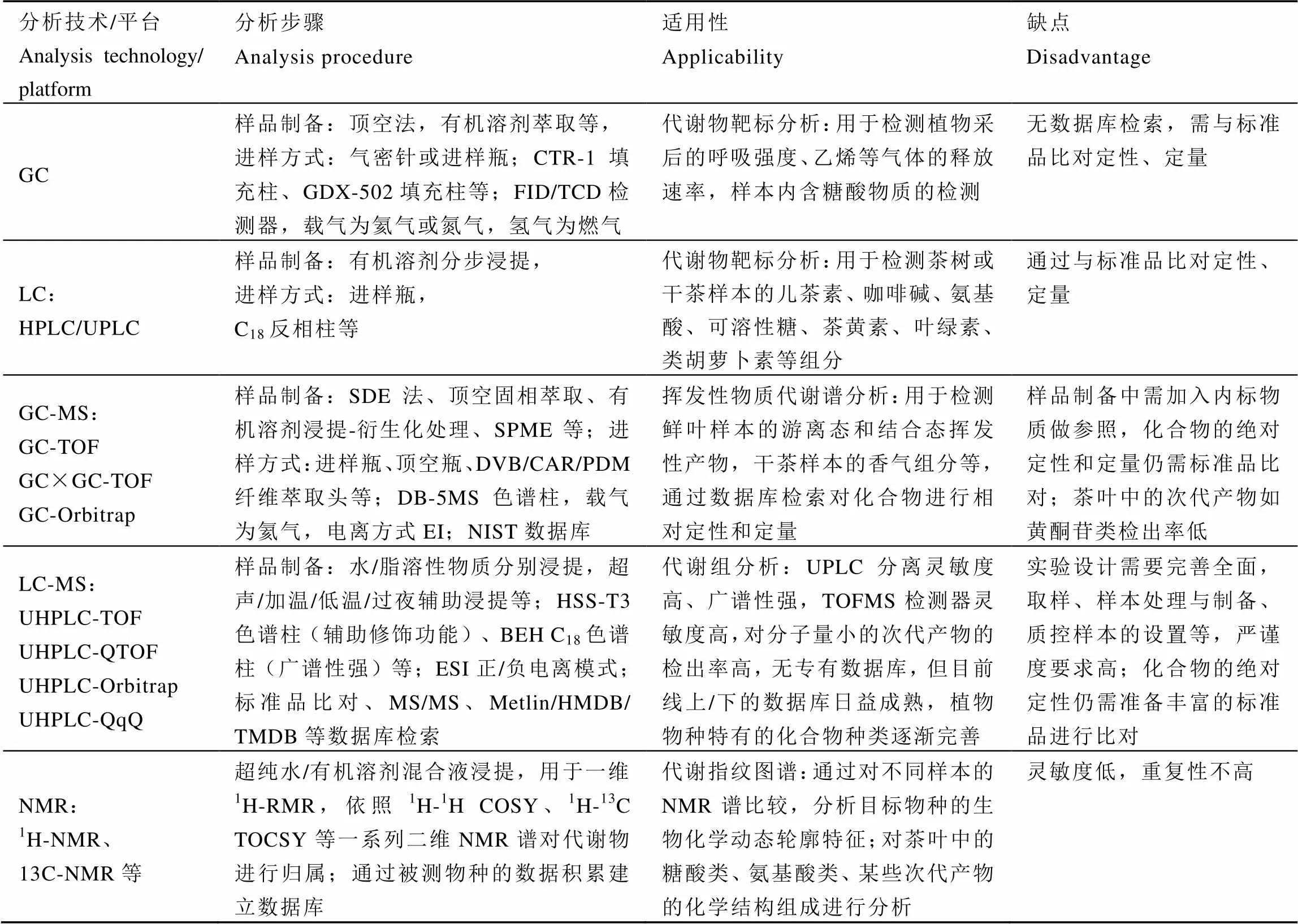
表1 代谢组学分离分析技术比较
2.1 生态环境对茶树代谢的影响
近年来,基于GC-MS、LC-MS及NMR的茶树非靶标代谢组分析方法逐渐建立与改进,并被应用于茶树种质评价或品质性状相关的代谢组学研究中。
Lee JE等[33]建立了茶树鲜叶样本的1H-NMR非靶标代谢谱分析方法,并绘制了某绿茶品种不同部位叶片的代谢指纹图谱[34],该方法可有效用于分析茶树全代谢谱变化。Elis DP等[35]基于HPLC-DAD-ESI/MS研究巴西不同季度茶树鲜叶的次生代谢产物变化,发现EGC和咖啡碱是区分巴西这两个季度茶树鲜叶代谢差异的标志物。Liu JW等[27]将UPLC-Q-TOF/MS和GC×GC-TOF/MS相结合,分析了龙井43鲜叶在早/中/晚春的代谢变化,结果表明晚春季节,光照增强,温度回升,芽叶的光合作用、光呼吸作用、三羧酸循环等代谢活动增强,碳水化合物、黄酮及其糖苷类化合物含量增加,因而晚春绿茶的风味品质较高。同样Dai WD等[36]选择了尖波黄、宁州2号、正和大白茶等9个绿茶品种,运用UPLC-Q-TOF/MS研究春/夏/秋三季的鲜叶代谢差异,数据分析得出不同季节的鲜叶代谢谱存在显著差异,其中黄烷醇、聚酯型儿茶素、原花青素、槲皮素糖苷类、芹菜素糖苷类和氨基酸表现出明显的季节波动。Too C J等[37]分别在7~9月对肯尼亚的23个栽培种采样,通过HPLC靶标监测鲜叶中茶氨酸的含量变化研究证实寒冷潮湿气候(肯尼亚的7~9月)是茶树获得高含量茶氨酸的最佳季节,季节的变换导致气候温、湿度的差异,因而对鲜叶组织内的氨基酸代谢影响较大。浙江的安吉白茶是一种早春敏感型的变异品种,早春气温较低时芽叶呈白色,随着气温上升,叶色又由白渐转为绿色。Li CF等[7]对安吉白茶白化阶段与复绿阶段的叶片分别采样,采用GC-TOFMS非靶标代谢谱分析找到了65种差异代谢物,其中主要差异代谢通路包括光合系统中的碳固定过程、苯丙氨酸合成代谢途径,以及黄酮类生物合成途径。Feng L等[38]又采用HPLC靶标代谢物检测的方法,选取4个白化品种(Ab、Hu、Th、Yu)和常规绿茶品种(Fd),分析了叶绿素a/b、类胡萝卜素、儿茶素、咖啡碱、游离氨基酸等代谢组分,研究得出一定的环境条件,如低温或异常的光照强度,白化茶品种的叶子变黄甚至呈白色,此时叶片的叶绿素、类胡萝卜素、咖啡碱和总儿茶素含量明显低于绿茶品种叶片,但游离氨基酸(包括茶氨酸)的含量上升,儿茶素和胡萝卜素的代谢是构成白化茶与常规绿茶品种间代谢差异的主要因素。
2.2 栽培条件对茶树代谢的影响
茶树主要以叶片为收获对象,氮肥施用量往往较高。氮肥对茶叶碳氮代谢平衡影响明显,能提高含氮物质的含量,降低多酚类的含量。杨亦扬等[39]将1H-NMR非靶标代谢组学分析与HPLC定量靶标分析结合,研究了白天和夜晚不同施氮水平下茶树新梢的代谢物差异,结果表明白天和夜晚所取茶树新梢第二叶的代谢谱差异较大,主要差异标志物是茶氨酸、葡萄糖和蔗糖,而施氮水平主要对游离氨基酸组分和儿茶素组分产生影响。茶树虽然是一种富Al3+植物,但高浓度的铝也会对茶树产生胁迫,Xu Q S等[40]研究不同铝离子浓度培养下的茶树根系及叶片的代谢反应,运用GC-MS非靶标代谢组分析得出,茶树对Al3+的适应能力与组织内的氨基酸、糖、莽草酸的代谢有关。
在生产上,塑料薄膜大棚和遮阳网是常用的栽培措施。冬季覆盖塑料薄膜,可降低霜冻危害,缩短茶树越冬休眠期,促进茶树早萌芽;夏季覆盖遮阳网可降温增湿,改善光质,降低茶树体内碳化物积累,提高夏茶品质。国内外对遮阳覆膜的作用机理做了详细研究,韩国Kang MK等[41]和Lee LS等[42]研究普通绿茶和碾茶的代谢组差异,发现碾茶中GC、芹菜素葡萄糖苷、槲皮素、山奈酚、苹果酸等含量明显高于普通绿茶,而EGC、EC、丁二酸、果糖含量下降,使碾茶的鲜味更强,收敛性减弱,遮荫18~20 d能使茶叶中的氨基酸、咖啡碱、GC等物质的含量显著升高,EGC、ECG、槲皮素糖基化合物、山柰酚羰基化合物的含量降低,总的来说遮荫能提高绿茶的鲜味,但口感的丰富度偏弱。Zhang QF等[8]采用黑色遮阳网和纳米绝缘薄膜(遮荫的同时,茶蓬面温度下降2~4℃)对茶树进行覆盖,研究光强和温度对绿茶品质的影响,结果遮荫促进茶树黄酮类含量显著降低,纳米膜处理的黄酮醇含量下降,但黄酮糖苷类含量上升,经KECG数据库检索到代谢途径,发现苯丙烷/类黄酮代谢途径的上下游反应会因光强和温度的外界环境作用而发生底物的竞争现象。
非靶向的代谢谱分析方法无需对代谢物进行准确定量,从全局表征茶树在受到各种内外环境扰动(基因改变或环境变化)后其代谢产物的变化,若要进一步了解茶叶中特定代谢物含量在不同环境、栽培、加工过程中的变化,则需代谢物靶标检测方法的辅助,详见表2。
3 茶叶加工过程品质形成的代谢组研究
3.1 加工过程中茶叶的代谢组研究
不同的茶类,因发酵程度和鲜叶在加工过程中的代谢变化的不同,风味品质各有特色。同时在制茶过程中,鲜叶含水量的变化速度和程度,都与制茶品质有着密切的关系,把含水量75%的茶鲜叶制成含水量6%以下的干茶,是鲜叶大量失水的过程,随着叶内水分散失速度和程度的变化,引起叶内一些成分发生相应的一系列理化变化,从而逐步形成茶叶的色、香、味、形。
绿茶的杀青工艺有炒青和蒸青两种,目的都是短时高温条件下迅速灭活PPO、POD等氧化酶类,阻止鲜叶组织内发生酶促反应,将内含物最大化保留。Han Z X等[47]选取BAS和FUD两个绿茶品种,分别按炒青和蒸青两种工艺加工成干茶,采用HPLC靶标检测干茶的儿茶素和咖啡碱组分,HS-SPME/GC-MS分别检测鲜叶和干茶样本的挥发性代谢物,再结合感官审评分析得出,与炒青相比,蒸青处理降低了茶叶中儿茶素的比例和香叶醇、芳樟醇及其衍生物的含量,因此蒸青绿茶的涩味和收敛性以及花香都偏弱。Katsuno等[48]尝试对新采摘的鲜叶先低温贮藏(15℃,16 h,黑暗环境)一段时间,再加工成绿茶,研究表明GC-MS/GC-O-MS的挥发性物质检测数据与感官审评结果一致,鲜叶经低温贮藏后加工的绿茶,花香、甜香更高,其中吲哚、茉莉内酯、茉莉酮、香豆素、甲基茉莉酮酸酯等为关键差异代谢物,表明低温贮藏期,减缓了鲜叶的失水速度,延长了保鲜摊放时间,促进了更多香气前体物质的合成与释放。
红茶的发酵工艺与茶汤的滋味、色泽、亮度、香气密切相关。国内外对红茶发酵过程中的代谢变化及其作用机理广泛关注,Youngmok K等[49]采摘同一茶树品种的鲜叶,分别加工成绿茶(不发酵)、乌龙茶(20%发酵、40%发酵、60%发酵)、红茶(80%发酵),对这5个干茶样本分别分析,HPLC测儿茶素组分、LC-MS测酚类化合物代谢谱、福林酚法测多酚总量、酶标仪法测PPO、POD等氧化酶活性、GC-MS测挥发性代谢物,大量的数据经多元统计分析后得出,5个干茶样本的酚类和挥发性产物代谢谱存在显著差异,酚类化合物的结构、种类、含量以及氧化酶活性在发酵组样本中也存在显著差异,认为发酵过程削弱了绿茶的抗氧化活性,减弱了黄酮类代谢物的潜在健康价值。Tan J F等[50]以鄂茶5号为原料,鲜叶、萎凋叶取样,发酵叶(0、1、2、4、6、8、10、12、14 h)加工成干茶分别取样,UPLC-3Q-TOFMS结合多元统计分析,绘制了红茶发酵过程的非挥发性物质代谢谱。
Zhang L等[51]研究比较了云南省14种生普洱和14种熟普洱的代谢指纹差异,采用HPLC靶标代谢物分析方法,检测儿茶素、氨基酸、咖啡碱等组分,发现在熟普中检测到24个物质特征峰,生普中检测到21个特征峰,熟普和生普的品质组分相似,个别独有的特征峰极有可能是发酵过程的变化导致。
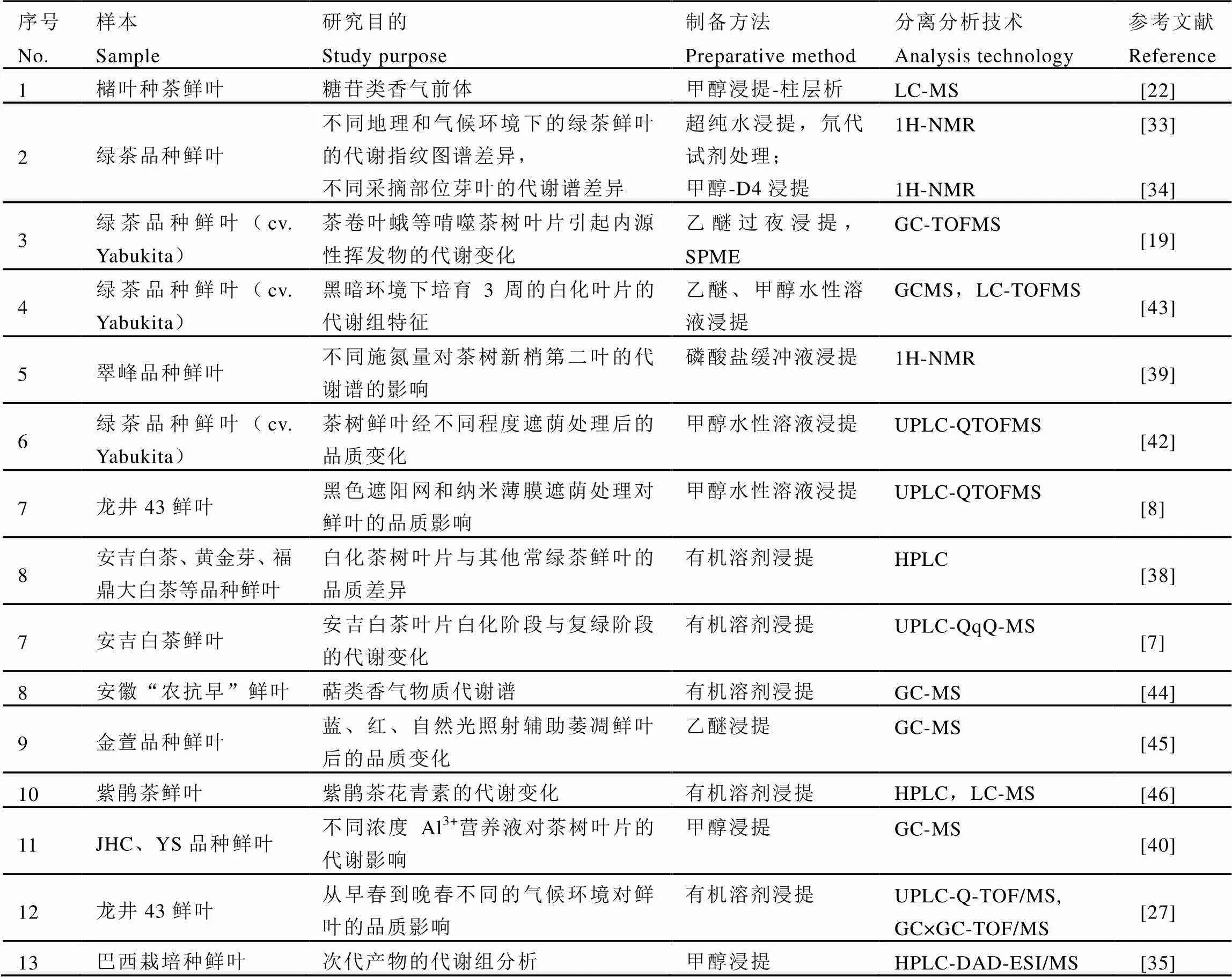
表2 基于茶树鲜叶样本的代谢组研究
3.2 次级代谢物与茶叶滋味和香气的关系
茶树能制造并积累种类繁多的有机物,包括大量的多酚类、生物碱、茶氨酸,以及色素、皂苷、芳香物质等次生代谢产物,这些产物是构成茶叶风味特质的重要元素。再者,茶叶又是重要的饮料和医药原料,因此,茶树次级代谢的研究受到国内外学者的关注。
茶树的次级代谢与茶叶香气关系密切,精确表征茶叶香气化学成分有重要的科研价值。Zhu Y等[52]通过GC×GC-TOFMS对中国传统绿茶“西湖龙井”的香气物质进行了分析,从55个西湖龙井茶样本中鉴定得到478种挥发性化合物,其中37种化合物与龙井茶的香气呈正相关,65种化合物对香气品质有负作用,确定了西湖龙井共同的香气物质。Yang T等[15]采用HS-SPME/GC-MS定性和定量市售的15种茶产品和14种茶树鲜叶中的芳樟醇化合物,结果显示芳樟醇在不同茶类及不同茶树品种间差异显著。萜类化合物具有较低的气味阈值和较愉悦的香气,对茶叶香气的影响较大。Zhu Y等[53]选取茅山白茶、英德1号红茶、铁观音乌龙茶、白牡丹白茶、普洱黑茶5大茶类的代表,采用HS-SPME/GC-MS检测干茶样本中的萜烯类挥发性化合物,分析得出S-柠檬烯、S-芳樟醇、(2S,5S)-芳樟醇氧化物A、(2S,5R)-芳樟醇氧化物B、R-4-松油醇、(2S,5R)-芳樟醇氧化物C、(2S,5S)-芳樟醇氧化物D、S-松油醇、R-紫罗兰酮、对茶螺烷A和对茶螺烷B是主要的萜类成分。糖苷挥发物(GBVS)对乌龙茶的特异香气有着突出贡献,Cui J L等[54]分别选取福鼎大白茶制作红茶,铁观音制作乌龙茶,从鲜叶、萎凋叶/晒青叶、发酵叶/摊青叶、干茶分别取样,采用LC-MS研究红茶和乌龙茶加工过程中的糖苷挥发物(GBVS)的代谢变化,分析得出红茶的揉捻阶段,茶叶中的主要糖苷类物质——茜黄樱草糖苷含量急剧下降,而吡喃葡萄糖苷含量变化不大;乌龙茶的萎凋阶段,GBVS的总量逐渐升高,在230℃的固定干燥阶段GBVs的总量急剧上升,其中β-吡喃葡萄糖苷所占比重最大,并对照KEGG对GBVs及其衍生物的代谢通路作了分析,详见表3。
植物体内的生化反应多数由一些小分子代谢物的糖基化反应调控,茶树组织内的糖基化合物多数未被鉴定,Dai WD等[56]采用UPLC-QTOF/MS非靶标代谢组分析方法,结合HMDB、TMDB等数据库,以及参考已发表的文献报道,选取了14种茶树品种,鲜叶中61种糖基化合物被检出鉴定,另外40种新型糖化物待推测鉴定中。中国的紫鹃茶因叶片富含花青素呈紫色而闻名,Lv HP等[46]将HPLC靶标代谢物分析法与LC-MS非靶标代谢组分析方法结合,采摘紫鹃茶鲜叶,并分别加工成炒青绿茶、蒸青绿茶、晒青绿茶、乌龙茶、红茶,分别检测鲜叶和干茶样本中的花青苷化合物,该研究结果为研究紫娟花青苷的代谢通路和转录调控提供了理论依据。
4 代谢组学在茶学研究中存在的问题及思考
目前代谢组学技术在茶学研究中仍存在一些问题需要改进。
首先,代谢组学研究要求数据丰富、重复性好,如何降低分离分析工具的偏差和局限性,如何标准化实验设计、采样处理条件一致,如何优化出简单易行、浸提效率高的样品前处理方法是获得较好的代谢组数据的关键步骤。为了控制和监测样品提取、样品前处理及仪器分析过程中的误差,一是要设置空白对照:空白对照不含待分析的样品,它可以检测有机溶剂的纯度、衍生化试剂杂峰、塑料管及枪头吸管中的增塑剂等外来污染物;二是要设置质控样本:质控样本可以是不同类型标准品的混合物,也可以从所有待测样本中取出很小一部分混合作为质控样本;第三设置内标:在代谢物浸提溶剂中加入已知量的内标物质,可以检测提取和分析过程中存在的误差;四是保留时间指数标准物质的添加:一般是正构烷烃或饱和脂肪酸甲酯的同系物,用来计算保留指数,对代谢物进行定性,而且还可以校正保留时间的漂移。
其次,茶树有别于其他作物,次生代谢产物复杂,虽然随着代谢组分析仪器水平和技术的普及和要求提高,已经能够大众化地做不少工作,但仍有相当多的化合物不能被准确鉴定和分析,不少发表的代谢组分析的文章存在化合物鉴定不清、含糊、测定不准的问题。例如采用GC-TOFMS非靶标分析茶鲜叶代谢组,检测不到香气有关的重要次生代谢产物,而有机溶剂萃取/GC-MS法检测鲜叶的香气成分效果显著,说明某一类型代谢物的检测,除了分辨率高的分析仪器,有针对性的浸提分离方法也是关键。无论是采用NMR和MS哪一种分离分析手段,对于物质的定性分析,仍需依靠与METLIN、NIST、HMDB、Moto DB、KEGG等数据库比对,并需要参考大量的文献报道,且应尽可能多地准备代谢物标准品去定性定量。

表3 基于干茶样本的代谢组研究
第三,如何将代谢组与其他组学技术更好地结合,发挥更大作用,仍有待实践。例如,Tai YL等[31]研究同属山茶科山茶属的茶树()和油茶()的代谢差异及相关基因差异,通过统计分析,结合转录组数据,建立一些相关的转录RNA和代谢物,发现一些紧密相关的代谢途径。其他植物的研究,如代谢组学结合致敏反应和毒理反应实验,可以综合评价转基因植物的安全性,分析转基因植物、非转基因植物和其他栽培品种的代谢谱,以主成分分析和聚类分析来区分这些相似的代谢谱,发现转基因植物代谢谱的变异范围存在于各栽培品种之间。抗旱、抗寒、抗病虫一直是茶树育种关心的问题,当植物处于胁迫、病害时,代谢物在免疫应答反应中扮演重要角色,结合代谢组学和蛋白组学、转录组学可以阐述免疫应答反应中植物细胞内的信号转导和代谢谱的变化。
随着代谢组技术的不断更新优化,研发出分辨率更高的分析设备及数据挖掘和分析工具,整合多种分离分析手段,建立更完备的数据库,植物代谢组学将在茶叶研究领域发挥更大的作用。
[1] Oliver F, Joachim K, Peter D, et al. Metabolite profiling for plant functional genomics [J]. Nature Biotechnology, 2000, 18(11): 1157-1161.
[2] Oliver F. Metabolomics—the link between genotypes and phenotypes [J]. Plant Molecular Biology, 2002(48): 155-171.
[3] 张丽, 姬厚伟, 黄锡娟, 等. 植物代谢组学及其在烟草上的应用进展[J]. 中国烟草学报, 2015, 21(5): 126-134.
[4] 尹恒, 李曙光, 白雪芳, 等. 植物代谢组学的研究方法及其应用[J]. 植物学通报, 2015, 22(5): 532-540.
[5] Josep R, Milena Z,Jana H. Advances in high-resolution mass spectrometry based on metabolomics studies for food—a review [J]. Food Additives & Contaminants: Part A, 2015, 32(10): 1685-1708.
[6] 漆小泉, 王玉兰, 陈晓亚. 植物代谢组学: 方法与应用[M]. 北京: 化学工业出版社, 2011: 9-11.
[7] Li C F, Yao M Z, Ma C L, et al. Differential metabolic profiles during the albescent stages of‘Anji Baicha’() [J]. PLOS ONE, 2015(10): 1-18.
[8] Zhang Q F, Shi Y Z, Ma L F, et al. Metabolomic analysis using ultra-performance liquid chromatography quadrupole time of flight mass spectrometry (UPLC-Q-TOFMS) uncovers the effects of light intensity and temperature under shading treatments on the metabolites in tea [J]. PLOS ONE, 2014, 9(11): 1-10.
[9] Maria D, Antiochia R, Anatoly P, et al. Untargeted and targeted methodologies in the study of tea [J]. Food Research International, 2014(63): 275-289.
[10] 杨亦扬, 张佳, 王川丕, 等. 茶树鲜叶品质成分浸提方法比较及应用[J]. 茶叶科学, 2014, 34(2): 137-143.
[11] 许国旺, 张磊, 曾仲大, 等. 基于气相色谱-质谱联用与液相色谱-质谱联用的非靶向代谢组学用于3类茶叶中化学成分分析[J]. 色谱, 2014, 32(8): 804-816.
[12] Lee J E, Lee B J, Chung J O, et al. 1H NMR-based metabolomic characterization during green tea () fermentation [J]. Food Research International, 2011(44): 597-604.
[13] Makoto K, Kozo O, Hiroshi K, et al. Determination of dimethylsulfide in the head space vapor of green tea by gas chromatography [J]. Agricultural and Biological Chemistry, 1977, 41(11): 2285-2287.
[14] 陈亚东, 曹玉廷, 干宁, 等. 分子印迹固相萃取和电喷雾质谱法联用测定茶叶中四种儿茶素[J]. 茶叶科学, 2009, 29 (3): 231-235.
[15] Yang T, Zhu Y, Shao C Y, et al. Enantiomeric analysis of linalool in teas using headspace solid-phase micro extraction with chiral gas chromatography [J]. Industrial Crops and Products, 2016(83): 17-23.
[16] 张佳, 王川丕, 阮建云. GC-MS及GC测定茶叶中主要游离氨基酸的方法研究[J]. 茶叶科学, 2010, 30(6): 445-452.
[17] Wipawee P, Taksehi B, Tsutomu Y, et al. Quality prediction of Japanese green tea using pyrolyzer coupled GC/MS based metabolic fingerprinting [J]. Journal of Agricultural and Food Chemistry, 2008, 56: 744-750.
[18] Christian S, Peter S. Characterization of the key aroma compounds in the beverage prepared from Darjeeling black tea quantitative differences between tea leaves and infusion [J]. Journal of Agricultural and Food Chemistry, 2006, 54: 916-924.
[19] Dong F, Yang Z Y, Susanne B, et al. Herbivore-induced volatiles from tea () plants and their involvement in intraplant communication and changes in endogenous nonvolatile metabolites [J]. Journal of Agricultural and Food Chemistry, 2011, 59: 13131-13135.
[20] Viola S Y L, Dou J P, Ronald J Y C, et al. Massive accumulation of gallic acid and unique occurrence of myricetin, quercetin, and kaempferol in preparing old Oolong tea [J]. Journal of Agricultural and Food Chemistry, 2008, 56(17): 7950-7956.
[21] Alexandr Y Y, Boris V N, Emilie C, et al. Determination of the chemical composition of tea by chromatographic methods—a review [J]. Journal of Food Research, 2015, 4(3): 56-87.
[22] 张正竹, 宛晓春, 陶冠军. 茶鲜叶中糖苷类香气前体的液质联用分析[J]. 茶叶科学, 2005, 25(4): 275-281.
[23] Hitoshi I, Toshiyuki W, Yukiko K, et al. Quantitation of chafurosides A and B in tea leaves and isolation of prechafurosides A and B from Oolong tea leaves [J]. Journal of Agricultural and Food Chemistry, 2009, 57(15): 6779-6786.
[24] 赵燕, 丁立建. 核磁共振技术在植物代谢研究中的应用[J]. 现代仪器与医疗, 2013, 19(1): 21-24.
[25] Justin J J. H Moktar A, Fatma Y Ü, et al. Structural annotation and elucidation of conjugated phenolic compounds in black, green, and white tea extracts [J]. Journal of Agricultural and Food Chemistry, 2012, 60: 8841-8850.
[26] Yue Y, Chu G X, Liu X S, et al. TMDB: a literature-curated database for small molecular compounds found from tea [J]. BMC Plant Biology, 2014, 14:243. DOI: 10.1186/s12870-014-0243-1.
[27] Liu J W, Zhang Q F, Liu M Y, et al. Metabolomic analyses reveal distinct change of metabolites and quality of green tea during the short duration of a single spring season [J]. Journal of Agricultural and Food Chemistry, 2016, 64: 3302-3309.
[28] Chao L, Cheng S, Zhang Y, et al. Transcriptomic, proteomic and metabolic changes inleaves after the onset of illumination [J]. BMC Plant Biology, 2016(16): 43. DOI 10.1186/s12870-016-0726-3.
[29] Wen W W, Li D, Li X, et al. Metabolome-based genome-wide association study of maize kernel leads to novel biochemical metabolome-based genome-wide association study of maize kernel leads to novel biochemical insights [J]. Nature Communications, 2014(2): 1-10.
[30] Chen W, Gao Y Q, Xie W B, et al. Genome-wide association analyses provide genetic and biochemical insights into natural variation in rice metabolism [J]. Nature Genetics, 2014, 46(7): 714-720.
[31] Tai Y, Wei C, Yang H, et al. Transcriptomic and phytochemical analysis of the biosynthesis of characteristic constituents in tea () compared with oil tea () [J]. BMC Plant Biology, 2015(15): 190. DOI: 10.1186/s12870-015-0574-6.
[32] Xia J G, Igor V S, Beomsoo H, et al. MetaboAnalyst 3.0-making metabolomics more meaningful [J]. Nucleic Acids Research, 2015(4): 1-7.
[33] Lee J E, Lee B J, Chung J O, et al. Geographical and climatic dependencies of green tea () metabolites: A1H NMR-based metabolomics study [J]. Journal of Agricultural and Food Chemistry, 2010, 58: 10582-10589.
[34] Lee J E, Lee B J, Hwang J, et al. Metabolic dependence of green tea on plucking positions revisited a metabolomic study [J]. Journal of Agricultural and Food Chemistry, 2011, 59: 10579-10585.
[35] Elis D P, Ieda S S, Romà T. Analytical investigation of secondary metabolites extracted fromL. leaves using a HPLC-DAD-ESIMS data fusion strategy and chemometric methods [J]. Journal of Chemometrics, 2016, 30: 75-85.
[36] Dai W D, Qi D D, Yang T, et al. Nontargeted analysis using ultraperformance liquid chromatography quadrupole time-of-flight mass spectrometry uncovers the effects of harvest season on the metabolites and taste quality of tea (L.) [J]. Journal of Agricultural and Food Chemistry, 2015, 63: 9869-9878.
[37] Too C J, Wanyoko K J, Kinyanjui T, et al. Effect of seasons on theanine levels in different Kenyan commercially released tea cultivars and its variation in different parts of the tea shoot [J]. Food and Nutrition Sciences, 2015, 6: 1450-1459.
[38] Feng L, Gao M J, Hou R Y, et al. Determination of quality constituents in the young leaves of albino tea cultivars [J]. Food Chemistry, 2014(155): 98-104.
[39] 杨亦扬, 马立锋, 黎星辉, 等. 氮素水平对茶树新梢叶片代谢谱及其昼夜变化的影响[J]. 茶叶科学, 2013, 33(6): 491-499.
[40] Xu Q S, Wang Y, Ding Z T, et al. Aluminum induced metabolic responses in two tea cultivars [J]. Plant Physiology and Biochemistry, 2016(101): 162-172.
[41] Kang M K, Jung N C, Jiyoung K, et al. Metabolomics analysis reveals the compositional differences of shade grown tea (L.) [J]. Journal of Agricultural and Food Chemistry, 2010, 58: 418-426.
[42] Lee L S, Choi J H, Son N, et al. Metabolomic analysis of the effect of shade treatment on the nutritional and sensory qualities of green tea [J]. Journal of Agricultural and Food Chemistry, 2013(1): 113-121.
[43] Yang Z Y, Eiji K, Tsuyoshi K, et al. Characterisation of volatile and non-volatile metabolites in etiolated leaves of tea () plants in the dark [J]. Food Chemistry, 2012(135): 2268-2276.
[44] 刘晶晶,王富民,刘国峰,等. 茶树萜类香气物质代谢谱与相关基因表达谱时空变化的关系[J]. 园艺学报. 2014, 41(10): 2094-2106.
[45] Fu X M, Chen Y Y, Mei X1, et al. Regulation of formation of volatile compounds of tea () leaves by single light wavelength [J]. Scientific Reports, 2015(11): 1-11.
[46] Lv H P, Dai W D, Tan J F, et al. Identification of the anthocyanins from the purple leaf coloured tea cultivar Zijuan (var. assamica) and characterization of their antioxidant activities [J]. Journal of Functional Foods, 2015(17): 449-458.
[47] Han Z X, Mohammad M R, Liu G F, et al. Green tea flavour determinants and their changes over manufacturing processes [J]. Food Chemistry, 2016(212): 739-748.
[48] Tsuyoshi K, Hisae K, Yumi K, et al. Characterisation of odorant compounds and their biochemical formation in green tea with a low temperature storage process [J]. Food Chemistry, 2014(148): 388-395.
[49] Youngmok K, Kevin L G, Jong D P, et al. Changes in antioxidant phytochemicals and volatile composition ofby oxidation during tea fermentation [J]. Food Chemistry, 2011(129): 1331-1342.
[50] Tan J F, Dai W D, Ma Y L, et al. Study of the dynamic changes in the non-volatile chemical constituents of black tea during fermentation processing by a non-targeted metabolomics approach [J]. Food Research International, 2016(79): 106-113.
[51] Zhang L, Ning L, Yan Y C, et al. Development of the fingerprints of crude Puerh tea and ripened Puerh tea by high performance liquid chromatography [J]. Journal of Chinese Pharmaceutical Sciences, 2011(20): 352-359.
[52] Zhu Y, Lv H P, Dai W D, et al. Separation of aroma components in Xihu Longjing tea using simultaneous distillation extraction with comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry [J]. Separation and Purification Technology, 2016(164): 146-154.
[53] Zhu Y, Shao C Y, Lv H P, et al. Enantiomeric and quantitative analysis of volatile terpenoids in different teas () [J]. Journal of Chromatography A, 2017(1490): 177-190.
[54] Cui J L, Tsuyoshi K, Kojiro T, et al. Characteristic fluctuations in glycosidically bound volatiles during tea processing and identification of their unstable derivatives [J]. Journal of Agricultural and Food Chemistry, 2016, 64: 1151-1157.
[55]Lo Y H, Chen Y J, Chang C I, et al. Teaghrelins, unique acylated flavonoid tetraglycosides in Chin-shin Oolong tea, are putative oral agonists of the ghrelin receptor [J]. Journal of Agricultural and Food Chemistry, 2014, 62: 5085-5091.
[56] Dai W D, Tan J F, Lu M L, et al. Nontargeted modification-specific metabolomics investigation of glycosylated secondary metabolites in Tea (L.) based on liquid chromatography-high-resolution mass spectrometry [J]. Journal of Agricultural and Food Chemistry, 2016, 64: 6783-6790.
Metabolomics Application in the Study of Tea Quality Formation
YU Xinlei, AI Yujie, QU Fengfeng, AI Zeyi, LIU Shuyuan, CHEN Yuqiong, NI Dejiang*
College of Horticulture &Forestry Sciences, HuaZhong Agricultural University; Key Laboratory of Horticulture Plant Biology, Ministry of Education, Wuhan 430070, China
Metabolomics, an important branch of systems biology, mainly study the changes of small molecule metabolites affected by the internal and external environments (gene or environmental changes). Metabolomics has been widely applied in the field of natural medicine development, botany, microbiology and food safety researches. The application of metabolomics in tea science has also been developed rapidly in recent years. In this article, the application of metabolomics in three major aspects of tea researches (growth and development, the quality formation during processing and the evaluation of tea function) was reviewed and discussed. We believed that metabolomics would play an irreplaceable role in the analysis of gene function, the regulation of metabolic network, the cultivation and the quality improvement in tea.
, metabolomics, growth and development, tea processing, tea functions
S571.1;Q51
A
1000-369X(2018)01-020-13
2017-04-05
2017-08-15
国家自然科学基金(34114057)
虞昕磊,女,博士研究生,主要从事茶树代谢与分子生物学研究,jiayoualei@sina.com。*通讯作者:nidj@mail.hzau.edu.cn

