山东茶园土壤高活性解钾细菌的筛选鉴定及肥效研究
韩晓阳,周波,董玉惠,张丽霞*,侯剑,向勤锃,黄晓琴*
山东茶园土壤高活性解钾细菌的筛选鉴定及肥效研究
韩晓阳1,2,周波3,董玉惠1,2,张丽霞1,2*,侯剑4,向勤锃1,2,黄晓琴1,2*
l. 山东农业大学园艺科学与工程学院,山东 泰安 271000;2. 作物生物学国家重点实验室,山东 泰安 271000;3. 泰安市农业局,山东 泰安 271000;4. 日照市岚山区茶业管理办公室,山东 日照 276800
为了筛选到适合山东茶园土壤环境的解钾菌株,以提高土壤钾素的高效转化效率,本研究经过菌株富集、分离、纯化等步骤,从山东茶园土壤中分离出9株解钾细菌。通过有效钾含量比较和菌株分类,筛选出1株活性最强菌株K2,经鉴定K2菌株为枯草芽孢杆菌()。发酵试验表明,菌株K2最适宜生长的条件为pH值6.0,温度35℃,以麦芽糖、淀粉、玉米粉为碳源,酵母膏为氮源。施用该菌剂后土壤速效钾和速效磷含量比对照最大分别提高28.40%和28.49%。茶叶产量最大提高36.30%,同时茶叶中氨基酸含量显著增加,酚氨比值降低,有利于茶叶品质的提升。菌株K2可能是一株茶园土壤高效解钾细菌,可作为后续进一步研究茶园专用微生物菌剂的参考。
山东茶园;解钾细菌;枯草芽孢杆菌;肥效
茶叶是我国重要的经济作物,具有独特的营养与保健功能。目前山东茶园面积已有约2.7万hm2(40多万亩),其土壤多由片麻岩和花岗岩发育形成(两类岩石中钾长石KAlSi3O8比例较大),虽然成土母质中钾素总量较丰富,但速效钾含量不足[1]。为了补足茶树对钾的需求,茶农多施用含钾化肥。化肥的大量使用,会导致土壤微生物多样性降低,板结程度上升,污染了环境[2]。因此,如何在降低化肥施用量的同时,加快土壤中含钾矿物的转化以提高土壤有效钾素含量,成为当前山东茶树营养管理的研究焦点之一。
土壤中存在大量微生物,可与矿物质作用改变土壤养分结构[3]。解钾细菌是一类能分解硅酸盐和铝硅酸盐矿物,释放钾、磷和硅等元素的细菌[4]。前人已发现的解钾细菌主要包括芽胞杆菌、固氮菌、假单胞菌、伯克霍尔德菌和农杆菌等[5-7],这些菌株应用后不仅增加了土壤中钾素的含量[8],同时促进了产量的提高[9],因此越来越受到人们的关注。在山东茶园土壤中如果能筛选到高活性的解钾菌株,制备成菌剂施用于土壤中将会加速矿物中钾的释放,这对于提高土壤速效钾含量具有重要的作用。本研究从山东茶园土壤中分离筛选出具有解钾功能的高效菌株,并对其进行肥效研究,可为山东茶树解钾菌剂的研发提供菌种支持。
1 材料与方法
1.1 试验材料
菌种分离来源:山东省济南市圣虎山茶园土壤。参比菌株为胶质芽孢杆菌(AMCC100075),该菌株由山东农业微生物菌种保藏管理中心提供。
1.2 培养基的制备
LB液体培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,定容至1 000 mL;富集培养基:酵母膏0.5 g,蔗糖10 g,(NH4)2SO41.0 g,Na2HPO42.0 g,MgSO4·7H2O 0.5 g,CaCO31.0 g,钾长石粉(K2O·Al2O3·6SiO2)1.0 g,定容至1 000 mL;每升富集培养基中加入15 g琼脂为选择培养基。培养基pH均调至7.0,使用前均在121℃条件下灭菌20 min[10]。
1.3 菌株的分离、纯化
称取10 g新鲜土壤样品,采用梯度稀释法及平板划线法[10]进行菌株分离纯化。所纯化的菌株在选择培养基中能产生溶钾圈的即为解钾细菌。
1.4 菌株分类
将菌株接种到LB液体培养基中,置于震荡培养箱中震荡培养,温度为28℃,转速200 r·min-1。培养12~24h后,5 000 r·min-1离心弃上清液,收集菌体,采用SDS-PAGE法进行菌株分类[11-13]。
1.5 菌株的鉴定
1.5.1 菌株分子鉴定
提取菌株总DNA,采用细菌16 S rDNA通用引物[11](16S-8F:AGAGTTTGATYMTGG CTCAG;16 S-1510-R:AGGGYTACCTTG TTACGACTT),按文献[14]的反应体系及条件进行PCR扩增检验。测序后将所测序列进行Blast比对分析,构建系统发育树分析菌株系统发育地位。
1.5.2 形态特征及生理生化鉴定
菌落形态特征用肉眼进行观察。菌株个体形态采用JEM-1200EX透射式电子显微镜进行观察[15]。根据细菌鉴定手册[16-17]进行菌株生理生化鉴定。
1.6 菌株解钾能力及发酵液pH测定
将菌株接种到LB液体培养中,置于摇床中28℃,120 r·min-1震荡培养,制备液体种子,以不接种为对照。当菌液OD600=0.05时,吸取种子液接种到选择培养基中,接种量为4%,28℃,120 r·min-1培养7 d。将发酵培养液置于离心管中,5 000 r·min-1离心10 min取上清液。利用PHS-3C型pH计测定上清液pH值,采用火焰光度法[18]测定上清液中钾含量。
1.7 菌株特性研究
1.7.1 适宜菌株生长的pH值和温度
液体种子制备及接种量同上述1.6节内容。pH试验设5个处理:pH=4、5、6、7、8,将接种后的培养基置于摇床中培养24 h,温度设定为28℃,转速设定为180 r·min-1;温度试验设6个处理:15、20、25、30、35、40℃,培养基pH调配至7.0,转速同上。以上试验震荡培养后测定菌液OD600值。
1.7.2 单一碳源和氮源测定
碳源试验:分别用葡萄糖、蔗糖、麦芽糖、可溶性淀粉、玉米粉作为初始发酵培养基中的唯一碳源;氮源试验:分别用蛋白胨、酵母膏、尿素、豆饼粉、硫酸铵作为初始发酵培养基中的唯一氮源。28℃,120 r·min-1培养48 h后,采用微生物平板计数法[10]测定发酵液活菌数,以确定最适碳源和氮源。
1.8 菌剂效果试验
试验地点设在山东省济南市圣虎山的茶园,该茶园土壤基本理化性状为有机质含量16.1 g·kg-1,pH 5.4,硝态氮5.74 mg·kg-1,铵态氮14.82 mg·kg-1,有效磷142.82 mg·kg-1,速效钾222.6 mg·kg-1。供试茶树品种为福鼎大白。供试肥料为有机肥(有机质含量≥40%)及自制解钾菌剂(有效活菌数每克10.0亿个;载体为麦麸、草炭、硅藻土复合而成)。
试验设3个处理,分别为有机肥(CK)、空白载体+有机肥(T1)、解钾菌剂+有机肥(T2)。每个处理设2个小区,每个小区面积为60 m2,于5月下旬和8月上旬进行施肥。每个小区每次有机肥施用量为36 kg,T1、T2处理载体和菌剂的施用量为0.55 kg。分别在7月底和9月底各取1次茶样和土样,测定茶叶产量及生化成分,土样过筛风干保存测定养分含量。
1.9 土壤养分测定
采用“之字形”取样方式用取样器取土,深度0~30 cm,将多点土样混匀、风干过筛保存。以2 mol·L-1氯化钾溶液为浸提剂,土液比为1︰5(质量比),置于往复振荡机中(25±1)℃震荡1 h,以浸提土壤中的铵态氮、硝态氮。浸提后采用靛酚蓝比色法测定铵态氮,双波长比色法测定硝态氮。
以pH 2.5的0.2 mol·L-1HOAc-0.25 mol·L-1NH4NO3为浸提剂,土液比为1︰10(质量比),置于往复振荡机中(25±1)℃震荡5 min,以浸提土壤中的速效磷和速效钾。浸提后采用钼锑抗比色法测定速效磷,采用火焰光度法测定速效钾[3-4]。
1.10 茶树百芽重及茶叶生化成分测定
试验采摘1芽2叶初展的茶树鲜叶计算百芽重。参考国家标准方法(GB/T 8303)进行固样、磨碎、保存,进行茶叶品质生化成分分析。水分测定参考GB/T 8304—2013、水浸出物测定参考GB/T 8305—2013、茶多酚测定参考GB/T 8313—2008、氨基酸含量测定参考GB/T 8314—2013、咖啡碱测定参考GB/T 8312—2013。
1.11 数据处理
试验所得数据采用SPSS 20.0软件进行单因素方差分析,Duncan新复极差法对处理间进行多重比较(< 0.05)。相关数据的作图利用Excel 2010进行处理。将SDS-PAGE数据进行转换(有条带标记为1,无条带标记为0),采用NTSYS 2.1软件进行upgma聚类分析。
2 结果与分析
2.1 菌株的分离纯化及初筛
试验共分离纯化出菌株11株。通过利用解钾选择培养基对分离得到的菌株进行定性初选。结果表明,能产生明显溶钾圈的解钾菌株有9株,分别为K2、K3、K13、K15、K18、K23、K28、K52、K56。菌株溶钾情况见图1。
2.2 菌株的复筛
2.2.1 菌株分类
试验采用蛋白质电泳技术对9株初选菌株进行了聚类。如图2所示,9株菌株共分成5类。菌株K2、K3属于同一类群(类群Ⅰ),菌株K23、K52属于同一类群(类群Ⅱ),类群Ⅲ仅有K28单一菌株,菌株K18、K56属于同一类群(类群Ⅳ),菌株K13、K15属于同一类群(类群Ⅴ)。
2.2.2 解钾菌解钾能力测定
由表1可知,菌株K2解钾能力最高,其解钾能力是对照菌株的3.16倍。此外,发酵完后培养液pH均出现了不同程度的下降,且与有效钾浓度呈一定的负相关性,即有效钾浓度越大,发酵液pH越小。综合图2和表1的结果,菌株K2活性最高。
2.3 菌株的鉴定
2.3.1 16 S rDNA分子鉴定
试验提取菌株总DNA后进行了PCR扩增检验。如图3所示,解钾细菌K2的PCR条带约在1 500 bp处,这与菌株16 S rDNA的理论值相符。
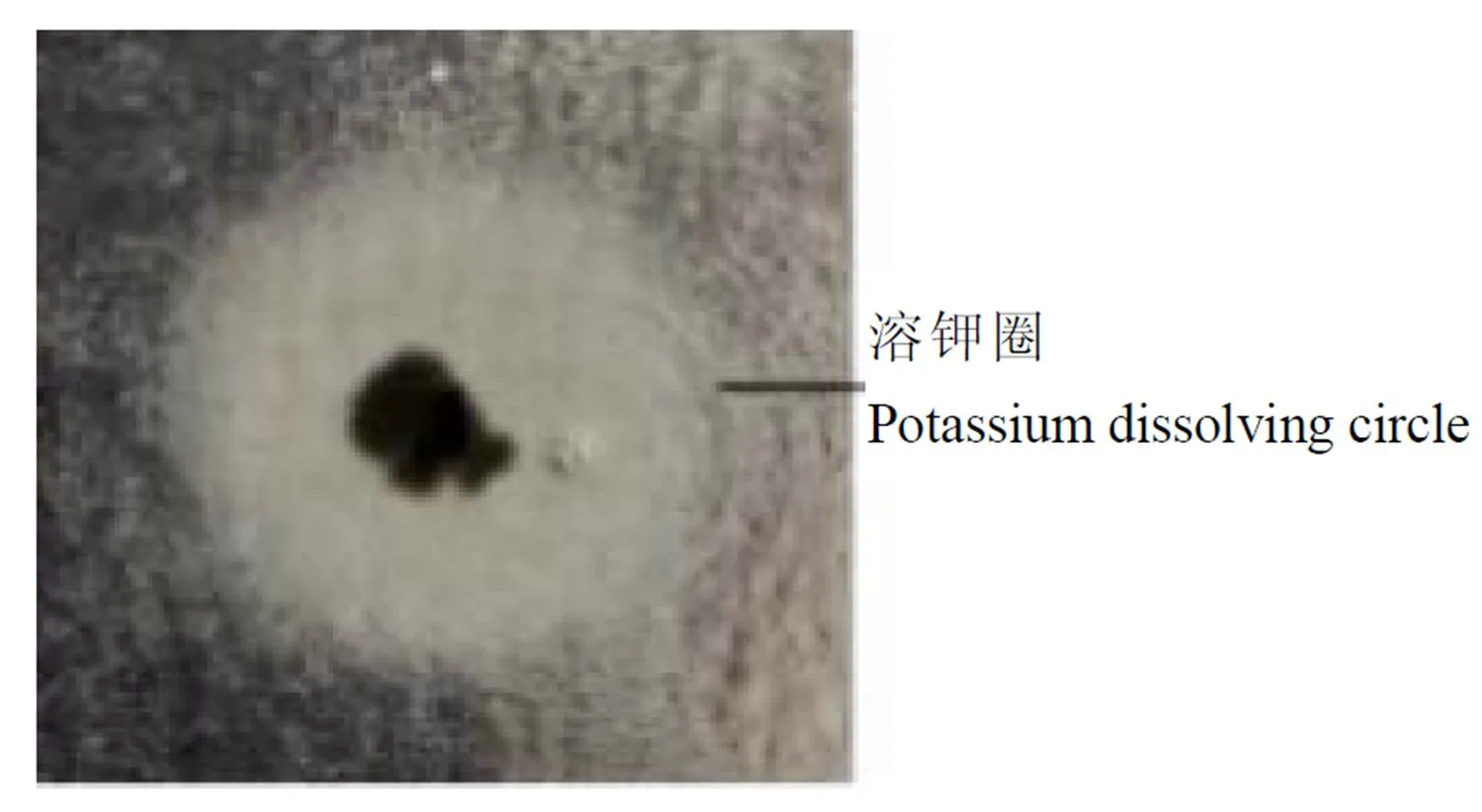
图1 菌株溶钾圈
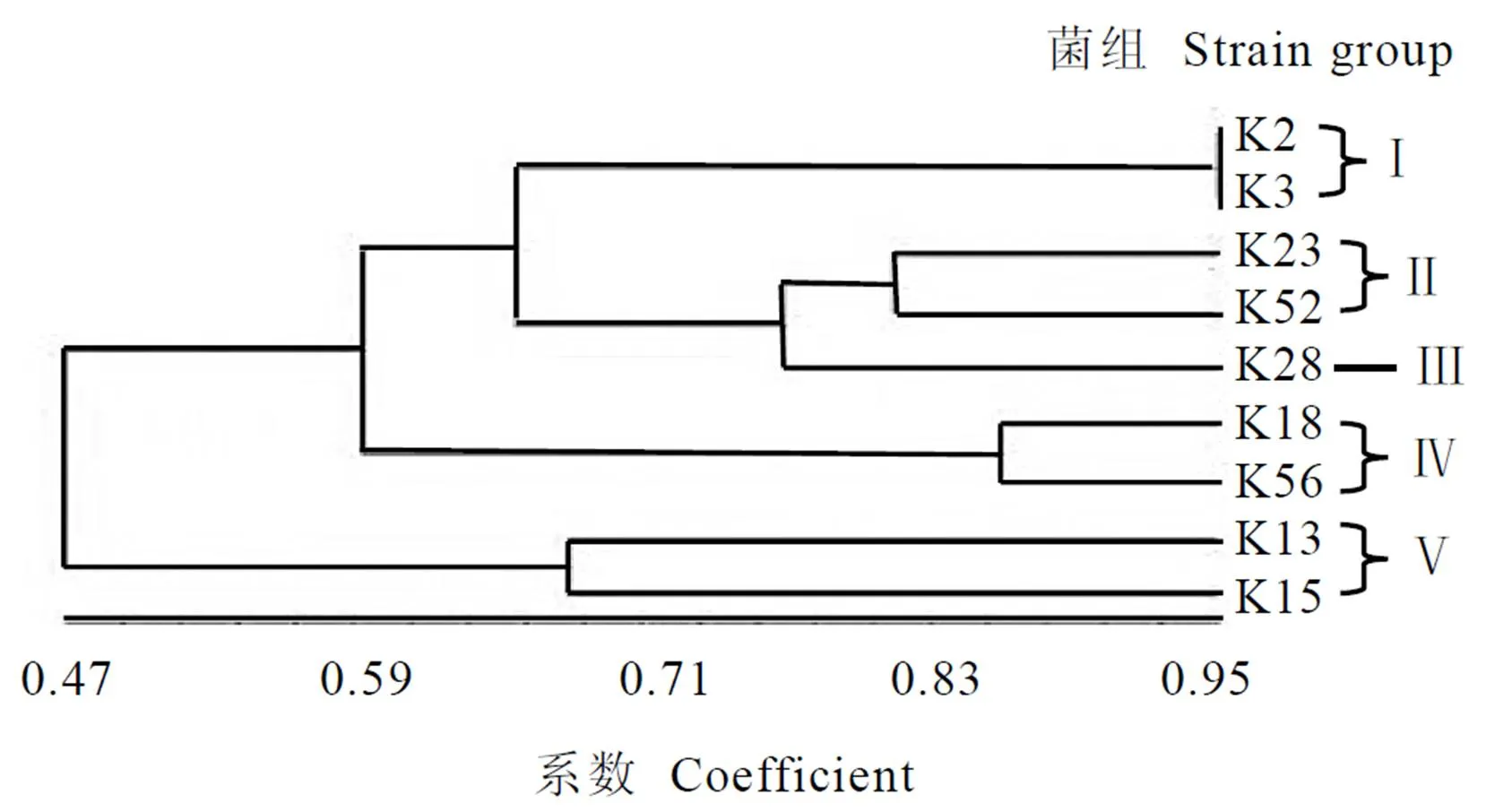
图2 解钾细菌聚类分析树形图
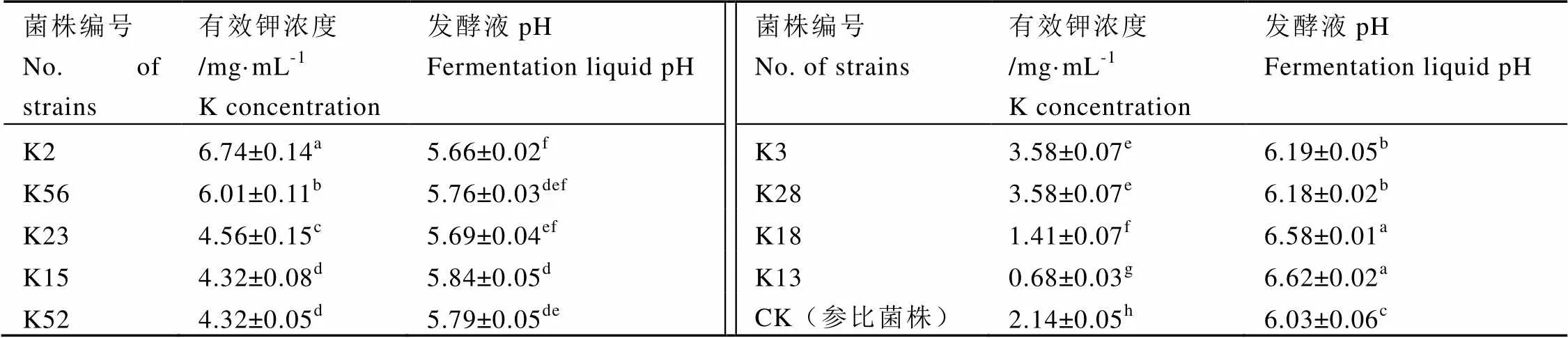
表1 解钾菌株解钾能力
注:同列不同小写字母表示差异达5%显著水平。Note: Different letters in the same row mean significant at 5% level.
测序后将所得序列进行BLAST比对,结果表明K2与枯草芽孢杆菌()相似率最高。选取同源性在96%以上的菌株构建系统发育树(图4),可见菌株K2与亲缘关系最近。同时菌株K2在GenBank中进行登录,登录号为KX064394。
2.3.2 菌落、菌体形态及生理生化鉴定
通过对菌落形态观察,发现K2菌株菌落为乳白色椭圆形,其表面褶皱,边缘不整齐,不透明,菌落呈凸起状。从个体形态来看,菌株K2为杆状细菌,无荚膜(图5)。
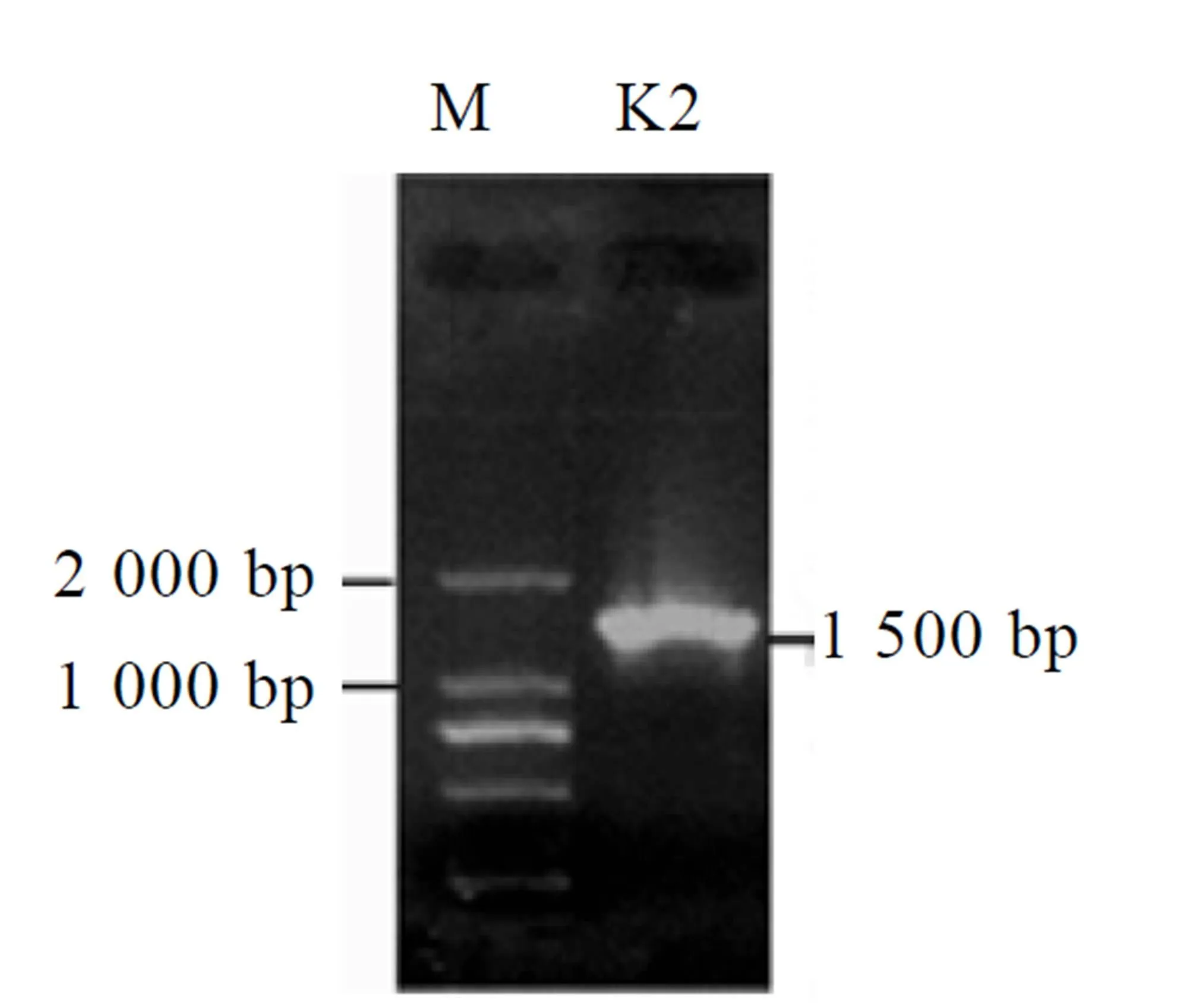
图3 解钾细菌16 S rDNA 电泳图
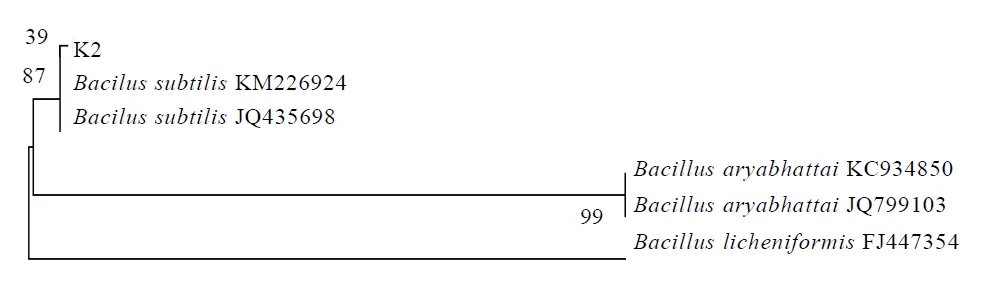
图4 解钾细菌系统发育树
注:菌株个体形态的放大倍数为10 000 倍。

表2 解钾菌生理生化特征鉴定结果
注:“+”代表阳性,“−”代表阴性。
Note: “+”means positive, “−” means negative.
从表2可知,菌株K2革兰氏染色、接触酶、V-P均呈阳性,生长过程中具有需氧特点,可利用葡萄糖、蔗糖和半乳糖,能水解酪素,液化明胶。根据菌株形态特点、生理生化指标的鉴定、分子测序结果,可以认定K2为枯草芽孢杆菌()。
2.4 菌株发酵条件
2.4.1 pH值及温度对菌株的影响
如图6所示,在pH值4~6时菌株活性随着pH的增大而增大,在6时达到最大,随后呈现下降的趋势。可见,K2菌株最适宜生长的pH值为6,喜欢偏弱酸的生长环境。菌株在温度为15~40℃内均能生长。随着温度的升高,K2菌株的活性呈现增大的趋势,在35℃时达到最大,随后急剧下降。可见,K2菌株最适宜生长温度为35℃。
2.4.2 单一碳源、氮源对菌株的影响
如表3所示,菌株对单一碳源、氮源的利用情况不同。菌株K2在以玉米粉为唯一碳源的培养基中发酵生长最快,而在以葡萄糖或蔗糖为单一碳源的培养基中生长缓慢;在以酵母膏为唯一氮源的发酵培养基中生长最快。
2.5 解钾菌剂肥效
2.5.1 解钾菌剂对茶园土壤化学成分的影响
由表4可知,在氮素含量方面,第一次施用后T2处理硝态氮和铵态氮含量均显著低于T1和CK,第二次施用后T2处理中两种形态的氮表现出较高的含量,其中硝态氮含量显著大于其它处理,而铵态氮与T1和CK没有差别。在速效磷方面,两次施肥T2处理都表现出较高的含量。第一次施肥后T2处理速效磷含量比CK增加了28.49%,第二次增加了24.96%,表明该菌剂在增加土壤速效磷方面起到了促进作用。此外,两次试验施用菌剂后土壤速效钾含量显著高于其它处理。第一次施肥后T2处理比CK增加了26.26%,第二次增加了28.40%,说明该菌剂能有效的促进土壤钾的释放。综合两次施肥结果可知,施用该菌剂能较好地提高茶园土壤肥力,特别是在提高磷钾含量方面作用显著。
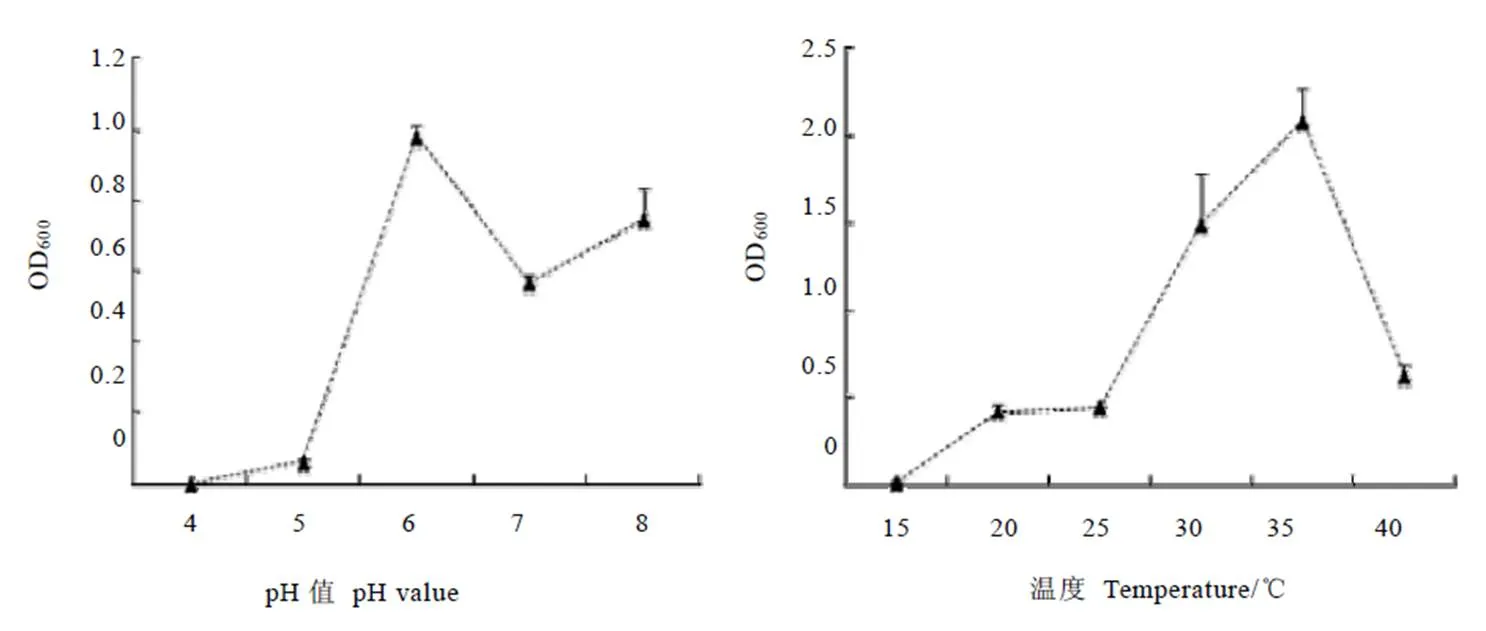
图6 不同pH 和温度中菌株的活性
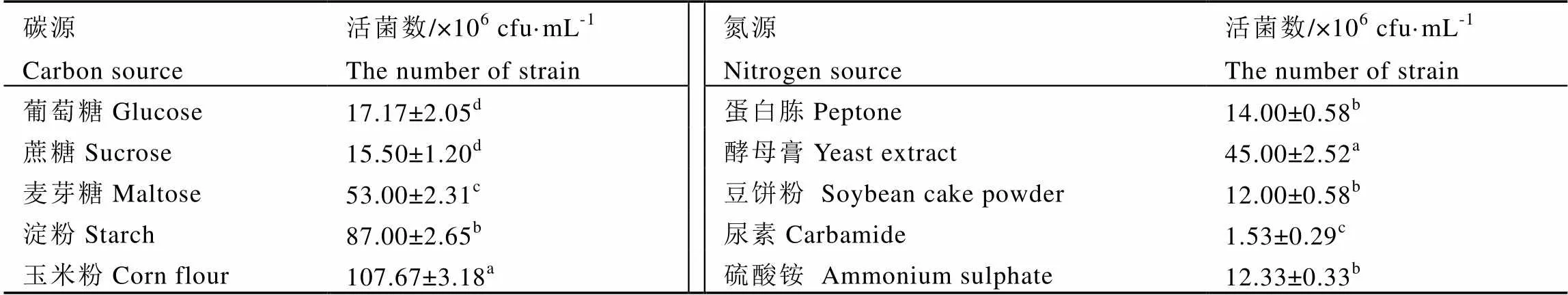
表3 单一碳源、氮源活菌数
注:不同小写字母表示差异达5%显著水平。
Note: Different letters mean significant at 5% level. mg·kg-1
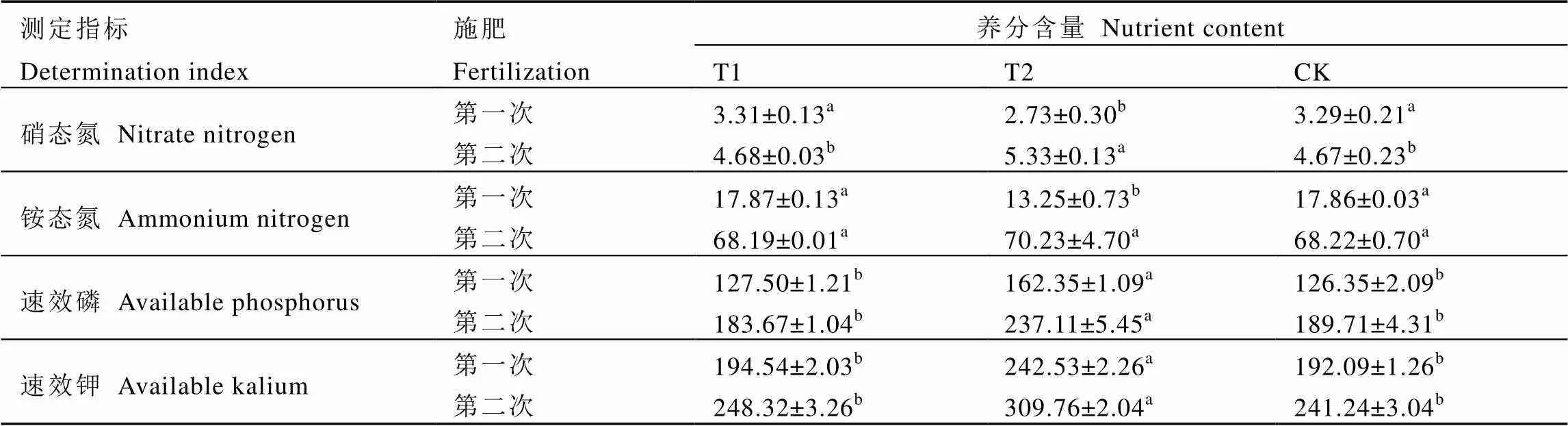
表4 不同施肥处理对土壤养分的影响
注:同行中不同小写字母表示差异达5%显著水平。
Note: Different letters mean significant at 5% level within the same line.

表5 不同施肥处理对茶树百芽重的影响
2.5.2 解钾菌剂对茶树百芽重的影响
从表5可以看出,第一次施肥后T2菌剂处理显著大于其它处理,增产率达到36.3%。从第二次施肥结果来看,百芽重均出现了一定程度的下降,但T2处理仍显著高于其它处理。综合分析来看,T2处理茶树百芽重增重显著,两次施肥效果相当,而T1处理与CK处理没有明显差异。可见,施用自制解钾菌剂能显著提高茶树百芽重,且效果稳定。
2.5.3 解钾菌剂对茶叶生化成分的影响
从表6可以看出,第一次施肥后,水浸出物含量以T2最高,水浸出物越多茶汤内含物越丰富。通过施用菌剂降低了茶叶中咖啡碱的含量,T2比单施有机肥降低8.99%。茶多酚含量不同处理间未表现出差别,而氨基酸则以T2最高。茶叶酚氨比值出现了差异,以T2最小。第二次施肥后,T2处理水浸出物含量略大于T1和CK,但没有差异。咖啡碱与氨基酸含量与第一次施肥相似,而茶多酚含量下降明显。两次施用空载体的处理与单施有机肥的处理均没有明显差异。综合两次施肥结果可知,解钾菌剂能显著增加鲜叶中氨基酸含量,降低酚氨比,使茶叶滋味更加鲜爽,有利于茶叶品质的提高。
3 讨论
山东土壤中富含钾硅酸盐矿物,该矿物只有在理化因素和微生物的作用下,通过分解逐步释放出钾,供植物生长利用。因此,筛选可高效降解钾的微生物对于提高土壤有效钾含量至关重要[19]。解钾菌作为一种有益功能菌,可将束缚态钾转化成有效钾供植物吸收利用[20]。本研究从茶园土壤中筛选出了高活性解钾菌株K2。经鉴定K2为枯草芽孢杆菌()。前人从水稻植株根际、菜园等处分离获得多株高效解钾菌株,亦多为假单胞菌属和芽孢杆菌属等属菌株[21-23],且孙海新[24]也发现茶园土壤中解钾细菌多为芽孢杆菌属,这与本试验结果一致。
不同解钾微生物的解钾能力存在较大差异。前人对微生物解钾机理研究发现,微生物可以通过酸溶、酶解、荚膜吸收等[25-27]方式进行解钾。本试验在对解钾细菌生长特性研究时发现,该菌株喜欢在偏酸性的环境中繁殖,同时随着解钾量的增大,发酵液的pH值降低幅度越大,这与燕红等[28]试验结果相似。这种现象的出现可能是该菌在繁殖过程中有酸性物质分泌[29-30],从而导致环境中pH值下降。对于引起pH值下降的原因以及菌株解钾机制将在后续的试验中进一步研究。
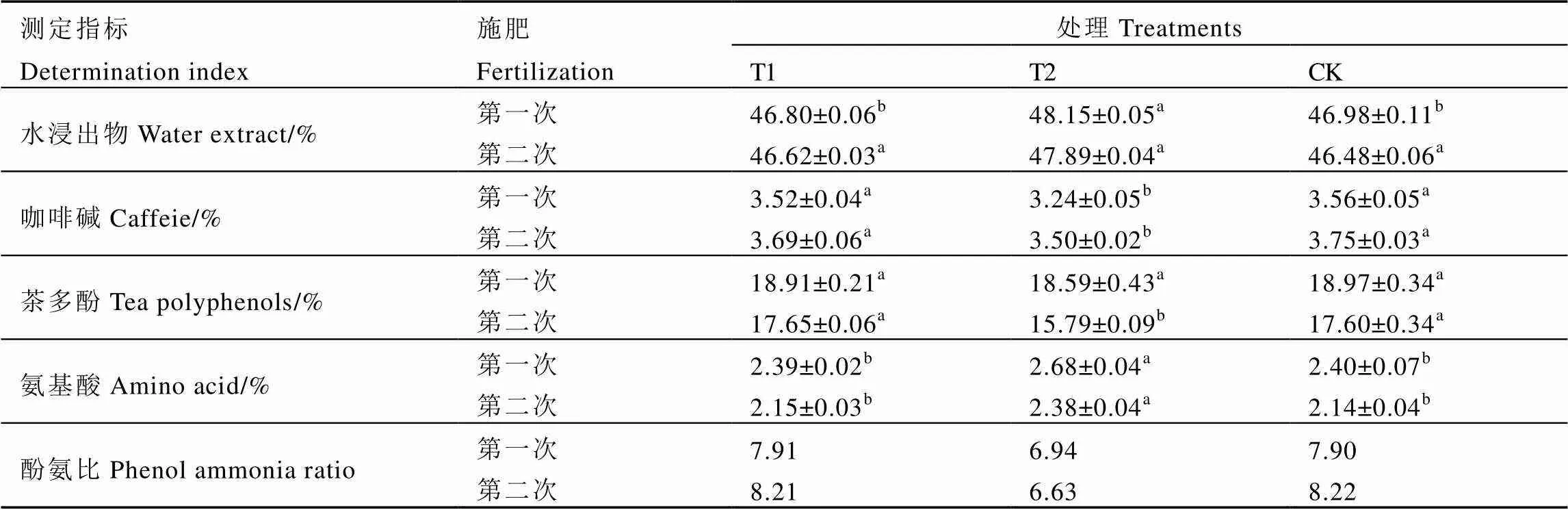
表6 不同施肥处理对茶叶品质的影响
注:同行中不同小写字母表示差异达5%显著水平。
Note: Different letters mean significant at 5% level within the same line.
此外,一些微生物除了具有解钾的功能外,还具有解磷、固氮等其它功能。燕红等[28]在发酵解钾菌株过程中出现了显著的溶磷特点,可溶性磷增加量达6.81 µg·mL-1。韩丽珍等[31]人从茶树根际土壤中筛选出GD-3和GD-12解钾菌,菌株除了具有解钾能力外,还具有解磷、产NH3、产HCN能力,可分泌嗜铁素及具有ACC脱氨酶活性。本试验在接种后也发现,土壤中不仅速效钾的含量有较大的提升,速效磷的含量也显著提高,可能该菌产生了同时具有溶钾和溶磷的酸性成分[28],从而促进了钾、磷含量的提高。
目前研究表明野生菌株在扩繁的过程中容易导致某些功能丧失和活力下降,降低微生物的功效。因此,本项目下一步将在菌株K2的基础上,采用紫外诱变技术对其进行改良,以提高菌株的活性和解钾能力,从而保证菌株功效的稳定性。
[1] 万广华, 李涛, 王国华. 山东省土壤钾素含量及分布研究[J]. 山东农业科学, 2000(3): 31-33.
[2] 刘钦普, 林振山, 周亮. 山东省化肥使用时空分异及潜在环境风险评价[J]. 农业工程学报, 2015, 31(7): 208-214.
[3] Huang P M, Wang M K, Chiu C Y. Soil mineral-organic matter-microbe interactions: impact on biogeochemical processes and biodiversity in soil [J]. Pedobiologia, 2005, 49(6): 609-635.
[4] 张爱民, 李乃康, 赵钢勇, 等. 土壤中解磷、解钾微生物研究进展[J]. 河北大学学报(自然科学版), 2015, 35(4): 442-448.
[5] 蒋宝贵.解磷解钾自生固氮菌的分离筛选及鉴定[J].华中农业大学学报, 2005, 24(1): 43-48.
[6] 饶正华, 林启美.解钾菌与解磷菌及固氮菌的相互作用[J].生态学杂志, 2002, 21(2): 71-73.
[7] 李新新, 高新新, 陈星, 等. 一株高效解钾菌的筛选、鉴定及发酵条件的优化[J].土壤学报, 2014, 51(2): 382-388.
[8] 阳洁, 江院, 王晓甜, 等. 几株高效溶磷解钾药用稻内生固氮菌的筛选与鉴定[J].农业生物技术学报, 2016, 24(2): 186-195.
[9] Basak BB, Biswas DR. Influence of potassium solubilizing microorganism (Bacillus mucilaginosus) and waste mica on potassium uptake dynamics by sudan grass (Sorghum vulgare Pers.) grown under two Alfisols [J]. Plant and Soil, 2009, 317: 235-255.
[10] Basak BB, Biswas DR. Co-inoculation of potassium solubilizing and nitrogen fixing bacteria on solubilization of waste mica and their effect on growth promotion and nutrient acquisition by a forage crop [J]. Biology and Fertility of Soils, 2010, 46: 641-648.
[11] 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002: 215.
[12] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J]. Nature, 1970, 227: 680-685.
[13] 韩晓阳, 李智, 张丽霞, 等. 茶园土壤高活性固氮菌的筛选鉴定及接种效果初步研究[J]. 茶叶科学, 2014, 34(5): 497-505.
[14] Tan Z Y, Kan F L, Peng G X, et al. Rhizobium yanglingense sp. nov., isolated from arid and semi-arid regions in China [J]. Int J Syst Evol Microbiol, 2001, 51: 909-914.
[15] Weisburgw G, Bams M, Elletier D A. 16sRibosomal DNA amplification for phylogenetic study [J]. J Bacterial, 1991, 173(2): 697-703.
[16] Martin Könneke, Anne E Bernhard, José R de la Torre, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon [J]. Nature, 2005, 437: 543-546.
[17] Buchanan R E, Gibbons N E. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984: 329-339.
[18] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 138-140.
[19] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[20] 麻瑞阳, 张爱民, 惠小双, 等. 高效解磷解钾菌NX-11菌株的分离筛选, 鉴定及最佳培养条件的确定[J]. 华北农学报, 2013, 28(2): 202-208.
[21] 肖胜. 不同种类解钾菌对烟叶化学成分及经济性状的影响[J]. 安徽农业科学, 2017, 45(3): 46-48.
[22] 顾杰, 孟丽媛, 孙乐妮, 等. 水稻根系固氮菌促生特性评价[J]. 安徽农业大学学报, 2012, 39(3): 426-429.
[23] 孙建光, 胡海燕, 刘君, 等. 农田环境中固氮菌的促生潜能与分布特点[J]. 中国农业科学, 2012, 45(8): 1532-1544.
[24] 孙海新. 茶树根际促生细菌的研究[D]. 山东: 山东农业大学, 2006.
[25] 梁成华, 魏丽萍, 罗磊. 土壤固钾与释钾机制研究进展. 地球科学进展[J]. 2002, 17(5): 679-684.
[26] 杨红武, 李帆, 唐春闺, 等. 溶磷解钾微生物在植烟土壤中的应用[J]. 湖南农业科学, 2014, 20: 31-32.
[27] 张爱民, 李乃康, 赵钢勇, 等. 土壤中解磷、解钾微生物研究进展[J]. 河北大学学报(自然科学版), 2015, 35(4): 442-448.
[28] 燕红, 于彩莲, 包鑫, 等. 高效解磷兼解钾活性菌株分离筛选的初步研究[J]. 扬州大学学报(农业与生命科学版), 2016, 37(1): 81-90.
[29] Ma Y, Prasad MN, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils [J]. Biotechnol Adv, 2011, 29(2): 248-258.
[30] Rajkumar M, Ae N, Prasad MN, et al. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction [J]. Trends Biotechnol, 2010, 28(3): 142-149.
[31] 韩丽珍, 邓兆辉, 朱春艳, 等. 茶树根际促生菌的筛选与促生特性的研究[J]. 山地农业生物学报, 2016, 35(1): 51-56.
Screening, Identification and Fertilizer Efficiency of Potassium Bacterium from the Soils of Tea Garden in Shandong
HAN Xiaoyang1,2, ZHOU Bo3, DONG Yuhui1,2, ZHANG Lixia1,2*,HOU Jian4, XIANG Qinzeng1,2, HUANG Xiaoqin1,2*
1. College of Horticulture Science and Engineering, Shandong Agriculture University, Tai'an 271018, China; 2. State key Laboratory of Crop Biology, Tai'an 271018, China; 3. Tai'an Agricultural Bureau, Tai'an 271018, China; 4. Tea Industry Administration Office of Lanshan, Rizhao 276800, China
The potassium bacterium suitable for soil environment in Shandong tea garden was screened to improve the transformation efficiency of soil potassium.By the experimental procedure of enrichment culture and microbial purification, 9 potassium bacterium strains were obtained from the soil of tea garden in Shandong Province. According to the activity comparison and taxonomy of strains, a strain with the highest activity was selected. The strain K2 was identified as. Meanwhile, the effects of growth environment of the strains were measured. The results showed that the optimum pH and temperature for K2 were 6.0 and 35℃. It was suitable for K2 to ferment with maltose, starch and corn flour as the carbon source, and with yeast extract as the nitrogen source. After applying the bacteria agent, the contents of available potassium and phosphorus in tea garden soil increased by 28.40% and 28.49% respectively. Meanwhile the tea yield increased by 36.30%. The amino acid contents in tea were also significantly increased, and the polyphenols/amino acids decreased, which benefit tea quality.The K2 may be a high efficient potassium bacterium in tea garden soil, which can be used as a reference for further research on special microbial inoculum in tea garden.
tea garden in Shandong, potassium bacterium,, fertilizer efficiency
S571.1;S154.3
A
1000-369X(2018)01-078-09
2017-06-05
2017-08-01
山东省“双一流”奖补资金,泰安市科技发展专项(201340629)、泰安市农业产业化扶持项目(02032909)、泰安市科技发展计划项目(201640576)
韩晓阳,男,讲师,主要从事茶树生理与生态方面的研究。*通讯作者zlx_sdau@163.com,31532504@qq.com

