血浆前蛋白转化酶枯草溶菌素9与钙化性主动脉瓣疾病的关联机制①
王英歌 梁景岩 陈 露 潘 阳 张雨蒙 何凯明
(扬州大学医学院,扬州 225001)
钙化性主动脉瓣疾病(Calcific aortic valve disease,CAVD)包括病变早期的主动脉瓣硬化和晚期的主动脉瓣狭窄,是心脏科的常见病,该病往往最终导致主动脉瓣钙化的病理过程[1,2]。CAVD和冠状动脉粥样硬化有相似的危险因素,包括年龄、吸烟、高血压和高脂血症[3];而CAVD病变的早期瓣膜组织病理改变在很多方面也与冠状动脉粥样硬化病变类似。然而CAVD的发生机制仍不十分明确。已经证实的是脂质滞留、脂质氧化和脂蛋白(a){LP(a)}参与了CAVD的发生过程[3-5]。前蛋白转化酶枯草溶菌素9(Proprotein convertase subtilisin kexin type 9,PCSK9)是否参与CAVD的发生过程尚不得而知。本研究拟探讨血浆PCSK9水平与CAVD发生的相关性。
1 对象与方法
1.1研究对象 通过经胸心脏彩超筛选2015年3月~2016年9月本院CAVD患者120例及阴性对照组患者40例。入选标准:年龄大于60岁,曾进行心脏彩超和心脏双源CT检查(2种检查间隔不超过2个月)。排除标准:1月内使用过他汀类药物,明确诊断的冠状动脉粥样硬化性心脏病、先天性二叶主动脉瓣疾病、严重的二尖瓣狭窄或钙化、严重的二尖瓣或主动脉瓣返流、风湿性心脏病、心力衰竭、现患感染性疾病、中重度肾功能不全、现患或慢性肝脏疾病、酗酒或嗜药史。本研究遵守赫尔辛基宣言并已通过我院伦理委员会伦理审查。
1.2方法
1.2.1双源CT评价主动脉瓣 所有患者通过CT检查进一步对主动脉瓣钙化程度进行评估。CT检查使用西门子公司双源CT扫描机,钙化扫描采用前瞻性心电门控触发技术。扫描参数:采用2×32×0.6层厚、旋转时间330 ms、管电压100~120 kV、管电流320 mA进行扫描。在图像后处理工作站对所有图像进行重建,层厚0.5 mm,重建间距0.3 mm。由2名有经验的CT医师对结果进行判读。主动脉瓣钙化定义为钙化病变位于主动脉瓣瓣叶或累及主动脉根部,表现为斑块在连续3个以上像素的密度大于130 HUs。首先,通过CT定量评分系统对主动脉瓣钙化进行分组:AVC 1级,主动脉瓣无钙化;AVC 2级,主动脉瓣轻度钙化,表现为小的孤立的点状钙化灶;AVC 3级,主动脉瓣中度钙化,表现为多个大的钙化点或钙化灶;AVC 4级,严重钙化,表现为所有瓣叶弥漫性钙化[6]。其次利用钙化积分分析软件对瓣膜钙化进行分析,计算钙化积分分值。每个病变的钙化积分为钙化体积乘以最大灰度值[7],所有病变的钙化积分之和记为钙化总积分。
1.2.2生化指标检测 根据本课题组前期研究和相关研究的资料查询,确定相关性分析时的生化指标。空腹采血,置于EDTA管中,3 000 r/min离心15 min,取血浆冻存于-80℃冰箱中备用。总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)、载脂蛋白A1(Apo A1)及载脂蛋白B(Apo B)、LP(a)和高敏C反应蛋白(hsCRP)均使用罗氏c701生化分析仪测定。通过酶联免疫吸附测定(ELISA)的方法检测血浆PCSK9水平。
1.3统计学处理 应用SPSS20.0统计软件;计量资料应用t检验或者方差分析,计数资料应用χ2检验。对于不符合正态分布的TG、Apo A1、LP(a)、hsCRP和PCSK9行对数转换,相关性采用Pearson法进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1患者的一般情况和实验室指标的比较 所有患者的平均年龄为(69.1±6.4)岁,男性94例(58.8%),女性66例(41.2%)。52.5%患者合并高血压,26.3%合并糖尿病,40.0%吸烟。与对照组(AVC1级)比较,AVC 2~4级在年龄、男性比例、吸烟、高血压、糖尿病方面组间差异无统计学意义,4组患者药物的使用亦无差别(P>0.05)。4组患者左室射血分数(LVEF)和左室舒张末期内径(LVDD)差异亦无统计学意义,4组患者主动脉瓣钙化积分为(0.048.6±14.5)、(114.5±37.7)及(427.8±210.3),差异有统计学意义(P<0.001)。4组患者LDL-C、Apo B和Lp(a)水平差异有统计学意义(P<0.05),AVC 2~4级患者明显高于AVC1级,而TG、HDL-C、Apo A1和反应炎症的指标hsCRP组间差异无统计学意义。组间比较AVC 3级和AVC 4级的TC水平高于AVC 1级组,差异均有统计学意义(P<0.05)。同时,AVC 2~4级组患者血浆PCSK9水平高于AVC1级组,差异有统计学意义(P<0.05),见表1。
2.3实验室指标与主动脉瓣钙化积分的相关性 将所有人群的主动脉瓣钙化积分和生化指标进行相关性分析,发现其与TC (r=0.248,P=0.026),LDL-C (r=0.222,P=0.048)、Lp(a)(r=0.276,P=0.013)、PCSK9(r=0.309,P=0.005)、Apo A1(r=0.245,P=0.012)、Apo B(r=0.212,P=0.019)均存在明显相关性。但是对 CAVD 患者的分析发现,主动脉瓣钙化积分与以上指标均无相关性。另外hsCRP与主动脉瓣钙化积分之间无相关性。PCSK9与TC、LDL、 LP(a)、 Apo A1、Apo B呈正相关,但与hsCRP无相关性,见表2。
表14组患者基线情况对比
Tab.1Baselinecomparisonof4groupsofpatients
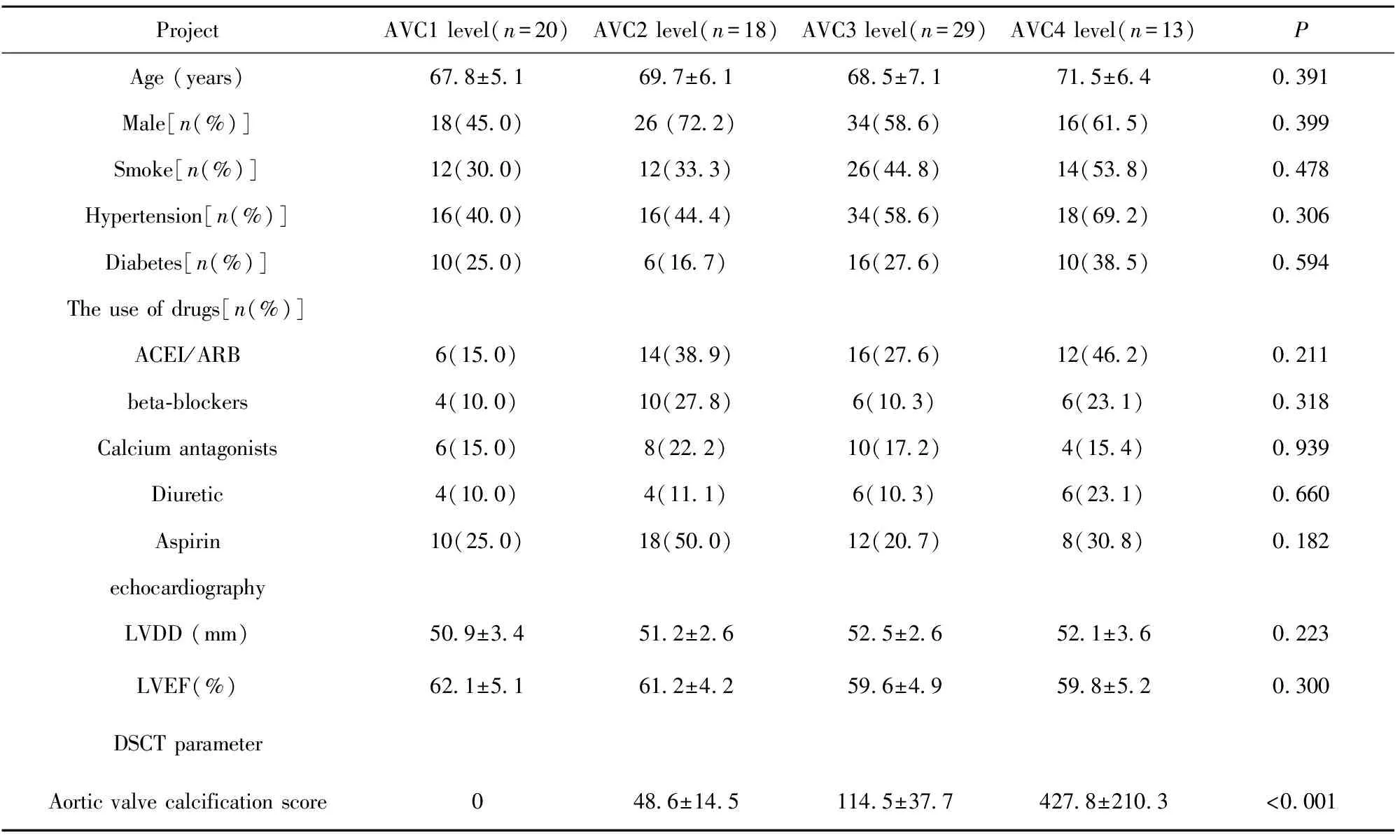
ProjectAVC1level(n=20)AVC2level(n=18)AVC3level(n=29)AVC4level(n=13)PAge(years)67 8±5 169 7±6 168 5±7 171 5±6 40 391Male[n(%)]18(45 0)26(72 2)34(58 6)16(61 5)0 399Smoke[n(%)]12(30 0)12(33 3)26(44 8)14(53 8)0 478Hypertension[n(%)]16(40 0)16(44 4)34(58 6)18(69 2)0 306Diabetes[n(%)]10(25 0)6(16 7)16(27 6)10(38 5)0 594Theuseofdrugs[n(%)]ACEI/ARB6(15 0)14(38 9)16(27 6)12(46 2)0 211beta⁃blockers4(10 0)10(27 8)6(10 3)6(23 1)0 318Calciumantagonists6(15 0)8(22 2)10(17 2)4(15 4)0 939Diuretic4(10 0)4(11 1)6(10 3)6(23 1)0 660Aspirin10(25 0)18(50 0)12(20 7)8(30 8)0 182echocardiographyLVDD(mm)50 9±3 451 2±2 652 5±2 652 1±3 60 223LVEF(%)62 1±5 161 2±4 259 6±4 959 8±5 20 300DSCTparameterAorticvalvecalcificationscore048 6±14 5114 5±37 7427 8±210 3<0 001
Note:ACEI/ARB.Angiotensin converting enzyme inhibitor/angiotensin receptor antagonist;LVDD.Left ventricular end diastolic diameter;LVEF.Left ventricular ejection fraction;DSCT.Dual source CT.
表2实验室指标与主动脉瓣钙化积分的相关性(Pearson相关分析)
Tab.2Correlationbetweenlaboratoryindexesandaorticvalvecalcificationscore(Pearsoncorrelationanalysis)

ProjectAllresearchpopulation(n=160)CAVDpatients(n=120)TC0 2481)0 166LDL⁃C0 2221)0 111Lp(a)0 2761)0 210PCSK90 3092)0 235hsCRP0 028-0 034ApoA10 2450 153ApoB0 2120 129
Note:Lp (a) and PCSK9 were analyzed by logarithmic transfor-mation.TC.Total cholesterol;LDL-C.Low density lipoprotein cholesterol;Lp(a).Lipoprotein(a);PCSK9.Proprotein convertase subtilisin/Kexin 9;hs-CRP.High sensitive C reactive protein;Apo A1.Apolipoprotein-A1;Apo B.Apolipoprotein-B,1)P<0.05,2)P<0.01.
表3PCSK9与TC,LDL-C,Lp(a)和hsCRP相关性分析(Pearson相关分析)
Tab.3CorrelationanalysisbetweenPCSK9andTC,LDL-C,Lp(a)andhsCRP(Pearsoncorrelationanalysis)

ProjectrPTC0 535<0 001LDL0 470<0 001Lp(a)0 489<0 001hsCRP-0 106>0 05ApoA10 392<0 001ApoB0 431<0 001
Note:Lp (a) and PCSK9 were analyzed by logarithmic transform-ation.TC.Total cholesterol;LDL-C.Low density lipoprotein cholesterol;Lp(a).Lipoprotein(a);PCSK9.Proprotein convertase subtilisin/Kexin 9;hs-CRP.High sensitive C reactive protein;Apo A1.Apolipoprotein-A1;Apo B.Apolipoprotein-B.
2.4PCSK9 与生化指标相关性分析 PCSK9与TC、LDL、LP(a)、Apo A1、Apo B呈正相关,然而PCSK9与hsCRP无相关性,见表3。
3 讨论
CAVD包括早期的以瓣膜增厚、纤维化和微钙化为主要表现的主动脉瓣硬化和晚期的主动脉瓣狭窄[8]。CAVD的早期病理过程包括脂质浸润、炎症反应等,与冠状动脉的粥样硬化过程存在很多相似点[8]。但是CAVD的发病机理、病理过程和药物干预的时机仍不明确。
PCSK9参加降解LDL受体,在LDL-C代谢中发挥关键作用[9]。PCSK9属于系统分泌蛋白,可以结合LDL受体并将其运至溶酶体内进行降解。PCSK9可以在人类的动脉粥样硬化斑块中检测到,提示PCSK9可能同脂质、氧化脂质一样参与了动脉粥样硬化的进展[9]。平滑肌细胞和巨噬细胞均在动脉粥样硬化病变的进展中起重要作用。研究表明,平滑肌细胞的PCSK9有活性,其可以降低巨噬细胞上LDL受体数量,该实验结果提示PCSK9在泡沫细胞的形成及动脉粥样硬化的进展中发挥直接作用[10]。另外,动物试验发现过量表达PCSK9的小鼠在高胆固醇饮食处理下容易会罹患主动脉瓣钙化[11]。因此,研究者推测PCSK9 参与主动脉瓣的钙化启动过程。
本实验结果揭示,血浆LDL-C、TC和LP(a)在主动脉瓣钙化患者中明显增高,与既往多数研究的结果一致[12,13]。另外,LP(a)水平与PCSK9水平存在正相关。有研究证实PCSK9 通过LDL受体调节LP(a)的分解代谢。PCSK9可以明显降低肝脏HepG2细胞和原代人成纤维细胞的LP(a)的内化[14]。上调HepG2细胞的LDL受体的表达可以明显增加LP(a)的内化,而给予LDL受体单克隆抗体治疗则可显著降低LP(a)的内化。LDL受体在LP(a)的分解代谢中起作用,而PCSK9则对这一过程进行调节[14]。GWAS研究(全基因组关联研究)发现LP(a)位点的单核苷酸多态性与CAVD的发生存在相关性[15]。基于以上理论,具有降低LP(a)的药物治疗有望成为未来CAVD药物治疗的基础。值得关注的是PCSK9单克隆抗体除显著降低LDL胆固醇外,还可以降低LP(a)20%~40%[16]。
血脂与主动脉瓣钙化之间的相关性以及主动脉瓣钙化病变早期与动脉粥样硬化之间的相似处导致以下假设:他汀有可能像改善动脉粥样硬化的预后一样使主动脉瓣钙化患者获益。早期的非随机临床试验和高胆固醇血症的动物试验的确支持这一理论[17,18]。然而随后针对中重度主动脉瓣狭窄患者的3项独立的随机对照临床试验却与上述理论相悖,他汀没能改善这两名患者的临床情况和预后。矛盾的结果让我们重新审视CAVD的病理生理过程。尽管脂质沉积和炎症可能在CAVD的发生早期起重要作用,然而后期的钙化、矿化阶段是以钙沉积和成骨细胞形成为特点的循环过程。一旦疾病进入至进展期,降脂药物可能无效。在CAVD的早期,发生瓣膜僵硬和造成血流梗阻之前,可能是降脂药物潜在发挥治疗作用的窗口和时机。
在与冠状动脉粥样硬化性心脏病患者观察到的结果不同是,血浆PCSK9水平与CAVD患者主动脉瓣钙化积分之间无相关性。PCSK9 水平增高除与冠状动脉粥样硬化性心脏病发病风险有所增高外,还与Gensini 评分有一定相关性[19,20]。本研究推测PCSK9与CAVD的严重程度无关是因为PCSK9水平仅仅在CAVD发生的初始阶段起作用。
综上所述,CAVD患者PCSK9水平明显高于对照组,PCSK9与CAVD的发生存在相关性,而与主动脉瓣钙化积分之间无相关性。PCSK9可能通过影响血脂代谢参与CAVD的发生和发展。
[1] Osnabrugge RL,Mylotte D,Head SJ,etal.Aortic stenosis in the elderly:disease prevalence and number of candidates for transcatheter aortic valve replacement:a meta-analysis and modeling study[J].J Am Coll Cardiol,2013,62(11):1002-1012.
[2] Rajamannan NM,Evans FJ,Aikawa E,etal.Calcific aortic valve disease:not simply a degenerative process.A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group.Executive summary:calcific aortic valve disease-2011 update[J].Circulation,2011,124(16):1783-1791.
[3] Thanassoulis G,Massaro JM,Cury R,etal.Associations of long-term and early adult atherosclerosis risk factors with aortic and mitral valve calcium[J].J Am Coll Cardiol,2010,55(22):2491-2498.
[4] McKenney JM.Understanding PCSK9 and anti-PCSK9 therapies[J].J Clin Lipidol,2015,9(2):170-186.
[5] Ridker PM,Amarenco P,Brunell R,etal.Evaluating bococizu-mab,a monoclonal antibody to PCSK9,on lipid levels and clinical events in broad patient groups with and without prior cardiovascular events:Rationale and design of the studies of PCSK9 Inhibition and the reduction of vascular events (SPIRE) lipid lowering and SPIRE cardiovascular outcomes trials[J].Am Heart J,2016,178(8):135-144.
[6] Tops LF,Wood DA,Delgado V,etal.Noninvasive evaluation of the aortic root with multislice computed tomography implications for transcatheter aortic valve replacement[J].JACC Cardiovasc Imaging,2008,1(3):321-330.
[7] Agatston AS,Janowitz WR,Hildner FJ,etal.Quantification of coronary artery calcium using ultrafast computed tomography[J].J Am Coll Cardiol,1990,15(4):827-832.
[8] Mathieu P,Boulanger MC.Basic mechanisms of calcific aortic valve disease[J].Can J Cardiol,2014,30(9):982-993.
[9] Li S,Jun Li JJ.PCSK9:A key factor modulating atherosclerosis[J].J Atheroscler Thromb,2015,22(3):221-230.
[10] Ferri N,Tibolla G,Pirillo A,etal.Proprotein convertase subtilisin kexin type 9 (PCSK9) secreted by cultured smooth muscle cells reduces macrophages LDLR levels[J].Atherosclerosis,2012,220(2):381-386.
[11] Fantus D,Awan Z,Seidah NG,etal.Aortic calcification:Novel insights from familial hypercholesterolemia and potential role for the low-density lipoprotein receptor[J].Atherosclerosis,2013,226(1):9-15.
[12] Parisi V,Leosco D,Ferro G,etal.The lipid theory in the pathogenesis of calcific aortic stenosis[J].Nutr Metab Cardiovasc Dis,2015,25(6):519-925.
[13] Smith JG,Luk K,Schulz CA,etal.Association of low-density lipoprotein cholesterol-related genetic variants with aortic valve calcium and incident aortic stenosis[J].JAMA,2014,312(17):1764-1771.
[14] Romagnuolo R,Scipione CA,Boffa MB,etal.Lipoprotein(a) catabolism is regulated by proprotein convertase subtilisin/kexin type 9 through the low density lipoprotein receptor[J].J Biol Chem,2015,290(18):11649-11662.
[15] Thanassoulis G,Campbell CY,Owens DS,etal.Genetic associations with valvular calcification and aortic stenosis[J].N Engl J Med,2013,368(6):503-512.
[16] Desai NR,Kohli P,Giugliano RP,etal.AMG145,a monoclonal antibody against proprotein convertase subtilisin/kexin type 9,significantly reduces lipoprotein(a) in hypercholesterolemic patients receiving statin therapy:an analysis from the LDL-C assessment with proprotein convertase subtilisin kexin type 9 monoclonal antibody inhibition combined with statin therapy (LAPLACE)-thrombolysis in myocardial infarction (TIMI) 57 trial[J].Circulation,2013,128(9):962-969.
[17] Moura LM,Ramos SF,Zamorano JL,etal.Rosuvastatin affecting aortic valve endothelium to slow the progression of aortic stenosis[J].J Am Coll Cardiol,2007,49(5):554-561.
[18] Weiss RM,Ohashi M,Miller JD,etal.Calcific aortic valve stenosis in old hypercholesterolemic mice[J].Circulation,2006,114(19):2065-2069.
[19] Wang S,Cheng ZY,Zhao ZN,etal.Correlation of serum PCSK9 in CHD patients with the severity of coronary arterial lesions[J].Eur Rev Med Pharmacol Sci,2016,20(6):1135-1139.
[20] Li S,Guo YL,Zhao X,etal.Novel and traditional lipid-related biomarkers and their combinations in predicting coronary severity[J].Sci Rep,2017,7(1):360.