血浆miRNA-200b及miRNA-21在上皮性卵巢癌中的表达及其临床意义①
唐 梅 林丽慧 林 元 薛万兴 苏红娥
(海南西部中心医院妇产科,那大 571799)
卵巢癌是女性生殖系统常见的恶性肿瘤,具有发病隐匿、病情进展迅速、病死率高和5年生存率低等特点,已成为严重威胁女性生命健康的恶性肿瘤[1]。目前,仍没有特异性的生物学指标可以用于卵巢癌的早期诊断、指导治疗及预后评估。近期的研究发现,微小核糖核酸(microRNA,miRNA)在肿瘤发生、发展及转移中起着重要的作用,其中miRNA-21和miRNA-200b与多种恶性肿瘤的发生有关,可能在肿瘤发生过程中发挥癌基因的作用[2,3]。本研究通过检测血浆miRNA-200b及miRNA-21在上皮性卵巢癌(Epithelial ovarian cancer,EOC)患者中的表达情况,分析其表达与EOC临床病理特征间的关系,旨在为EOC的早期诊断及靶向治疗提供依据。
1 资料与方法
1.1研究对象 选取2012年1月至2016年12月海南西部中心医院收治行手术治疗的上皮性卵巢癌患者162例,年龄28~79岁,平均(54.27±11.83)岁。纳入标准:①符合国际妇产科联合会(FIGO)分类标准和WHO分级标准,且经病理确诊为上皮性卵巢癌并适合手术治疗者;②术前均未接受放射治疗和化疗者;③能配合本次研究及病历资料完整者。另取同期与卵巢癌患者年龄匹配的上皮性卵巢良性肿瘤患者120例(58例良性浆液性囊腺瘤、32例黏液性囊腺瘤、21例泡膜细胞瘤、9例成熟型畸胎瘤)作为良性组和正常健康女性108例作为对照组。所有研究对象均于清晨空腹抽静脉血5 ml,离心分离血浆后保存于-80℃冰箱待检。
1.2方法
1.2.1主要试剂和仪器 RNA提取试剂盒购自德国Qiagen公司,在ABI 7500型荧光定量PCR仪上进行实时荧光定量聚合酶链反应(RT-PCR)。
1.2.2miRNA的提取 取300 μl血浆样本,加入1 ml总miRNA提取液,按照血液总miRNA快速提取试剂盒(miRNeasy血浆提取试剂盒)说明书从血浆中提取总RNA。
1.2.3miRNA逆转录及RT-PCR检测 以U6为实验内参,miRNA逆转录反应体系:5 μl RNA模板,3 μl U6及miRNA特异性茎环引物,0.15 μl 100 mmol/L dNTPs(with dTTP),1.00 μl逆转录酶(50 U/μl),1.50 μl 10×反转录缓冲液,0.19 μl RNase抑制剂(20 U/μl),4.16 μl无菌三蒸水。反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min,4℃保存,进行逆转录反应。以U6为实验内参,反应体系为20 μl:1.00 μl TaqMan Small RNA Assay(20×)溶液,10.00 μl TaqMan®Universal PCR Master MixⅡ(2×)溶液,1.33 μl 反转录产物cDNA,7.67 μl DEPC水。扩增条件为:95℃10 min 1个循环,95℃15 s、60℃ 60 s进行40个循环,实验重复3次。每个反应体系中荧光信号达到所设定的阈值的经历的循环数即为Ct值,以U6为内参照,采用2-ΔΔCt法计算microRNA的相对表达水平,其中△Ct=Ct目的基因-CtU6。
1.2.4血清CA125检测 使用全自动电化学发光免疫分析仪及配套试剂盒检测血清CA125水平,操作过程严格按照试剂盒说明书进行。
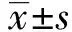
2 结果
2.1EOC患者基本分布特征 162例EOC患者年龄≥50岁的占62.3%(101/162);手术-病理分期标准:Ⅰ期23例,Ⅱ期35例,Ⅲ期84例,Ⅳ期20例;病理类型:浆液性癌116例,透明细胞癌20例,黏液性癌14例,子宫内膜样癌8例,混合型细胞癌3例;病理分级:高分化癌(G1)9例,中分化癌(G2)30例,低分化癌(G3)123例;淋巴结转移状态:有淋巴结转移70例,无淋巴结转移92例;术后有残余肿瘤68例,无残余肿瘤94例。
2.2各组血浆miRNA-200b、miRNA-21及CA125表达水平比较 EOC组血浆miRNA-200b、miRNA-21及CA125表达水平均明显高于良性组和对照组,差异有统计学意义(P<0.01);而良性组与对照组血浆miRNA-200b、miRNA-21及CA125表达水平比较,差异无统计学意义(P>0.05)。见表1。
2.3EOC患者血浆miRNA-200b及miRNA-21表达与临床病理特征的关系 随着EOC临床分期的进展,miRNA-200b及miRNA-21表达水平逐渐升高,Ⅲ~Ⅳ期EOC患者中两者的表达水平明显高于Ⅰ~Ⅱ期,差异有统计学意义(P<0.01)。血浆miRNA-200b及miRNA-21表达水平与淋巴结转移及CA125水平也相关(P<0.05),而与年龄、绝经状态、病理类型、病理分级及术后有残余肿瘤无关(P>0.05)。见表2。
2.4血浆miRNA-200b、miRNA-21及CA125对EOC的诊断价值 血浆miRNA-200b、miRNA-21、CA125及三项联合诊断EOC的曲线下面积(AUC)及95%CI分别为0.896(0.834~0.958)、0.792(0.731~0.847)、0.908(0.841~0.973)、0.947(0.883~0.995),与对照组(AUC=0.5)比较,差异均有统计学意义(P<0.01)。miRNA-200b、miRNA-21及CA125诊断EOC的最佳截值分别为2.08、1.46、52.84U/ml。三项联合诊断EOC的敏感度和特异度较好,分别为97.2%和78.3%。见图1和表3。
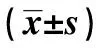

GroupsnmiRNA⁃200b(2-ΔΔCt)miRNA⁃21(2-ΔΔCt)CA125(U/ml)Controlgroup1081 15±0 341 04±0 2821 53±9 45Benigngroup1201 26±0 371 18±0 3226 27±11 36EOCgroup1623 52±1 031)2)2 32±0 451)2) 78 64±30 571)2)F15 1868 42910 619P<0 001<0 001<0 001
Note:Compared with the control group,1)P<0.01;compared with the benign group,2)P<0.01.
表2EOC患者血浆miRNA-200b及miRNA-21表达与临床病理特征的关系
Tab.2RelationshipbetweenexpressionofplasmamiRNA-200bandmiRNA-21andclinicopathologicalfeaturesinpatientswithEOC

GroupsnmiRNA⁃200b(2-ΔΔCt)PmiRNA⁃21(2-ΔΔCt)PAge(year)0 5840 627<50613 46±0 952 27±0 42≥501013 63±1 122 42±0 63Menopause0 3630 416Yes1063 34±0 852 14±0 42No563 75±1 162 53±0 68Pathologicalstaging0 0270 034Ⅰ-Ⅱstage581 96±0 641 41±0 36Ⅲ-Ⅳstage1045 18±1 273 37±0 84Pathologicaltype0 6580 742Serouscarcinoma1163 68±1 072 50±0 48Clearcellcarcinoma203 56±1 032 42±0 46Mucinousadenocarcinoma143 42±0 932 28±0 43Endometrioidcarcinoma83 38±0 872 25±0 41Mixedcellcarcinoma33 64±1 052 53±0 56Pathologicalgrading0 5170 603G193 60±1 042 44±0 46G2303 44±0 922 25±0 39G31233 58±1 022 37±0 42Residualtumorsaftertheoperation0 1420 254Yes683 18±0 742 07±0 38No943 91±1 182 68±0 71Lymphnodemetastasis0 0060 013Yes706 28±1 314 16±1 05No921 36±0 421 47±0 38CA125(U/ml)0 0150 022<50341 92±0 601 37±0 34≥501285 26±1 283 46±0 85
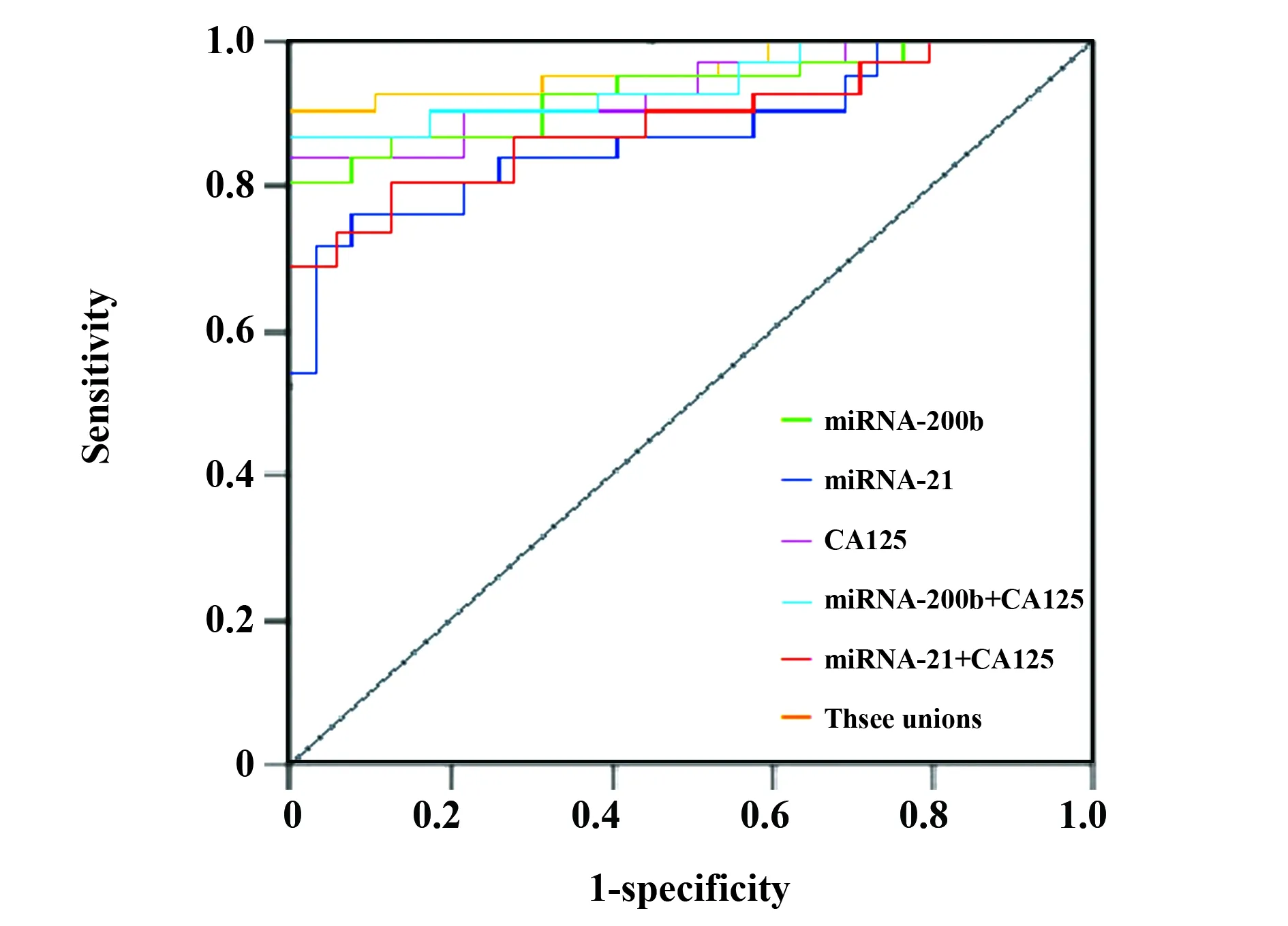
图1 血浆miRNA-200b、miRNA-21及CA125诊断EOC的ROC曲线Fig.1 ROC curve of plasma miRNA-200b,miRNA-21 and CA125 in diagnosis of EOC
2.5多元Logistic回归模型分析血浆miRNA-200b及miRNA-21与EOC的关系 把EOC组与对照组作为二分变量,以miRNA-200b、miRNA-21及CA125作为自变量,应用多元Logistic回归模型对两组数据进行分析。结果显示,血浆miRNA-200b、miRNA-21及CA125水平升高是EOC发生的独立危险因素[OR(95%CI)=2.518(1.563~3.547),OR(95%CI)=1.724(1.103~2.528),OR(95%CI)=2.316(1.347~3.419)]。见表4。
2.6EOC患者血浆miRNA-200b与miRNA-21、CA125的相关性 Pearson相关分析显示,血浆miRNA-200b与miRNA-21呈正相关(r=0.516,P<0.01);血浆miRNA-200b与CA125呈正相关(r=0.702,P<0.01);血浆miRNA-21与CA125呈正相关(r=0.604,P<0.01)。见图2。
表3血浆miRNA-200b、miRNA-21及CA125对EOC的诊断价值
Tab.3DiagnosticvalueofplasmamiRNA-200b,miRNA-21andCA125inEOC

ItemOptimumcut⁃offStandarderrorAUC(95%CI)PSensitivity(%)Specificity(%)Positivepredictivevalue(%)Negativepredictivevalue(%)miRNA⁃200b2 080 0370 896(0 834-0 958)<0 00187 580 484 283 6miRNA⁃211 460 0520 792(0 731-0 847)<0 00184 270 573 881 5CA12552 84U/ml0 0350 908(0 841-0 973)<0 00191 674 878 088 6miRNA⁃200b+CA125-0 0310 916(0 852-0 981)<0 00194 276 379 590 8miRNA⁃21+CA125-0 0460 841(0 778-0 893)<0 00185 775 279 380 6Threeunions-0 0280 947(0 883-0 995)<0 00197 278 382 692 7
表4多元Logistic回归模型分析血浆miRNA-200b及miRNA-21与EOC的关系
Tab.4MultivariateLogisticregressionmodelwasusedtoanalyzerelationshipbetweenplasmamiRNA-200bandmiRNA-21andEOC

FactorβSE(β)WaldOR95%CIPmiRNA⁃200b0 8140 2757 3842 5181 563-3 547<0 001miRNA⁃210 4820 1735 1461 7241 103-2 5280 018CA1250 6730 2386 2172 3161 347-3 4190 006

图2 miRNA-200b与miRNA-21、CA125的相关性Fig.2 Correlation between miRNA-200b and miRNA-21 and CA125
3 讨论
微小核糖核酸(miRNA)是一类短的内源性非编码单链RNA,在卵巢生理病理过程中发挥着重要的调控作用,其表达的缺失或过表达会显著影响卵巢的生理功能,有望成为治疗卵巢癌患者的重要靶点[4]。已有研究证实,miRNA在EOC中异常表达,与EOC的发生、发展、转移及预后密切相关,可作为EOC早期诊断和预后判断的新型标记物[5]。近年来研究发现,血浆miRNA-200b及miRNA-21在多种恶性肿瘤中异常表达,且不同恶性肿瘤组织miRNA-200b及miRNA-21的表达谱不同,是诊断恶性肿瘤患者的潜在生物学指标[6,7]。然而,血浆miRNA-200b及miRNA-21能否作为EOC早期诊断的分子标志物,目前尚无定论。
本研究结果显示,EOC组血浆miRNA-200b、miRNA-21及CA125表达水平均明显高于良性组和对照组,而良性组与对照组无显著差异。在EOC患者临床病理分期中,Ⅲ~Ⅳ期患者血浆miRNA-200b及miRNA-21的表达水平明显高于Ⅰ~Ⅱ期。说明血浆miRNA-200b、miRNA-21在EOC患者中异常表达,可能通过发挥癌基因的作用来调节EOC的发生发展过程。国外学者从多个角度研究发现,miRNA-200b可作为一种更强的调节因子以诱导上皮细胞的分化和上皮向基质状态转变,进而参与EOC的发生发展[8]。Hu等[9]通过对55例晚期卵巢癌的研究发现,miRNA-200b与卵巢癌的复发及生存率有关,在卵巢癌的发生发展中起着重要的作用。另有研究表明,miRNA表达水平在EOC组织中明显降低,可抑制卵巢癌细胞增殖,并抑制细胞周期相关蛋白的表达,在EOC发生中可能存在调控关系[10]。此外,进一步分析血浆miRNA-200b及miRNA-21表达与EOC临床病理特征的关系,发现两者均与淋巴结转移有关,提示两者在肿瘤预测方面有一定的作用,分其原因可能是存在淋巴结转移的患者肿瘤负荷往往较大,肿瘤组织可释放更多的具有原癌基因作用的miRNA进入血液,同时可抑制机体原有的具有抑癌作用的miRNA水平表达,进而导致机体miRNA表达水平异常升高。Zuberi等[11]研究也显示,miRNA-200b表达水平与肿瘤的恶性进展有关,是预测EOC患者的预后及生存的可靠标记物。
应用ROC曲线分析,结果显示血浆miRNA-200b及miRNA-21对EOC患者的诊断效能与CA125相当,其最佳截值分别为2.08、1.46,敏感度和特异度分别为87.5%和80.4%,84.2%和70.5%;三项联合诊断EOC的敏感度和特异度较好,分别为97.2%和78.3%。相关性分析也显示,miRNA-200b与miRNA-21、CA125之间具有良好相关性。进一步说明了三项联合检测有助于提高EOC早期诊断的准确性。有报道证实血浆miRNA-200b是监测EOC的有效指标,能够稳定地被检测并能评估EOC患者的预后,有望作为EOC早期诊断的新型肿瘤标志物[12]。
Xu等[13]研究也表明,血浆miR-21可能作为一种新的诊断和预后的标志物,可作为EOC治疗的新靶点。本研究中,血浆miRNA-200b及miRNA-21升高是EOC发生的独立危险因素,而年龄、绝经状态、病理类型、病理分级及术后有残余肿瘤与miRNA-200b及miRNA-21表达水平无关。提示miRNA-200b及miRNA-21可独立作为EOC早期诊断的分子标志物。Meng等[14]研究认为,miRNA-200b是一种肿瘤诊断、治疗及检测预后极具潜能的生物学指标。Lv等[15]研究也发现,miRNA-21在肿瘤组织中发挥原癌基因的作用,miRNA-21异常表达是影响肿瘤患者预后的独立危险因素。
综上所述,尽管CA125是EOC早期诊断的标志物已有研究证实,但仍然存在一定的不足,其诊断EOC的特异度有待提高。我们初步研究表明血浆miRNA-200b及miRNA-21在EOC患者中异常表达,其对EOC的诊断效能与CA125相当,三项联合检测有助于提高EOC早期诊断的准确性。但本研究为单中心的临床研究,尚需多中心协作的前瞻性研究来进一步完善和丰富EOC诊疗评估体系。
[1] Anuradha S,Donovan PJ,Webb PM,etal.Variations in adjuvant chemotherapy and survival in women with epithelial ovarian cancer-a population-based study[J].Acta Oncol,2016,55(2):226-233.
[2] Fang H,Xie J,Zhang M,etal.miRNA-21 promotes proliferation and invasion of triple-negative breast cancer cells through targeting PTEN[J].Am J Transl Res,2017,9(3):953-961.
[3] Zhu SH,He XC,Wang L.Correlation analysis of miR-200b,miR-200c,and miR-141 with liver metastases in colorectal cancer patients[J].Eur Rev Med Pharmacol Sci,2017,21(10):2357-2363.
[4] Zou J,Liu L,Wang Q,etal.Downregulation of miR-429 contributes to the development of drug resistance in epithelial ovarian cancer by targeting ZEB1[J].Am J Transl Res,2017,9(3):1357-1368.
[5] Lin Y,Jin Y,Xu T,etal.MicroRNA-215 targets NOB1 and inhibits growth and invasion of epithelial ovarian cancer[J].Am J Transl Res,2017,9(2):466-477.
[6] Liu X,Zhang J,Xie B,etal.MicroRNA-200 family profile:a promising ancillary tool for accurate cancer diagnosis[J].Am J Ther,2016,23(2):e388-e397.
[7] Han JG,Jiang YD,Zhang CH,etal.A novel panel of serum miR-21/miR-155/miR-365 as a potential diagnostic biomarker for breast cancer[J].Ann Surg Treat Res,2017,92(2):55-66.
[8] Cao Q,Lu K,Dai S,etal.Clinicopathological and prognostic implications of the miR-200 family in patients with epithelial ovarian cancer[J].Int J Clin Exp Pathol,2014,7(5):2392-2401.
[9] Hu X,Macdonald DM,Huettner PC,etal.A miR-200 microRNA cluster as prognostic marker in advanced ovarian cancer[J].Gynecol Oncol,2009,114(3):457-464.
[10] 王 璐,杨文静.miR-211对上皮性卵巢癌细胞 HO8910增殖及细胞周期相关蛋白的影响[J].中国免疫学杂志,2017,33(2):264-267.
Wang L,Yang WJ.Effect of miR-211 on proliferation and cell cycle related proteins of epithelial ovarian cancer cell line H08910[J].Chin J Immunol,2017,33(2):264-267.
[11] Zuberi M,Mir R,Das J,etal.Expression of serum miR-200a,miR-200b,and miR-200c as candidate biomarkers in epithelial ovarian cancer and their association with clinicopathological features[J].Clin Transl Oncol,2015,17(10):779-787.
[12] Pendlebury A,Hannan NJ,Binder N,etal.The circulating microRNA-200 family in whole blood are potential biomarkers for high-grade serous epithelial ovarian cancer[J].Biomed Rep,2017,6(3):319-322.
[13] Xu YZ,Xi QH,Ge WL,etal.Identification of serum microRNA-21 as a biomarker for early detection and prognosis in human epithelial ovarian cancer[J].Asian Pac J Cancer Prev,2013,14(2):1057-1060.
[14] Meng X,Müller V,Milde-Langosch K,etal.Circulating cell-free miR-373,miR-200a,miR-200b and miR-200c in patients with epithelial ovarian cancer[J].Adv Exp Med Biol,2016,924(10):3-8.
[15] Lv H,He Z,Wang H,etal.Differential expression of miR-21 and miR-75 in esophageal carcinoma patients and its clinical implication[J].Am J Transl Res,2016,8(7):3288-3298.

