高原低氧环境对小鼠巨噬细胞杀伤活性及分泌IL-6、TNF-α的影响①
蒲小燕 胡方杰 李积东 刘 燕 乔丽娟 许玉珍 刘 珺 永 胜
(青海大学医学院,西宁 810001)
高原的自然环境较为特殊,其中较为明显的自然环境是强辐射、低氧和寒冷。在高原环境下,随着海拔的升高,空气中的氧分压不断降低,机体长期处于缺氧环境中,严重者可出现低氧血症。高原病是机体进入高原地区后的常见病和特发病,低氧引起的高原病严重威胁着我国高原居民的健康。据研究报道,低氧可导致机体免疫功能下降,易感染,免疫细胞(如淋巴细胞、中性粒细胞)减少,T细胞增殖能力受损,而B细胞无明显改变[1,2]。研究表明,模拟海拔8 000 m低氧暴露6 h后,小鼠脾脏CD3+、CD4+、CD8+细胞数均显著下降[3]。目前,有关低氧对固有免疫细胞功能改变的报道甚少。本研究通过建立高原低氧环境的小鼠模型,研究低氧条件对巨噬细胞(Macrophages,Mφ)的功能改变及作用机制,为高原低氧对固有免疫功能的影响提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康雄性BALB/c小鼠,4~6周龄,体重(17±2)g,于西安交通大学医学院动物实验中心购买,动物批准号SCXK(陕2007-001)。
1.1.2仪器与试剂 恒温摇床(ZD-85,精达仪器制造有限公司) ;酶联免疫检测仪(Bio-Rad xMark,美国);CO2培养箱(Thermo Scientific Forma,美国);小型台式离心机(Eppendorf 5148R,德国);流式细胞仪(BD FACS Calibur,美国)。异硫氰酸荧光素(FITC,eBioscience,美国);双乙酰基二氯荧光素(DCFH-DA,Sigma公司); N-甲酞-甲硫氨酞-亮氨酞苯丙氨酸(fMLP,Sigma公司);豆蔻酰佛波醇乙酷(PMA,Sigma公司);脂多糖(LPS,Sigma公司);RPMI1640、PBS 缓冲液(北京索莱宝公司);IL-6、TNF-α、NO ELISA试剂盒(TSZ,美国)。
1.2方法
1.2.1高原低氧动物模型的建立 30只健康雄性BALB/c小鼠,适应性喂养1周后,分3组。第1组为平原对照组,饲养于西安交通大学医学院动物试验中心30 d,海拔为400 m;第2组饲养于青海大学医学院基础医学研究中心动物室30 d,海拔为2 200 m;第3组饲养于青海省果洛州甘德县青珍乡30 d,海拔为4 200 m。三个组小鼠饲养环境温度均控制在18~20℃。
1.2.2检测Mφ吞噬能力 小鼠腹腔Mφ的制备:小鼠脱颈处死,浸入75%酒精中5 min,腹腔注入5 ml PBS缓冲液,用棉球轻柔腹部1~2 min后吸取腹腔液置于离心管,1 500 r/min离心5 min,弃上清收集Mφ,台盼蓝染色证实细胞活率在95%以上,用RPMI1640培养液调整细胞浓度为1×106个/ml。于24孔细胞培养板中接种Mφ,37℃、5%CO2培养箱中培养3 h,用PBS洗去未贴壁细胞,收取贴壁腹腔Mφ,细胞浓度至1×106个/ml[4]。
FITC标记细菌的制备:取对数生长期的金黄色葡萄球菌,PBS液洗涤2次,悬浮于碳酸缓冲液(pH值为9.05)中,浓度调整至0.5×109个/ml,1 ml 菌液中添加50 mg/ml FITC 10 μl(终浓度为500 μg/ml)后,37℃ 恒温摇床培养3 h,用 RPMI1640 液清洗,悬浮于RPMI1640培养液(荧光标记率为100%)。将细胞悬液与细菌悬液混合(细菌与细胞比例调整为20∶1),37℃ 恒温摇床培养30 min,用2.5%的甲醛溶液固定30 min,悬浮于PBS液中(细胞浓度为1×106个/ml)[4]。
吞噬能力检测:用流式细胞仪检测Mφ吞噬率时,用阴性对照在 FSC 和 SSC 二维点阵图选取 Mφ所在区域,调整 FS、SS 电压,圈定门内目的细胞。用FITC阳性细胞百分率来表示Mφ吞噬率,以阳性细胞平均荧光强度(X-Mean)表示其吞噬指数,每个样本均检测10 000个细胞[4]。
1.2.3Mφ呼吸爆发检测 装载探针DCFH-DA:先将DCFH-DA(用无血清 RPMI1640培养液稀释)加入至1×106个/ml Mφ细胞悬液中,将终浓度调为10 μmol/L。37℃、CO2培养箱内避光孵育 30 min。每隔 3~5 min 颠倒混匀1次,使细胞和探针充分接触,用PBS液洗涤细胞2次,以充分去除未进入细胞内的 DCFH-DA,将细胞浓度调整为1×106个/ml[4]。
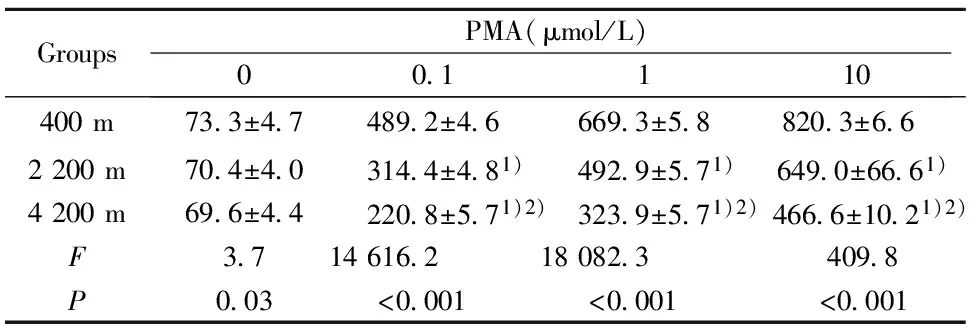
检测呼吸爆发:用FL1直方图阳性细胞平均荧光强度(X-Mean)表示ROS水平[4](图1)。各实验组细胞分别添加fMLP (终浓度分别为0、0.1、1、10 μmol/L)及PMA(终浓度分别为0、0.1、1、10 μmol/L)后于37℃孵育fMLP组30 min、PMA组孵育60 min,每个样本均检测10 000 个细胞。
1.2.4检测小鼠Mφ培养上清中的NO稳定氧化代谢产物亚硝酸盐(NO2-)水平 将1×106个/ml Mφ细胞悬液加入96孔细胞培养板(100 μl/孔),每孔添加100 μl LPS (终浓度分别为0、5、10、20、40 μg/ml) 刺激,于37℃、5%CO2培养箱中培养48 h后获取细胞培养上清,严格按试剂盒说明书操作测定不同浓度LPS作用下细胞培养上清中NO的浓度。

图1 高原低氧对fMLP 和PMA诱导的小鼠腹腔Mφ 呼吸爆发功能的影响Fig.1 Effects of hypoxia on fMLP and PMA induced peritoneal macrophages respiratory burst in mice
1.2.5检测小鼠Mφ培养上清中的IL-6、TNF-α的释放水平 将1×106个/ml Mφ细胞悬液接种于96孔细胞培养板(100 μl/孔),每孔加入100 μl LPS (终浓度为10 μg/ml)于37℃、5%CO2培养箱中培养48 h后,严格按试剂盒说明书操作检测细胞培养上清IL-6、TNF-α的释放水平。
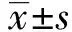
2 结果
2.1高原低氧对Mφ吞噬能力变化的影响 海拔2 200 m和海拔4 200 m实验组小鼠Mφ的吞噬率及吞噬指数较平原对照组明显降低(P<0.01);海拔4 200 m 组小鼠Mφ吞噬率、吞噬指数较海拔2 200 m组明显降低(P<0.01,表1,图2)。
2.2高原低氧对Mφ呼吸爆发功能的影响 未添加刺激物(fMLP、PMA)时,海拔2 200 m组和海拔4 200 m 组Mφ的呼吸爆发水平与平原对照组相比较无明显差异;添加刺激物(fMLP、PMA)后,海拔2 200 m 组和海拔4 200 m组Mφ的呼吸爆发水平在各浓度点上均低于平原对照组(P<0.01);添加刺激物(fMLP、PMA)后,海拔4 200 m组Mφ的呼吸爆发水平明显低于海拔2 200 m组(P<0.01,表2、3)。
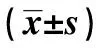
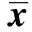
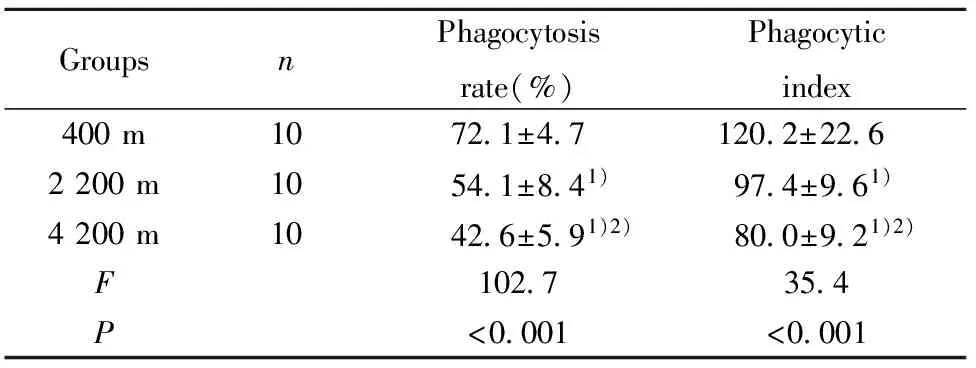
GroupsnPhagocytosisrate(%)Phagocyticindex400m1072 1±4 7120 2±22 62200m1054 1±8 41) 97 4±9 61)4200m1042 6±5 91)2) 80 0±9 21)2)F102 735 4P<0 001<0 001
Note:1)P<0.01,compared with 400 m group;2)P<0.01,compared with 2 200 m group.
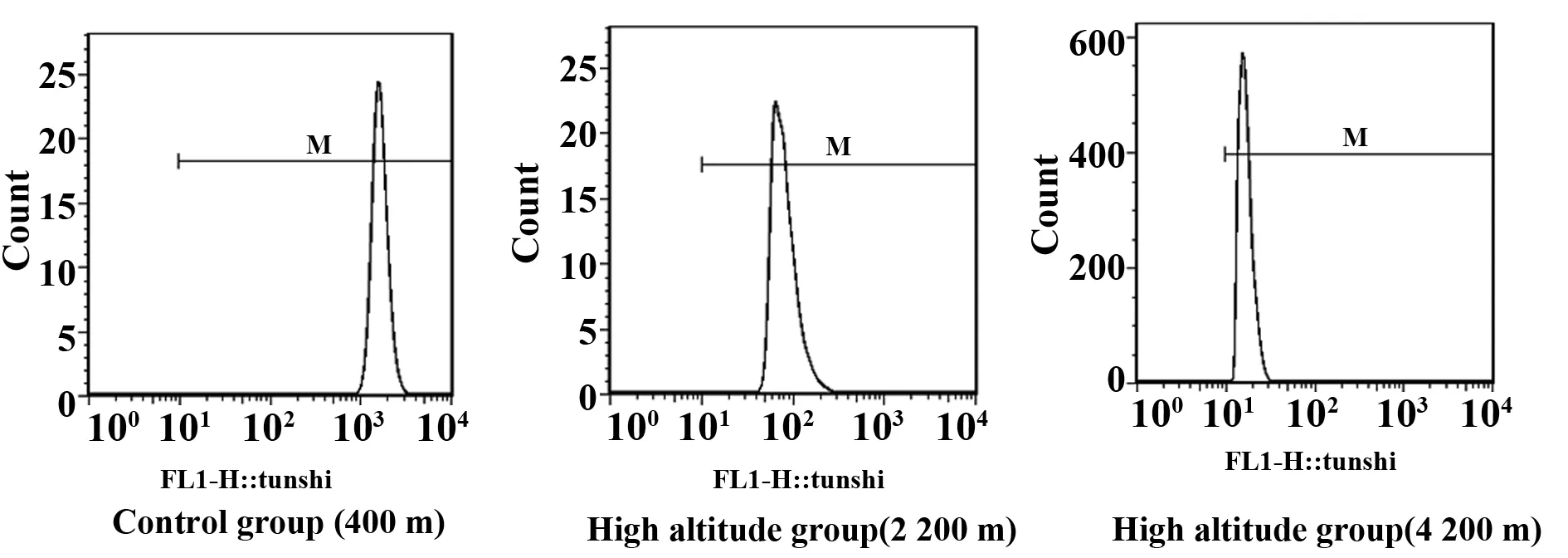
图2 高原低氧对小鼠腹腔中Mφ吞噬能力的影响Fig.2 Effects of hypoxia on peritoneal macrophages phagocytosis in mice
2.3高原低氧对LPS诱导的小鼠腹腔Mφ的NO产生的影响 未添加LPS时,海拔2 200 m和海拔4 200 m 组小鼠腹腔Mφ的NO释放量明显低于平原对照组 (P<0.01),且海拔4 200 m组Mφ的NO释放量明显低于海拔2 200 m组(P<0.01);添加LPS后,海拔2 200 m组和海拔4 200 m组小鼠腹腔Mφ培养上清中NO的浓度在各LPS浓度点上均低于平原对照组(P<0.01);添加LPS后,海拔4 200 m组小鼠腹腔Mφ培养上清中NO的浓度明显低于海拔2 200 m组(P<0.01,表4)。
2.4高原低氧对Mφ分泌IL-6、TNF-α的影响 未添加LPS时,海拔2 200 m和海拔4 200 m组小鼠腹腔Mφ培养上清中IL-6、TNF-α的浓度较平原对照组明显升高(P<0.01);海拔4 200 m组小鼠腹腔Mφ培养上清中IL-6、TNF-α的浓度较海拔2 200 m组明显升高(P<0.01,表5)。添加LPS时,海拔2 200 m 组和海拔4 200 m组小鼠腹腔Mφ培养上清中IL-6、TNF-α的浓度明显高于平原对照组(P<0.01); 添加LPS后, 海拔4 200 m组小鼠腹腔Mφ培养上清中IL-6、TNF-α的浓度明显高于海拔2 200 m组(P<0.01,表5)。
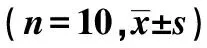
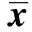
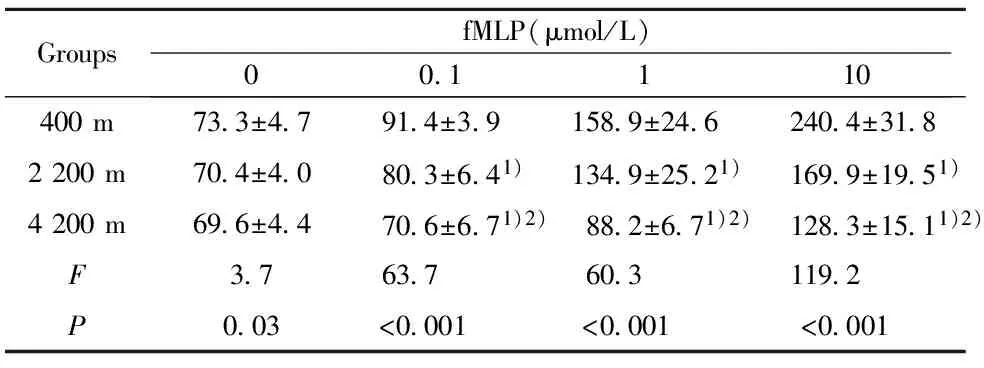
GroupsfMLP(μmol/L)00 1110400m73 3±4 791 4±3 9158 9±24 6240 4±31 82200m70 4±4 080 3±6 41)134 9±25 21)169 9±19 51)4200m69 6±4 470 6±6 71)2)88 2±6 71)2)128 3±15 11)2)F3 763 760 3119 2P0 03<0 001<0 001<0 001
Note:1)P<0.01,compared with 400 m group;2)P<0.01,compared with 2 200 m group.
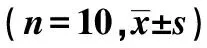
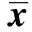
GroupsPMA(μmol/L)00 1110400m73 3±4 7489 2±4 6669 3±5 8820 3±6 6 2200m70 4±4 0314 4±4 81)492 9±5 71)649 0±66 61)4200m69 6±4 4220 8±5 71)2)323 9±5 71)2)466 6±10 21)2)F3 714616 218082 3409 8P0 03<0 001<0 001<0 001
Note:1)P<0.01,compared with 400 m group;2)P<0.01,compared with 2 200 m group.
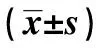
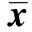
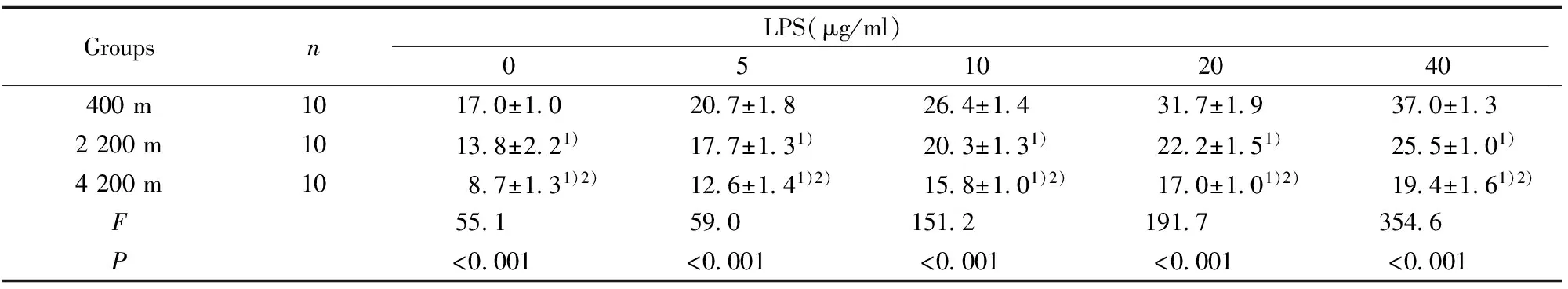
GroupsnLPS(μg/ml)05102040400m1017 0±1 020 7±1 826 4±1 431 7±1 937 0±1 32200m1013 8±2 21)17 7±1 31)20 3±1 31)22 2±1 51)25 5±1 01)4200m108 7±1 31)2)12 6±1 41)2)15 8±1 01)2)17 0±1 01)2)19 4±1 61)2)F55 159 0151 2191 7354 6P<0 001<0 001<0 001<0 001<0 001
Note:1)P<0.01,compared with 400 m group;2)P<0.01,compared with 2 200 m group.
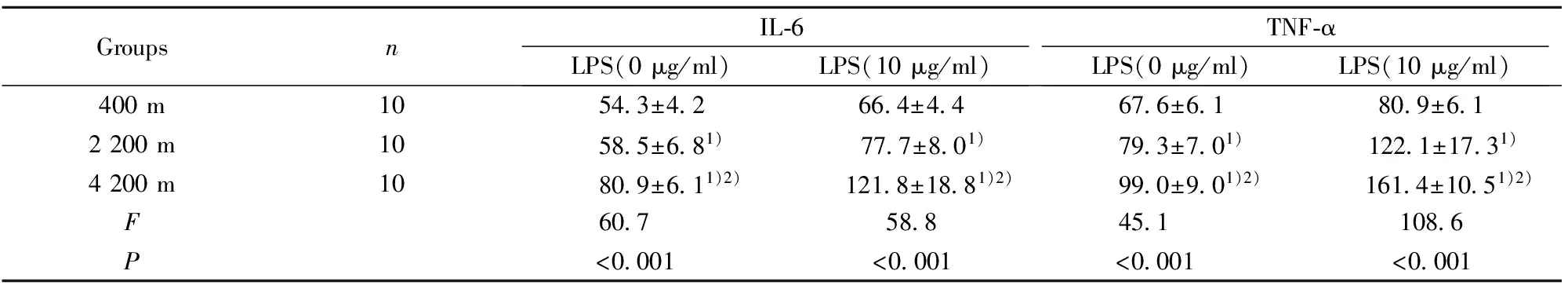
GroupsnIL⁃6LPS(0μg/ml)LPS(10μg/ml)TNF⁃αLPS(0μg/ml)LPS(10μg/ml)400m1054 3±4 266 4±4 467 6±6 180 9±6 12200m1058 5±6 81)77 7±8 01)79 3±7 01) 122 1±17 31)4200m1080 9±6 11)2) 121 8±18 81)2)99 0±9 01)2) 161 4±10 51)2)F60 758 845 1108 6P<0 001<0 001<0 001<0 001
Note:1)P<0.01,compared with 400 m group;2)P<0.01,compared with 2 200 m group.
3 讨论
Mφ是固有免疫中的重要成员,具有吞噬杀伤及抗原提呈的生物学功能,是维持机体正常生理状态所必需的免疫细胞[5-7]。Mφ通过呼吸爆发功能得以清除吞噬溶酶体内的病原微生物,是综合性的机体防御性反应。吞噬细胞可氧化还原型辅酶 Ⅱ (又称烟酰胺腺嘌呤二核苷酸磷酸,Nicotinamide adenine dinucl-eotide phosphate,NADPH),继而催化分子氧还原为反应性氧中间产物(Reactive oxygen intermedi-ate,ROI),伴有氧耗量骤然增加;ROI包括游离羟基(OH-)、超氧阴离子(O2-)、过氧化氢(H2O2)和单态氧(1O2)等活性氧(Reactive oxygen species,ROS);这是一类高活性的杀菌物质,这种现象称呼吸爆发(Respiratory burst)[8]。NO是机体内重要的效应分子及信使分子,也是一种细胞毒分子,具有双重作用[9,10]。NO具有非特异性杀菌和杀肿瘤作用,还可以在特异性淋巴细胞参与下发挥复杂的免疫功能。研究表明,高海拔低氧暴露条件下,增加机体的易感性,低氧可抑制单核/Mφ的迁移功能,低氧影响Mφ的吞噬能力,低氧抑制金黄色葡萄球菌的清除[11-15]。本研究结果也表明低氧可降低小鼠腹腔巨噬细胞的吞噬率以及吞噬杀伤功能,与以往研究结果一致。此外,研究表明低氧抑制吞噬细胞 NADPH 氧化酶 PHOX 的活性[16]。Lewis等[17]的试验结果表明低氧刺激的巨噬细胞释放NO的能力也有所下降。本研究结果也表明低氧可抑制巨噬细胞释放NO的能力,与以往研究结果一致。据报道,激活Mφ分泌的IL-6、TNF-α炎性因子可引起广泛的组织损伤、多器官炎症反应[18]。据研究报道,低氧能够引起高原人群血清中IL-6、TNF-α水平上升[19]。本研究结果表明海拔2 200 m和4 200 m高原低氧暴露可促进小鼠腹腔巨噬细胞IL-6、TNF-α的分泌功能,与以往研究结果一致。
综上所述,海拔2 200 m和4 200 m高原低氧暴露可抑制小鼠腹腔Mφ吞噬及氧依赖杀伤功能、增加细胞因子的分泌造成组织损伤,进而抑制小鼠Mφ的固有免疫功能。
[1] Healy K,Labrique AB,Miranda JJ,etal.Dark adaptation at high altitude:an unexpected pupillary response to chronic hypoxia in andean highlanders[J].High Altitude Med Biol,2016,17(3):208-213.
[2] Mishra KP,Ganju L.Influence of high altitude exposure on the immune system:a review[J].Immunol Invest,2010,39(3):219-234.
[3] 刘嘉婧,刘荣花,储以微.免疫代谢研究进展[J].中国免疫学杂志,2017,33(1):148-151.
Liu JJ,Liu RH,Chu YW.Reservoir research progress in micro-immune metabolism [J].Chin J Immunol,2017,33(1):148-151.
[4] 永 胜,蒲小燕,高 翔,等.慢性高原红细胞增多症患者中性粒细胞吞噬能力及呼吸爆发功能[J].青海医学院学报,2012,33(4):224-229.
Yong S,Pu XY,Gao X,etal.Research on the changes of phagocytic ability and the function of respiratory burst of neutrophils in patients with high altitude polycythemia[J].J Qinghai Med College,2012,33(4):224-229.
[5] Mills CD,Ley K.M1 and M2 macrophages:the chicken and the egg of immunity[J].J Innate Immunity,2014,6(6):716-726.
[6] Riboldi E,Porta C,Morlacchi S,etal.Hypoxia-mediated regulation of macrophage functions in pathophysiology[J].Intern Immunol,2013,25(2):67-75.
[7] Huang G,Su J,Zhang M,etal.RhoB regulates the function of macrophages in the hypoxia-induced inflammatory response[J].Cell Mol Immunol,2017,14(3):265-275.
[8] Yang CY,Hong CP.The NADPH oxidase Rboh D is involved in primary hypoxia signalling and modulates expression of hypoxia-inducible genes under hypoxic stress[J].Environmental Experimental Botany,2015,115:63-72.
[9] Macmicking J,Xie QW,Nathan C.Nitric oxide and macrophage function[J].Annual Rev Immunol,1997,15(15):323-350.
[10] Muriel P.Regulation of nitric oxide synthesis in the liver[J].J Applied Toxicol,2015,20(3):189-195.
[11] Engin A.Adipose tissue hypoxia in obesity and its impact on preadipocytes and macrophages:hypoxia hypothesis[J].Adv Exp Med Biol,2017,960:305-326.
[12] Leeper-Woodford SK,Mills JW.Phagocytosis and ATP levels in alveolar macrophages during acute hypoxia[J].Am J Respir Cell Mol Biol,1992,6(3):326-334.
[13] Lindert KA,Caldwell-Kenkel JC,Nukina S,etal. Activation of Kupffer cells on reperfusion following hypoxia:particle phagocytosis in a low-flow,reflow model[J].Am J Physiol,1992,262(1):345-350.
[14] Albina JE,Herry WL Jr,Mastrofrancesco B,etal. Macrophage activation by culture in an anoxic environment[J].J Immunol,1995,155(9):4391-4396.
[15] Ortiz-Masià D,Díez I,Calatayud S,etal.Induction of CD36 and thrombospondin-1 in macrophages by hypoxia-inducible factor 1 and its relevance in the inflammatory process[J].PLoS One,2012,7(10):e48535.
[16] 永 胜,双 杰,芦殿香,等.高原红细胞增多症患者中性粒细胞[Ca2+]i及NADPH氧化酶活性变化[J].山东医药,2013,53(35):5-8.
Yong S,Shuang J,Lu DX,etal.Changes of neutrophils [Ca2+]i and activity of NADPH oxidase in patients with high altitude polycythemia[J].J Shandong Med,2013,53(35):5-8.
[17] Lewis JS Lee JA,Underwood JC,etal.Macrophage responses to hypoxia:relevance to disease mechanisms[J].J Leukoc Biol,1999,66(6):889-900.
[18] 张翠萍,谢印芝,陈 鹏,等.低氧对巨噬细胞分泌TNF-α和IL-6的影响及其机制[J].中国应用生理学杂志,2005,21(3):281-284.
Zhang CP,Xie YY,Chen P,etal.Effects of low oxygen on TNF-α and IL-6 in macrophages[J].J Chin Applied Physiol,2005,21(3):281-284.
[19] 崔建华,张西洲,何富文,等.健康青年进驻高原血清TNF-α和IL-6的变化[J].西北国防医学杂志,1999,20(3):197-198.
Cui JH,Zhang XZ,He FW,etal.Changes in serum TNF-α and IL-6 in the plateau of healthy young people[J].J Northwestern Defense Med,1999,20(3):197-198.

