RNA干扰抑制BAG-1基因表达对皮肤鳞状细胞癌增殖及凋亡的影响研究
邢 枫 陶思羽 张 黎
(河南省人民医院眼科/河南省立眼科医院,郑州 450003)
皮肤鳞状细胞癌(Cutaneous squamous cell carcinoma,CSCC)简称皮肤鳞癌,是眼睑部常见的皮肤恶性肿瘤之一,具有侵袭力高、易发生转移和复发、远期预后差、耐药性等特性,且发病率逐年增长[1]。遗传因素及外部环境,细胞内抑癌基因失活、癌基因突变、异常的信号转导通路和凋亡过程等多种因素均可引起皮肤鳞状细胞癌的发生发展,这提示该病的发生发展是一个多因素、多阶段、多基因的复杂过程,因此,研究皮肤鳞状细胞癌发生的分子机制对于诊断和治疗具有重要意义。 BAG-1(Bcl-2-associated athanogene-1)是一种多功能蛋白,可与B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)、多种生长因子受体等相互作用,抑制多种刺激因素诱导的凋亡,也可通过影响蛋白质翻译后修饰-重组或降解,调节细胞的侵袭、转移、黏附[2]。一些临床研究发现,在正常组织中BAG-1低表达或几乎不表达,而在多种肿瘤中呈现高表达,如甲状腺癌、乳腺癌等,影响肿瘤的发生、发展、预后等[3,4]。BAG-1基因在皮肤鳞状细胞癌中的研究较少,有研究发现,BAG-1基因在皮肤鳞状细胞癌中有高表达,可降低化疗敏感性[5],但关于其对皮肤鳞状细胞癌增殖凋亡的影响及机制研究的尚不清楚。因此,本研究旨在探索BAG-1对皮肤鳞状细胞癌增殖凋亡的影响,并进一步探究可能的分子机制。
1 材料与方法
1.1细胞及主要试剂和仪器 皮肤鳞状细胞癌A431购自中科院细胞库;胎牛血清、RPMI1640培养基、Trizol、LipofectamineTM2000转染试剂盒均购自美国Gibco公司;CCK8试剂盒购自美国Promega公司;二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒购自碧云天生物技术研究所;膜联蛋白V(Annexin V)-异硫/碘化丙锭(PI)细胞凋亡试剂盒购自南京凯基生物科技发展有限公司;BAG-1、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、β-连环蛋白(β-catenin)、Survivin抗体均购自美国SANTA CRUZ;辣根过氧化物酶标记的羊抗鼠IgG购自北京中杉金桥生物技术公司;实时荧光定量PCR仪购自瑞士Roche;酶标仪购自美国Bio-Tek公司;流式细胞仪均购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养 A431细胞在RPMI1640高糖培养基中(含有10%胎牛血清、青霉素100 U/ml和链霉素100 U/ml),置于37℃、饱和湿度及5%CO2培养箱中单层传代培养,每2~3 d更换一次培养基。实验用生长至对数期的细胞。
1.2.2细胞转染 以2×105个/孔将A431细胞铺在不含血清的6孔细胞培养皿中,培养24 h后进行转染。转染分为空白组、阴性对照组和BAG-1-siRNA组。阴性对照组和BAG-1-siRNA组按照LipofectamineTM2000说明书进行转染,转染浓度为200 nmol/L。转染48 h后收集细胞,提取细胞中的RNA、蛋白进行检测。
1.2.3转染效果检测 RT-PCR检测转染BAG-1的siRNA后A431细胞中BAG-1的mRNA表达,简要操作步骤如下:利用RNA提取试剂盒提取细胞中的总RNA,紫外分光光度法定量,取2 μg总RNA逆转录合成cDNA,以GAPDH为内参引物,实时荧光定量PCR对BAG-1进行扩增。相应的引物序列如下:BAG-1 上游引物 5′-ACCCGTAGCAAGAACG-TGAC-3′,下游引物:5′-CACCAATTAACATGACT-CGGC-3′。GAPDH引物序列:上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′。PCR扩增标准程序为:94℃预变性5 min,94℃ 变性45 s、58℃ 退火45 s,72℃延伸45 s,循环35次,最后72℃延伸10 min。采集荧光值,根据Ct均值利用2-ΔΔCt法进行统计,以GAPDH作为内参,分析BAG-1的mRNA相对表达量。
Western blot检测转染BAG-1的siRNA后A431细胞中BAG-1的蛋白表达,简要操作步骤如下:收集5×106个细胞,加入适量的裂解液裂解细胞,离心,取上清,BCA试剂盒对蛋白进行定量。取总蛋白60 μg,在15%的SDS-PAGE凝胶中进行电泳分离,电转移法将蛋白转移至硝酸纤维素膜上,硝酸纤维素膜用5%的脱脂奶粉在室温下封闭2 h,加入1∶1 000稀释的BAG-1、GAPDH一抗,4℃孵育,再加入辣根过氧化物酶标记的羊抗鼠IgG,洗膜,增强型化学发光法(ECL)显影,自动凝胶成像系统采集图像。
1.2.4细胞增殖实验 空白组、阴性对照组和BAG-1-siRNA组分别以1×105ml-1接种于96孔板,每孔中加入200 μl,于转染后的48 h收集细胞,检测时每孔中加入CCK8试剂10 μl,酶标仪在570 nm处检测三组细胞的吸光度值(OD)。实验重复3次。
1.2.5细胞凋亡实验 收集转染48 h的细胞,制备单细胞悬液,并将细胞浓度调整为1×106个/ml,取1 ml细胞,离心,弃掉上清,加入预冷的磷酸盐缓冲液振荡悬浮细胞,再次离心,弃上清。加入200 μl结合缓冲液重悬细胞,加入10 μl的AnnexinV-FITC和5 μl的PI,充分混匀后室温避光反应30 min,再加入300 μl结合缓冲液,1 h内上流式细胞仪检测细胞凋亡情况。
1.2.6IL-6、VEGF含量检测 各组细胞转染后处理48 h,收集细胞上清,同时计数细胞,采用双抗夹心ELISA试剂盒检测细胞上清中IL-6、VEGF的含量。
1.2.7Bax、β-catenin、Survivin蛋白表达检测 参照1.2.3方法
2 结果
2.1BAG-1-siRNA转染A431细胞后BAG-1的表达 BAG-1的siRNA转染A431细胞48 h后,RT-PCR及Western blot检测BAG-1-siRNA组及阴性对照组和空白组细胞中BAG-1的表达,结果显示,阴性对照组BAG-1的mRNA及蛋白表达与空白组差异无统计学意义(P>0.05),而在BAG-1-siRNA组的表达显著低于空白组(P<0.05)。见图1、表1。
2.2RNA干扰BAG-1表达对A431细胞增殖凋亡的影响 CCK8法检测各组细胞的增殖情况,流式细胞仪检测细胞凋亡情况,结果显示,与空白对照组比较,BAG-1-siRNA组细胞增殖显著降低(P<0.05),细胞凋亡率显著增加(P<0.05)。见图2、表2。
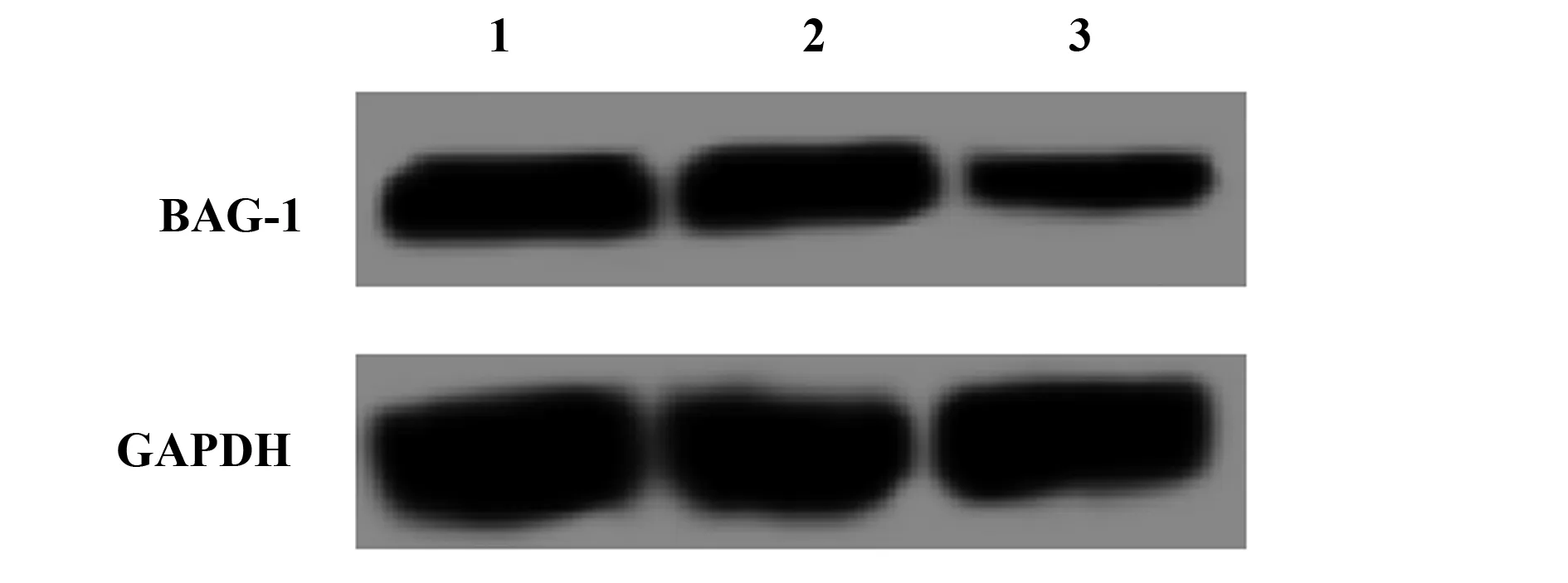
图1 BAG-1-siRNA转染A431细胞后BAG-1的蛋白表达Fig.1 Protein expression of BAG-1 after BAG-1-siRNA was transfected into A431 cellsNote:1.Control group;2.NC-siRNA group;3.BAG-1-siRNA group.
表1BAG-1-siRNA转染A431细胞后BAG-1的mRNA及蛋白表达
Tab.1mRNAandproteinexpressionofBAG-1afterBAG-1-siRNAwastransfectedintoA431cells
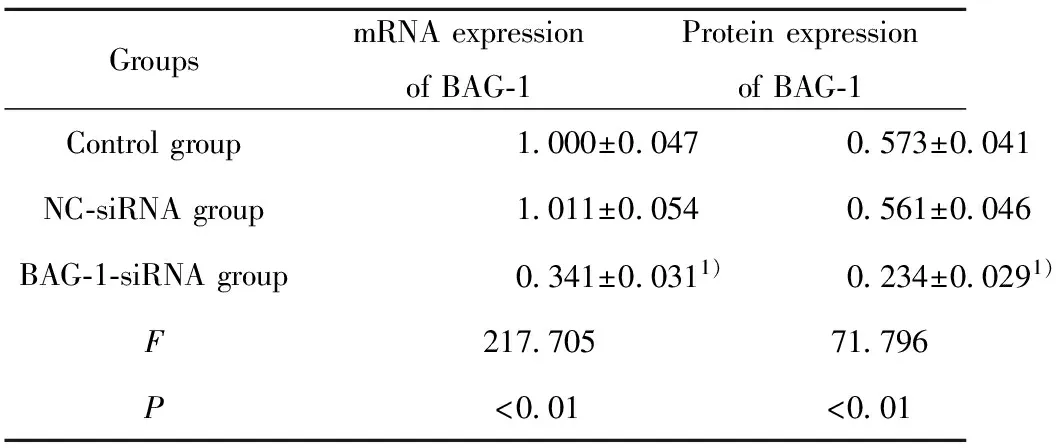
GroupsmRNAexpressionofBAG⁃1ProteinexpressionofBAG⁃1Controlgroup1 000±0 0470 573±0 041NC⁃siRNAgroup1 011±0 0540 561±0 046BAG⁃1⁃siRNAgroup0 341±0 0311)0 234±0 0291)F217 70571 796P<0 01<0 01
Note:Compared with control group,1)P<0.05.
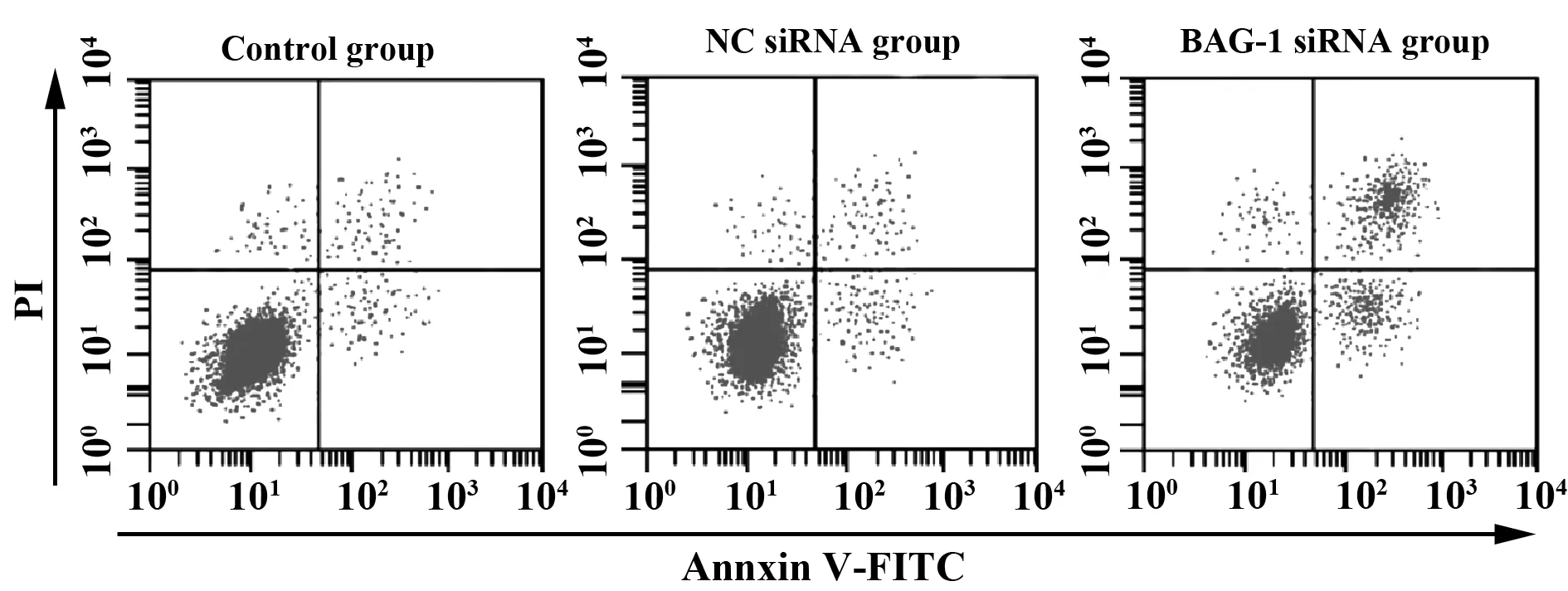
图2 RNA干扰BAG-1表达对A431细胞凋亡的影响Fig.2 Effect of BAG-1 expression by RNA interference on A431 cell apoptosis
2.3RNA干扰BAG-1表达对A431细胞 Bax、β-catenin、Survivin蛋白表达的影响 Western blot检测a-2家族促凋亡蛋白 Bax及Wnt/β-catenin信号通路β-catenin、Survivin的蛋白表达,结果显示,与空白对照组比较,Bax蛋白表达显著升高,β-catenin、Survivin蛋白表达均显著降低(P<0.05)。见图3、表3。
2.4RNA干扰BAG-1表达对A431细胞 IL-6、VEGF含量的影响 通过ELISA试剂盒检测RNA干扰BAG-1表达后A431细胞中IL-6、VEGF含量,结果如表4所示,BAG-1-siRNA组IL-6、VEGF含量均显著低于空白组(P<0.05)。
表2RNA干扰BAG-1表达后A431细胞增殖凋亡情况
Tab.2EffectofBAG-1expressionbyRNAinterferenceonA431cellproliferationandapoptosis
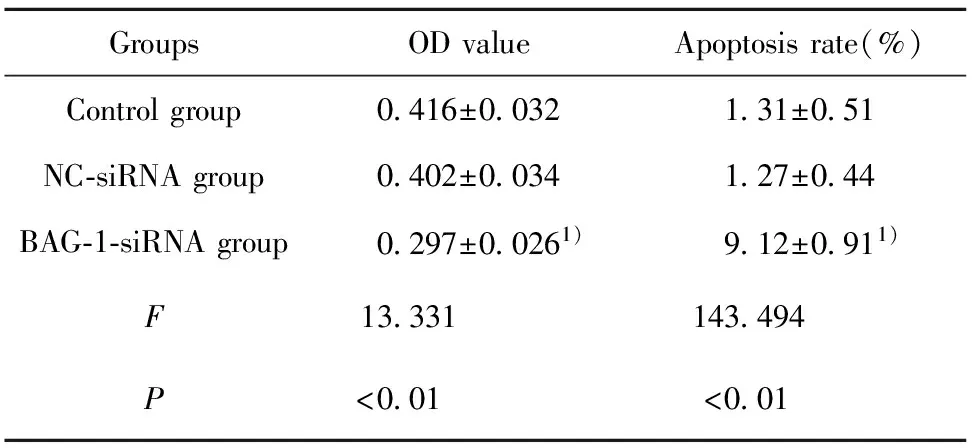
GroupsODvalueApoptosisrate(%)Controlgroup0 416±0 0321 31±0 51NC⁃siRNAgroup0 402±0 0341 27±0 44BAG⁃1⁃siRNAgroup0 297±0 0261)9 12±0 911)F13 331143 494P<0 01<0 01
Note:Compared with control group,1)P<0.05.
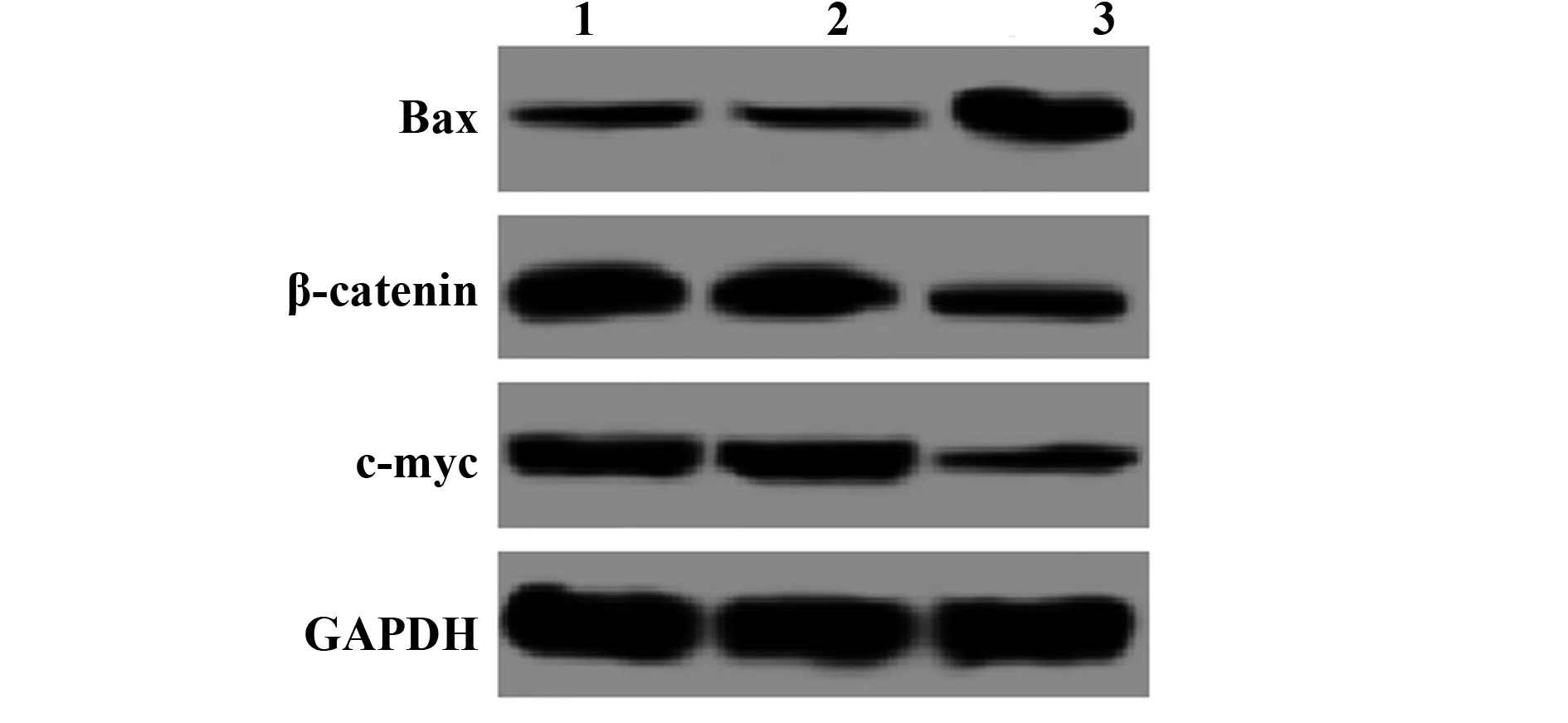
图3 RNA干扰BAG-1表达对A431细胞 Bax、β-catenin、Survivin蛋白表达的影响Fig.3 Effect of BAG-1 expression by RNA interference on expression of Bax,β-catenin and Survivin protein in A431 cellsNote:1.Control group;2.NC-siRNA group;3.BAG-1-siRNA group.
表3Bax、β-catenin、Survivin的蛋白相对表达量
Tab.3ProteinrelativeexpressionofBax,β-cateninandSurvivin

GroupsProteinrelativeexpressionBaxβ⁃cateninSurvivinControlgroup0 102±0 0090 553±0 0480 255±0 026NC⁃siRNAgroup0 094±0 0100 564±0 0520 271±0 028BAG⁃1⁃siRNAgroup0 642±0 0591)0 209±0 0221)0 108±0 0101)F242 47766 77446 571P<0 01<0 01<0 01
Note:Compared with control group,1)P<0.05.
表4RNA干扰BAG-1表达对A431细胞IL-6、VEGF含量的影响
Tab.4IL-6andVEGFcontentofA431cellsafterBAG-1expressionissuppressedbyRNAinterference
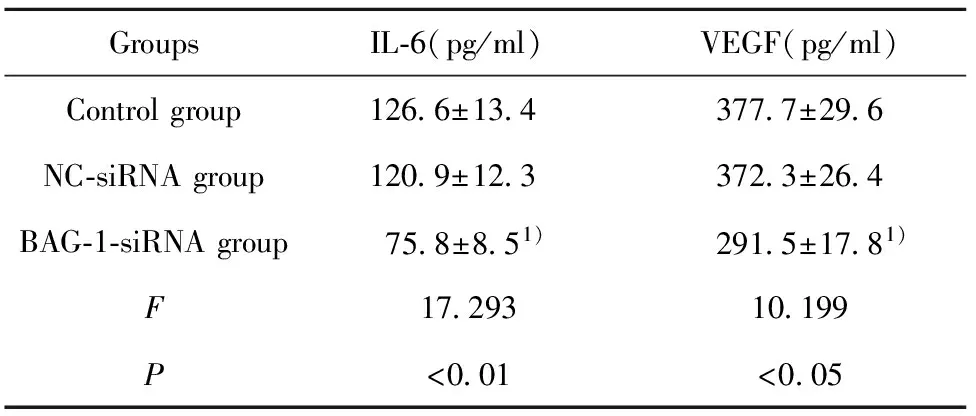
GroupsIL⁃6(pg/ml)VEGF(pg/ml)Controlgroup126 6±13 4377 7±29 6NC⁃siRNAgroup120 9±12 3372 3±26 4BAG⁃1⁃siRNAgroup75 8±8 51)291 5±17 81)F17 29310 199P<0 01<0 05
Note:Compared with control group,1)P<0.05.
3 讨论
RNA干扰是一种能使基因在转录后发生沉默的机制,是目前公认的快速有效的基因沉默技术,能特异、高效地抑制细胞内基因表达,目前已在肿瘤治疗、基因功能研究、信号转导等方面得到广泛应用[6]。利用RNA干扰技术寻找更有效的皮肤鳞状细胞癌治疗方法具有重要意义。皮肤鳞状细胞癌的发生发展是多因素、多基因、多阶段的复杂过程,增殖、凋亡的失衡是其发生发展的重要机制。因此,寻找在肿瘤中既能抑制细胞增殖,又能促进凋亡的方法是治疗的关键。BAG-1是一种多功能的抗凋亡蛋白,与细胞的增殖凋亡相关。BAG-1过度表达可使含半胱氨酸的天冬氨酸蛋白水解酶(Cysteinyl aspartate specific proteinase,Caspase)途径激活受到抑制,从而抑制放射、化学试剂等诱导的凋亡[7]。已有多项研究发现,BAG-1在多种肿瘤中有高表达,其表达可作为结肠癌、前列腺癌等肿瘤判断预后的一个重要因素[8,9]。也有研究指出,通过RNA干扰技术沉默BAG-1的表达可增强非小细胞肺癌放疗敏感性,可能机制是抑制细胞增殖和促凋亡[10];在小鼠黑色素瘤生物学特性的研究中发现,RNA干扰BAG-1表达后可明显降低细胞增殖及克隆形成能力,促进细胞的凋亡,并阻滞细胞于S期[11]。鉴于BAG-1在皮肤鳞状细胞癌中研究较少,但已发现在皮肤鳞状细胞癌中的高表达,通过RNA干扰沉默其表达,检测细胞增殖凋亡情况,发现细胞增殖明显受到抑制,且凋亡增加。
细胞凋亡受到复杂的网络系统进行精细的调控,胞内信号转导通路、细胞凋亡通路及Bcl-2、P53等均是这个系统的一部分。Bax是Bcl-2家族的成员之一,发挥促凋亡作用,其表达水平升高可促进细胞的凋亡[12]。大量研究发现,Wnt/β-catenin信号通路的异常表达与肿瘤的发生发展密切相关,在肝癌、胃癌等多种癌组织中均可检测到Wnt信号分子及蛋白存在高表达,而抑制其表达可降低肿瘤细胞的发生发展[13,14]。皮肤鳞状细胞癌中发现抑制Wnt/β-catenin信号通路可促进癌细胞凋亡[15]。β-catenin、Survivin是Wnt/β-catenin信号通路下游的靶基因,β-catenin、Survivin共同作用可促进癌细胞的增殖[16]。细胞因子对肿瘤具有杀伤和促生长的双重作用,IL-6和VEGF是两个促进肿瘤生长的细胞因子[17]。本研究中为了进一步研究RNA干扰沉默BAG-1表达后引起细胞增殖凋亡的机制,及对细胞免疫的影响,通过Western blot检测了Bax、β-catenin、Survivin蛋白表达,通过ELISA试剂盒检测了IL-6和VEGF含量,发现Bax蛋白表达上调,β-catenin、Survivin蛋白表达下调,IL-6和VEGF含量降低。
综上所述,本研究发现RNA干扰BAG-1表达可降低皮肤鳞状细胞癌增殖和诱导细胞凋亡,并可降低细胞内细胞因子IL-6和VEGF的含量,其中影响细胞增殖凋亡的机制可能与上调Bax表达和抑制Wnt/β-catenin信号通路有关。这些结果提示BAG-1可能是皮肤鳞状细胞癌分子生物学诊断的指标,但本研究研究的还不够全面。后续研究的重点是BAG-1对皮肤鳞状细胞癌其他生物学特性的影响,以及在实验模型中研究其作用。
[1] Wang A,Landén NX,Meisgen F,etal.MicroRNA-31 is overexpressed in cutaneous squamous cell carcinoma and regulates cell motility and colony formation ability of tumor cells[J].PLoS One,2014,9(7):e103206.
[2] Hung KW,Huang HW,Cho C C,etal.Nuclear magnetic resonance structure of the cytoplasmic tail of heparin binding EGF-like growth factor (proHB-EGF-CT) complexed with the ubiquitin homology domain of Bcl-2-associated athanogene 1 from Mus musculus (mBAG-1-UBH)[J].Biochemistry,2014,53(12):1935-1946.
[3] Ma F,Zhang M,Gong W,etal.MiR-138 Suppresses Cell Proliferation by Targeting Bag-1 in Gallbladder Carcinoma[J].PLos One,2015,10(5):e0126499.
[4] Emmanouil P,Natalia R,Alison Y,etal.A combination of trastuzumab and BAG-1 inhibition synergistically targets HER2 positive breast cancer cells:[J].Oncotarget,2016,7(14):18851-18864.
[5] Wood J,Pring M,Eveson JW,etal.Co-overexpression of Bag-1 and heat shock protein 70 in human epidermal squamous cell carcinoma:Bag-1-mediated resistance to 5-fluorouracil-induced apoptosis[J].Br J Cancer,2011,104(9):1459-1471.
[6] 刘志坤,祝淑钗,苏景伟,等.RNA干扰MDC1基因对食管癌细胞X线照后细胞周期及相关蛋白表达影响[J].中华放射肿瘤学杂志,2015,24(6):708-713.
Liu ZK,Zhu SC,Su JW,etal.Effect of RNA interference for MDC1 gene on cell cycle and expression of related proteins in esophageal carcinoma cells after X-ray radiation[J].Chin J Radiat Oncol,2015,24(6):708-713.
[7] Aveic S,Viola G,Accordi B,etal.Targeting BAG-1:A novel strategy to increase drug efficacy in acute myeloid leukemia[J].Exp Hematol,2015,43(3):180-190.e6.
[8] Huang W,Liu Z,Zhou G,etal.Magnetic gold nanoparticle-mediated small interference RNA silencing Bag-1 gene for colon cancer therapy[J].Oncol Reports,2016,35(2):978-984.
[9] Bruchmann A,Roller C,Walther T V,etal.Bcl-2 associated athanogene 5 (Bag5) is overexpressed in prostate cancer and inhibits ER-stress induced apoptosis[J].Bmc Cancer,2013,13(1):1-11.
[10] Yang L,Liu Z,minwen H,etal.Reduction of cisplatin resistance of lung cancer A549 cells through down-regula-ting the expression of BAG-1 mediated by shRNA[J].Chin J Cancer Biotherapy,2013,20(6):706-710.
[11] Enthammer M,Papadakis ES,Salomé GM,etal.Isolation of a novel thioflavin S-derived compound that inhibits BAG-1-mediated protein interactions and targets BRAF inhibitor-resistant cell lines[J].Mol Cancer Therapeutics,2013,12(11):2400-2414.
[12] 朵 杰,汪晓洲.芹菜素与老年大鼠缺血心肌细胞凋亡及Bcl-2、Bax、Caspase-3表达的相关性[J].中国老年学,2017,37(1):54-56.
Duo J,Wang XZ.Correlation of apigenin with apoptosis and expression of Bcl-2,Bax and Caspase-3 in ischemic myocardium of old rats[J].Chin Gerontol,2017,37(1):54-56.
[13] Chen W,Zhang Y W,Li Y,etal.Constitutive expression of Wnt/β-catenin target genes promotes proliferation and invasion of liver cancer stem cells[J].Mol Med Reports,2016,13(4):3466-3474.
[14] 苏 坚,赵晓红,刘 芳,等.RORα高表达抑制人胃癌MGC803细胞Wnt/β-catenin信号通路靶基因表达[J].中国细胞生物学学报,2016(11):1358-1365.
Su J,Zhao XH,Liu F,etal.Overexpression of RORα influence target genes of Wnt/β-catenin signaling pathway in human gastric MGC803 cells[J].Chin J Cell Biol,2016,38(11):1358-1365.
[15] Hui H,Wu N,Wu M,etal.Dihydroartemisinin suppresses growth of squamous cell carcinoma A431 cells by targeting the Wnt/β-catenin pathway[J].Anti-cancer Drugs,2016,27(2):99-105.
[16] Arend RC,Londono-Joshi AI,Samant RS,etal.Inhibition of Wnt/β-catenin pathway by niclosamide:a therapeutic target for ovarian cancer[J].Gynecol Oncol,2014,134(1):112-120.
[17] 王洪琰,王 郁,王佳丽,等.IL-6与VEGF在食管鳞状细胞癌中的表达及其临床意义[J].中国肿瘤生物治疗杂志,2015,22(5):619-624.0.
Wang HY,Wang Y,Wang JL,etal.Expression and clinical significance of IL-6 and VEGF in esophageal squamous cell cancer[J].Chin J Cancer Biotherapy,2015,22(5):619-624.

