稳定敲低NLRP3基因的小鼠巨噬细胞系的建立与鉴定①
李晓瑞 游雷鸣 陈丹军 任睿芳 安 辰 张海丽 吴 珺 郝 钰
(北京中医药大学生命科学学院免疫学与微生物学系,北京 100029)
巨噬细胞(Macrophages,Mφ)是机体固有免疫系统的重要免疫细胞之一,它在病原微生物和衰老细胞的清除,促进炎症反应,诱发适应性免疫应答以及组织损伤后的修复与重构过程中起关键作用[1]。内源性或外源性的多种刺激能引起巨噬细胞活化,特别是细胞中NLRP3炎性体的活化,产生大量的促炎性细胞因子,如IL-1β、IL-18、IL-6、IL-8及TNF-α等[2,3]。另外,巨噬细胞分泌的趋化因子,还可以招募大量的中性粒细胞、单核细胞和淋巴细胞向炎症部位迁移,以加重炎症反应。NLRP3是包括巨噬细胞在内的固有免疫细胞中的一种重要胞内模式识别受体(Pattern recognition receptor,PRR),可被细胞内的病原相关分子模式(Pathogen-associated molecular patterns,PAMP)或者损伤相关分子模式(Damage-associated molecular pattern,DAMP)刺激而活化[4,5]。与NLRP3相关的炎症小体(称为NLRP3炎性体)是最近研究较广泛的炎症小体,其在炎症反应的发生中有重要的作用。NLRP3炎性小体是由支架蛋白NLRP3,接头蛋白ASC和效应分子pro-Caspase-1相互结合而形成的复合物。胞内活化的NLRP3分子可招募接头分子ASC,使与ASC结合的无活性的pro-Caspase-1蛋白水解为有活性Caspase-1(又称为白介素转换酶),活性Caspase-1结合并切割pro-IL-1β和pro-IL-18细胞因子前体分子,使其成为成熟的IL-1β和IL-18分泌出胞外,以介导并放大炎症反应[6-8]。
越来越多的研究发现,NLRP3炎症小体作为先天性免疫的重要组分,在免疫反应,特别是过度炎症反应相关疾病的发生过程中,有极其重要作用[9,10]。因此,一个NLRP3炎性体缺损的免疫细胞模型,特别是NLRP3炎性体缺损的巨噬细胞模型,对于探究免疫细胞中NLRP3炎性体活化途径及其介导的炎症信号转导是急需的。所以,本研究利用shRNA(small hairpin RNA)介导的基因沉默策略,设计并筛选靶向小鼠NLRP3基因的有效shRNA序列,并构建带GFP荧光和Neomycin抗性的双标记RNA干扰载体(靶向小鼠NLRP3基因的shRNA表达载体)[11,12]。该载体稳定转染小鼠巨噬细胞RAW264.7后,通过GFP荧光标记和G418抗性筛选NLRP3基因稳定沉默的巨噬细胞克隆,即NLRP3炎性体缺损的小鼠巨噬细胞模型,这将为进一步探究NLRP3炎症小体在巨噬细胞炎症反应中的作用,特别是NLRP3炎症体活化及其介导的炎症信号转导打下基础。
1 材料与方法
1.1材料 人胚肾细胞系HEK293T、小鼠巨噬细胞系RAW264.7,由北京中医药大学免疫与病原微生物实验室保存。反转录试剂盒、DNA内切酶、DNA连接酶、DNA Ladder、原核感受态细胞DH-5α均购自TaKaRa公司。RNA提取试剂(TRIZOL)、核酸转染试剂(Lipofectamine2000)以及真核细胞抗生素G418,均购自Invitrogen公司。高保真DNA聚合酶(KOD FX Neo)、SYBgreen荧光定量PCR试剂盒,购自ToYoBo公司。PCR引物采用Primer 5.0设计,并由生工生物工程(上海)股份有限公司合成。
1.2方法
1.2.1细胞培养 HEK293T及RAW264.7细胞接种在含10%胎牛血清的高糖DMEM培养基中,37℃、5%CO2饱和湿度细胞培养箱中无菌培养。
1.2.2shRNA设计 利用shRNA设计软件(OligoEngine Workstation 2),对小鼠NLRP3编码基因(UCSC:uc007jei.1,1-3102 bp)序列进行了扫描,从候选shRNA序列中挑选出4个靶点区二级结构简单,特异性高且GC含量合理shRNA序列(表1、图1A)。
1.2.3shRNA表达载体的构建及鉴定 根据设计好的shRNA序列合成对应的可以互补的寡核苷酸单链,两端分别引入BamHⅠ和XhoⅠ酶切位点,将可以互补的两条寡核苷酸链(终浓度各120 ng/μl)在退火缓冲液(10 mmol/L Tris-HCl,pH7.5~8.0,50 mmol/L NaCl,1 mmol/L EDTA)中,按程序(95℃ 3 min,94℃降到25℃且保持每90 s降低一度)在PCR仪中退火后形成带黏末端的双链DNA,连接到pGH1表达载体的pGH1表达载体的H1启动子(human H1 RNA promoter)的下游(利用BgLⅡ,XhoⅠ酶切位点插入),构建成可以稳定持续表达目的shRNA的真核表达载体(图 1B),并对构建的4个shRNA表达载体分别进行测序鉴定,以保证插入shRNA表达载体的shRNA编码序列正确如设计。构建的含靶向NLRP3基因shRNA编码框的干扰载体分别命名为pGH1-shRNA398、pGH1-shRNA 556、pGH1-shRNA11-69和pGH1-shRNA1832。
表1设计合成的引物
Tab.1Primersdesignedandsynthesizedinthisstudy

PrimersSequence(5′to3′)sh398_topGATCCccGCAGGAGCGGGAGCATGAATTCAAGAGATTCATGCTCCCGCTCCTGCTTTTTggaaCsh398_botTCGAGttccAAAAAGCAGGAGCGGGAGCATGAATCTCTTGAATTCATGCTCCCGCTCCTGCggGsh556_topGATCCccCCATCCTAGCCAGGAAGATTTCAAGAGAATCTTCCTGGCTAGGATGGTTTTTggaaCsh556_botTCGAGttccAAAAACCATCCTAGCCAGGAAGATTCTCTTGAAATCTTCCTGGCTAGGATGGggGsh1169_topGATCCccGACCACTACGGCCGTCTACTTCAAGAGAGTAGACGGCCGTAGTGGTCTTTTTggaaCsh1169_botTCGAGttccAAAAAGACCACTACGGCCGTCTACTCTCTTGAAGTAGACGGCCGTAGTGGTCggGsh1832_topGATCCccCCTCTCTACCAGAATGGACTTCAAGAGAGTCCATTCTGGTAGAGAGGTTTTTggaaCsh1832_botTCGAGttccAAAAACCTCTCTACCAGAATGGACTCTCTTGAAGTCCATTCTGGTAGAGAGGggGH1scan⁃FTATCTTAACGCGTGAATTCGAACGCTGACH1scan⁃RATATTAACGCTTACAATTTACGCGTAAGCNLRP3CDS⁃FaatAAGCTTGccAccATGACGAGTGTCCGTTGCAAGCTGGCTCNLRP3CDS⁃RaatCTCGAGCCAGGAAATCTCGAAGACTATAGTCAGCqR_NLRP3⁃FATCTTTGCTGCGATCAACAGGCGqR_NLRP3⁃RCGCGTTCCTGTCCTTGATAGAGTqR_GAPDH⁃FggtgaaggtcggtgtgaacgqR_GAPDH⁃Rctcgctcctggaagatggtg
1.2.4小鼠NLRP3基因克隆以及NLRP3-GFP融合表达载体的构建 用RNA提取试剂(Trizol),按使用说明收集培养的RAW264.7细胞分离总RNA,提取的RNA经DNA酶消化处理后测定浓度。取约1 μg RNA,用Oligo d(T)18引物,按反转录试剂盒(TaKaRa)的操作说明,合成20 μl cDNA溶液。取1 μl 的cDNA溶液作为模板,加引物NLRP3CDS-F(10 μmol/L)和NLRP3CDS-R(10 μmol/L)各0.5 μl,在25 μl体系中进行PCR 扩增。PCR 条件如下:先95℃预变性 4 min,然后扩增32个循环(94℃ 30 s,58℃ 30 s,72℃ 80 s)后,于72℃延伸6 min,4℃保存。获得的PCR产物经1%琼脂糖凝胶电泳分离后,按胶回收试剂盒(TaKaRa)说明,割胶回收约1 500 bp的NLRP3基因条带。回收的PCR片段经HindⅢ和XhoⅠ双酶切后,连接到同酶切的pCMVGFP载体上构建成NLRP3-GFP融合表达重组载体(pCMVGFP-NLRP3),并送上海生工测序鉴定。
1.2.5shRNA有效性检测 以pGH1-shRNA398、pGH1-shRNA556、pGH1-shRNA1169和pGH1-shRNA 1832重组质粒为模板,用引物H1scanF和H1scanR,PCR分别扩增出含H1启动子的shRNA表达框片段。将扩增的4个shRNA表达框片段,分别与pCMVGFP-NLRP3载体(前面构建的NLRP3基因与EGFP融合表达载体)共转染人HEK293T细胞,转染72 h后,收集细胞利用流式细胞仪分析各组细胞的GFP表达情况,筛选出能抑制NLRP3基因表达的最佳shRNA序列(由于NLRP3与GFP是融合表达的,共转染细胞的GFP表达越少代表shRNA对NLRP3表达的抑制能力越强)。
1.2.6shRNA表达载体转染RAW264.7细胞及NLRP3稳定敲低细胞的分选和富聚 稳定转染之前,需先确定G418药物对RAW264.7细胞的最小致死浓度,其过程大致如下:首先将RAW264.7细胞按每孔1×105个细胞的密度接种到24孔板中,每个浓度设置2个复孔,并依次加入适量G418抗生素,使细胞培养孔中G418终浓度分别为0、50、100、200、400、600、800、1 000、1 200、1 500 μg/ml。连续培养7 d并观察细胞的生长情况,1周之内巨噬细胞完全死亡的G418浓度为800 μg/ml,将其作为后续稳定转染细胞的药物筛选参考浓度。
稳定转染时,先将正常的RAW264.7细胞接种到6孔板中,待细胞浓度长至70%~80%时用转染试剂Lipofectamine 2000按操作说明,将酶切线化处理的shRNA表达载体(事先用ApaLⅠ酶切并纯化)稳定RAW264.7细胞,转染24 h后将转染孔细胞消化,1∶10稀释后,接种到24孔板并换G418(800 μg/ml)抗性培养基培养,7 d后更换为G418(600 μg/ml)维持培养基继续筛选。待抗性克隆细胞生长到量足够多时,消化各孔细胞并混合,PBS离心清洗后,利用GFP标记通过流式细胞仪进一步纯化和富聚稳定转染的细胞,得到的混合克隆细胞(命名为RAWNKD),即NLRP3稳定敲低缺损NLRP3炎性体的小鼠巨噬细胞系(图 2)。
1.2.7小鼠NLRP3基因稳定敲低巨噬细胞系的鉴定 将RAW264.7巨噬细胞和建立的RAWNKD巨噬细胞分别接种到6孔板中,两种细胞分别设置,非刺激对照组、LPS(脂多糖)+ATP(三磷腺苷)联合刺激组,每组3个重复。待细胞浓度长至70%~80%,对照组不做处理,刺激组加LPS(终浓度1 μg/ml)刺激4 h后再加入ATP(终浓度5 mmol/L)共刺激0.5 h。去除培养基并用PBS清洗各组各孔细胞2次,每空加1 ml的TRIZOL试剂裂解细胞分离纯化各孔细胞总RNA,测定浓度备用。提取的各孔RNA经DNA酶消化处理后,按反转录试剂盒(ToYoBo)的操作说明,取适量RNA配制逆转录体系(10 μl反转录体系中加入RNA 1 μg,5×RT Buffer 2 μl,RT Enzyme Mix 0.5 μl,Primer Mix 0.5 μl,Nuclease-free Water补足到10 μl),按程序(37℃ 30 min,98℃ 5 min)合成cDNA,各组cDNA加入90 μl 去离子水(即10倍稀释)备用。按qPCR试剂盒(ToYoBo)的操作说明,取1μl稀释的cDNA为模板,以小鼠GAPDH基因为内参,用引物qR_NLRP3-F和qR_NLRP3对各组细胞NLRP3基因的mRNA水平进行相对定量分析。
1.3统计学分析 每个研究至少重复2次,每组3个平行样品,结果数据为平均值。采用χ2检验确定数据的统计学差异,P<0.05为差异有统计学意义。
2 结果
2.1靶向小鼠NLRP3基因的最佳shRNA序列及对应的shRNA表达载体 OligoEngine公司的small interference RNA(siRNA)预测评估软件(OligoEgine Workstation 2)是一个基于NCBI(National Center of Biological information)数据库的siRNA预测分析软件。它可以在候选序列中找到高物种特异性,高抑制效果且GC含量合理的siRNA序列,并可以对siRNA靶点所在二级结构进行预测和实时展示,这是高效siRNA序列低空间位阻的重要参考依据,并可自动生成shRNA序列,本文中设计的4个靶向NLRP3基因的shRNA序列就在低二级结构的区域(图 1A)。利用PCR方法获得包含H1启动子的shRNA表达框片段与pCMVGFP-NLRP3载体(测序确认正确的,NLRP3基因与EGFP融合表达)共转染人HEK293T细胞,流式细胞仪上的GFP表达分析显示(图 1C、D),能抑制NLRP3基因表达的最佳shRNA序列为5′-GACCACTACGGCCGTCTAC-3′,而包含该shRNA编码框的双标记表达载体为pGH1-sh1169。

图1 靶向NLRP3基因的shRNA设计及有效shRNA的筛选Fig.1 Design and selection of effective shRNAs targetting mouse NLRP3 geneNote:A.shRNA target sites in NLRP3 mRNA;B.Construction of the dual-marker shRNA expression vector containing a customized shRNA-coding frame;C.Comparison for percentage of GFP-positive cells;D.Histogram analysis of FACS (fluorescence-activated cell sorting) for shRNA-mediated inhibition of NLRP3-GFP fusion expression.The region (GFP+ cells) defines the GFP-positive cells.Compared with the negative control shRNA (shmock),shRNA (sh1169) is more efficient in inhibiting the fusion expression of NLRP3-GFP.
2.2联用GFP标记和Neomycin抗性标记快速筛选NLRP3基因稳定敲低的细胞 使用脂质体将ApaLⅠ线化的pGH1-sh1169 质粒转染RAW264.7细胞, 1 d后可见GFP荧光表达,但荧光比例并不高(RAW264.7细胞属于比较难转染的细胞类型)。改换G418抗性培养基筛选后,1周内大部分细胞死亡,约16 d时出现发荧光的G418抗性细胞,随后荧光细胞分裂且数量迅速增多。抗性细胞经流式分选富聚后,得到了GFP阳性率更高的稳定巨噬细胞群,命名为RAWNKD细胞(该细胞基因组稳定整合了外源的质粒DNA,所以可表达GFP标记和Neomycin抗性标记基因,且能在H1启动子的驱动下持续转录靶向NLRP3基因的shRNA)。这种RAWNKD巨噬细胞既能抵抗G418抗生素又带GFP标记(图2C),同时胞内持续转录的shRNA可稳定干扰沉默NLRP3基因表达。
2.3RAWNKD巨噬细胞系NLRP3基因的稳定敲低 如图2D所示,与正常的小鼠巨噬细胞RAW264.7相比,建立的RAWNKD细胞的NLRP3基因的mRNA几乎检测不到。即使用细菌脂多糖类似物LPS联合ATP来模拟体内感染和损伤刺激,RAWKDN细胞内NLRP3基因的mRNA水平上升也不明显,不仅低于正常巨噬细胞的NLRP3基因mRNA水平,也远远低于LPS刺激的正常巨噬细胞。
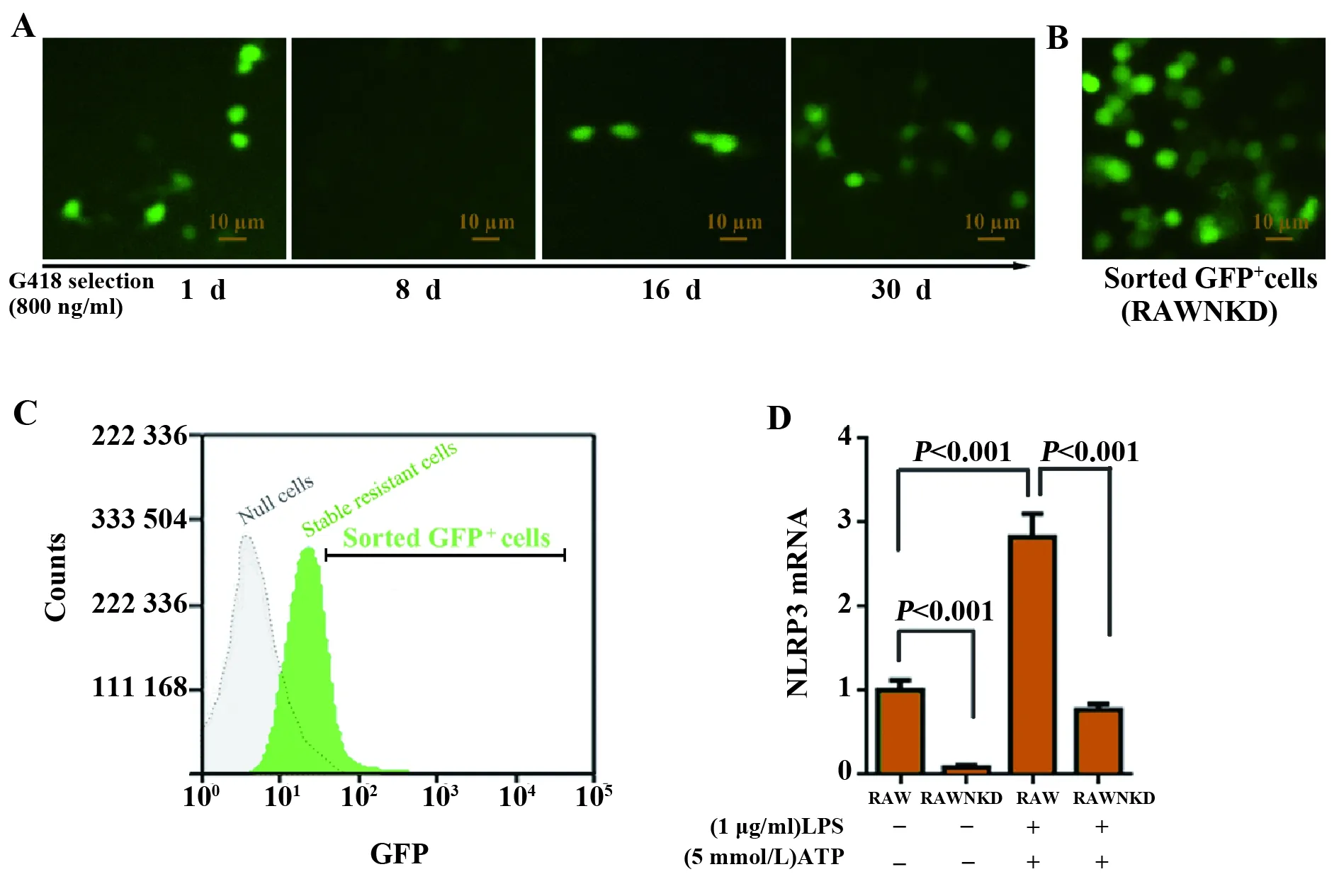
图2 稳定敲低NLRP3基因的巨噬细胞的筛选和鉴定Fig.2 Selection and identification of generated macropha-ges (RAWNKD) lacking NLRP3Note:A.GFP expression in transfected cells in the G418-contained medium;B.Observation for the GFP marker of the obtained RAWNKD cells;C.Definition of the GFP positive subset of G418-resistant cells.The gray histogram denotes the wild type macrophages,the green histogram indicates the G418-resistant macrophages,and the ‘Sorted GFP+ cells′ region defines the strong fluorescent cells,that is,the enriched subset (called RAWNKD);D.RT-qPCR analysis for the NLRP3 mRNA level in the RAWNKD and RAW cells.RAW.A wild type macrophage line RAW264.7;RAWNKD.The generated line whose NLRP3 were stably knocked down;LPS.Lipopolysaccharide;ATP.Three adenosine monophosphate.
这些结果说明,RAWNKD细胞的NLRP3基因被稳定敲低,缺少NLRP3基因会造成巨噬细胞NLRP3炎性体缺损,RAWNKD细胞也可认为是一种NLRP3炎性体缺损的巨噬细胞模型。
3 讨论
NLRP3分子是包括巨噬细胞在内的固有免疫细胞的一种重要胞内模式识别受体(PRR),与之相关的炎性体(NLRP3炎性体)在免疫反应,特别是过度炎症反应相关疾病的发生过程中,都有极其重要的作用[13-15]。NLRP3炎性体也因此成了近年来研究最多的炎症小体。当巨噬细胞受外源或内源性刺激(PAMP或DAMP)而活化时,也伴随着胞内NLRP3分子及NLRP3炎症小体介导的白介素转化酶(Caspase-1)的活化,致使巨噬细胞分泌大量IL-1β和IL-18等促炎性细胞因子,从而加重和放大局部的炎症反应[16]。巨噬细胞已成为NLRP3炎性体相关炎症信号转导研究的常用免疫细胞模型。
本研究利用带双筛标记(GFP荧光和Neomycin抗性)的shRNA表达载体介导的靶基因沉默及快速筛选策略,建立了带GFP荧光标记的NLRP3基因稳定沉默的小鼠巨噬细胞模型(此处称为RAWNKD巨噬细胞)[17-19]。在某种意义上,这种RAWNKD细胞也可认为是一种NLRP3炎性体缺损的小鼠巨噬细胞模型(由于胞内炎性体支架蛋白NLRP3分子的缺乏,巨噬细胞在活化时胞内无法形成功能NLRP3炎性体)。此种类型的巨噬细胞模型,将为探究NLRP3炎症小体在巨噬细胞炎症反应中的作用,特别是NLRP3炎性体活化途径及其介导的炎症信号转导提供方便。
[1] 杨雪梅,吴 刚.苦参碱抑制LPS诱导巨噬细胞IL-1β、TNF-α分泌及机制研究[J].中国免疫学杂志,2016,33(6):820-824,837.
Yang XM,Wu G.Inhibitory effect of Matrine on IL-1β,TNF-α of macrophages induced by LPS[J].Chin J Immunol,2016,33(6):820-824,837.
[2] Sutterwala FS,Haasken S,Cassel SL.Mechanism of NLRP3 inflammasome activation[J].Ann N Y Acad Sci,2014,1319:82-95.
[3] 臧娅妮,韩秋菊,张 建.PRR信号通路调控巨噬细胞极化在免疫相关疾病中的作用研究进展[J].中国免疫学杂志,2017,33(8):1255-1258,1262.
Zang YN,Han QJ,Zhang J.Research progress on the role of PRR signaling pathway in regulating macrophage polarization in immune related diseases[J].Chin J Immunol,2017,33(8):1255-1258,1262.
[4] Jo EK,Kim JK,Shin DM,etal.Molecular mechanisms regulating NLRP3 inflammasome activation[J].Cell Mol Immunol,2016,13(2):148-159.
[5] Abderrazak A,Syrovets T,Couchie D,etal.NLRP3 inflammasome:From a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases[J].Redox Biol,2015,4:296-307.
[6] Latz E,Xiao TS,Stutz A.Activation and regulation of the inflammasomes[J].Nat Rev Immunol,2013,13(6):397-411.
[7] Giguère PM,Gall BJ,Ezekwe E,etal.G Protein signaling modulator-3 inhibits the inflammasome activity of NLRP3[J].J Biol Chem,2014,289(48):33245-33257.
[8] Wang W,Xiao F,Wan P,etal.EV71 3D protein binds with NLRP3 and enhances the assembly of inflammasome complex[J].PLoS Pathog,2017,13(1):e1006123.
[9] Youm YH,Grant RW,Mccabe LR,etal.Canonical Nlrp3 inflammasome links systemic low grade inflammation to functional decline in aging[J].Cell Metab,2013,18(4):519-532.
[10] Abais JM,Xia M,Zhang Y,etal.Redox regulation of NLRP3 inflammasomes:ROS as trigger or effector[J].Antioxid Redox Signal,2015,22(13):1111-1129.
[11] Nakashima Y,Abe N,Ito Y,etal.Nanostructured RNAs for RNA interference[J].Methods Mol Biol,2015,1218:17-36.
[12] Shegokar R,Al SL,Mishra PR.SiRNA delivery:challenges and role of carrier systems[J].Pharmazie,2011,66(5):313-318.
[13] Franchi L,Muoz-Planillo R,Núez G.Sensing and reacting to microbes through the inflammasomes[J].Nat Immunol,2012,13(4):325-332.
[14] Sutterwala FS,Haasken S,Cassel SL.Mechanism of NLRP3 inflammasome activation[J].Annals N Y Acad Sci,2014,1319(1):82-95.
[15] Kankkunen P,Valimaki E,Rintahaka J,etal.Trichothecene mycotoxins activate NLRP3 inflammasome through a P2X7 receptor and Src tyrosine kinase dependent pathway[J].Hum Immunol,2014,75(2):134-140.
[16] Ataide MA,Andrade WA,Zamboni DS,etal.Malaria-induced NLRP12/NLRP3-dependent caspase-1 activation mediates inflammation and hypersensitivity to bacterial superinfection[J].PLoS Pathog,2014,10(1):e1003885.
[17] Hu D,Wu J,Xu L,etal.A method for the establishment of a cell line with stable expression of the GFP-LC3 reporter protein[J].Mol Med Rep,2012,6(4):783-786.
[18] Fischer SE.RNA interference and microRNA-mediated silencing[J].Curr Protoc Mol Biol,2015,112:21-26.
[19] Lam J,Chow M,Zhang Y,etal.siRNA versus miRNA as therapeutics for gene silencing[J].Mol Ther Nucleic Acids,2015,4(9):e252.