IL-21/BCL-6/Blimp-1在囊性包虫病中的表达特点研究①
耿新惠 张峰波 姜 敏 赵 慧 安梦婷 庞楠楠 王红英 丁剑冰
(新疆医科大学第二附属医院检验科,乌鲁木齐 830063)
包虫病(Echinococcosis),又称棘球蚴病,是细粒棘球绦虫的幼虫感染人体所致的疾病。牧区较多见[1],包虫感染后,参与机体免疫反应的因子有很多,以往我们研究过Th1细胞相关因子、Th2细胞相关因子、Th17细胞相关因子和Treg细胞,一般以Th1/Th2细胞的失衡来评价感染状况[2-4]。目前认为CD4+T细胞新亚群、滤泡辅助性T细胞 (Follicular helper T Tfh)可通过调节B细胞介导体液免疫反应,辅助B细胞占主导地位的T细胞亚群[5,6]。据文献报道,Tfh及其相关分子同样参与寄生虫感染后体液免疫应答[7]。调节Tfh细胞的辅助因子有很多。白介素-21(Interleukin-21,IL-21)主要由Tfh细胞分泌,除了作为刺激B细胞的“辅助细胞因子”外,还是Tfh自分泌细胞因子。IL-21参与了自身免疫病和免疫缺陷的发病机制,并在丝虫病、疟疾及利什曼病的相关研究中也发现了一定作用。很可能成为治疗这些疾病的重要靶分子。B细胞淋巴瘤分子6(B cell lymphoma 6,BCL-6)是调控初始 T 细胞发育为 Tfh 细胞所必需的,且是 Tfh 细胞分化的充分必要条件[8],其表达增高有利于 Tfh 细胞相关分子的表达,B淋巴细胞诱导成熟蛋白1(B lymphocyte-induced maturation protein-1,Blimp-1)是 B 淋巴细胞终极分化的主要调控子,是 Tfh 细胞的关键抑制因子,Blimp-1 的表达能阻止BCL-6 的表达和 Tfh 细胞的分化,并不会抑制Th1、Th2、Th17、Treg 等其他CD4+T 细胞的分化。这3种因子的表达变化在一定程度上反映了 Tfh细胞免疫应答状态[9,10]。BCL-6 通过与抑制性转录因子Blimp-1 的相互作用改变初始 CD4+T 细胞在Tfh细胞与Th1细胞、Th2细胞、Th17细胞、Treg细胞间的转换,调节机体免疫平衡,参与多种感染性疾病的发生。但是这3种因子在包虫病感染中的作用目前尚不清楚。因此,本次研究采用ELISA和RT-PCR法对CE患者血浆中IL-21水平及外周血单个核细胞(PBMC)中IL-21 mRNA、BCL-6 mRNA、Blimp-1 mRNA进行检测,探讨这几种因子在CE病程中的变化特点,为CE的病因分析和临床治疗提供实验基础。
1 材料与方法
1.1材料
1.1.1研究对象 收集2016年6~12月新疆医科大学第一附属医院住院确诊的CE患者27例,全部为肝脏感染病例,处于活动期,年龄在20~55岁之间,排除具有自身免疫性疾病患者。以30名健康体检者作为对照组。对照组要求无肝病,无自身免疫性疾病,近期无感染。影像学未检出包虫特殊影像。手术治疗组,追踪17例行手术摘除包囊患者,术后3个月复查影像学和血清学,均为阴性者收纳为治疗后组。所有受试者要求早晨空腹抽取外周静脉血约9 ml,一部分以EDTA抗凝,无溶血。一部分无抗凝,用于分离血清。
1.1.2试剂与仪器 ELISA试剂盒购自上海生工生物工程技术有限公司;RT-PCR 试剂盒购自德国Qiagen公司;Trizol 试剂购自美国Invitrogen公司;目的基因及内参引物均由上海生物工程技术有限公司合成。
1.2方法
1.2.1标本采集 肝包虫病患者入院后于次日清晨空腹抽取EDTA抗凝血约5 ml,用于分离外周血单个核细胞(PBMC)并从中提取总RNA 。同时抽取4 ml未抗凝血,离心取血清,于-70℃保存用于检测IL-21。
1.2.2ELISA法检测血清中IL-21浓度 取出冷冻血清,复溶至室温。严格按照试剂盒操作步骤进行。酶标仪波长设置为450 nm,读吸光度(OD)值,根据标准曲线计算 IL-21 的浓度值。
1.2.3实时荧光定量PCR(qRT-PCR)法检测CE患者及健康对照外周单个核细胞中Blimp-1/BCL-6/IL-21 mRNA 表达情况 按照试剂盒说明提取总RNA后用核酸蛋白分析仪测定其纯度,确定是否达到反转录要求,将合格标本逆转录合成 cDNA。实时荧光定量PCR反应条件为:预变性95℃ 10 min,95℃ 15 s,59℃ 1 min ,40 个循环。计算 CE 组和健康组患者三种 mRNA 表达量,重复3 次取平均值。结果分析 :采用2-ΔΔCT相对定量法,测定特定荧光域值对应循环数的CT值 ,对目标基因进行定量分析。
引物设计和合成:从 Gene Bank中检索人IL-21、BCL-6、Blimp-1 mRNA 基因引物序列,用 DNAMAN 软件设计引物 ,引物由上海生工生物公司合成,见表1。
1.3统计学处理 所有数据应用SPSS17.0统计软件处理,分析采用成组t检验,结果以P值表示,指标间相关性用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1qRT-PCR法检测 Blimp-1、IL-21和BCL-6mRNA表达量
表1引物列表
Tab.1Listofprimers

PrimersSequence(5′to3′)IL⁃21_FACACAGACTAACATGCCCTTCAIL⁃21_RACCGTGAGTAACTAAGAAGCAAATCBCL⁃6_FGGAAACCCAGTCAGAGTATTCGBCL⁃6_RCACATTTGTAGGGCTTTTCTCCBlimp⁃1_FTCCAGCACTGTGAGGTTTCABlimp⁃1_RTCAAACTCAGCCTCTGTCCA
2.1.1CE组和健康对照组的mRNA表达水平 利用qRT-PCR检测PBMC中相关因子表达,结果显示,CE组BCL-6 mRNA表达水平升高,是对照组的39.8倍,差异有统计学意义(P<0.01)。IL-21 mRNA表达水平升高,是对照组的10.1倍,差异有统计学意义(P<0.01)。 但是 Blimp-1 mRNA在人感染棘球蚴后体内表达水平变化不明显(P>0.05),无统计学意义,见表2。
2.1.2三种因子在CE患者治疗前和治疗后的mRNA表达水平 在CE患者中我们将最终跟踪到的17个治愈病例与治疗前患者Blimp-1/BCL-6/IL-21 mRNA结果相比较,三种因子的mRNA表达水平在手术治疗后均降低,差异有统计学意义(P<0.01),见表3。
2.2不同分组外周血IL-21水平的比较
2.2.1CE病例组和健康对照组中IL-21水平 利用 ELISA法检测CE组和健康组外周血清标本中IL-21水平,结果显示病例组IL-21表达量为(313.0±62.4)ng/L,而健康对照组表达量仅为(179.4±32.1)ng/L,两组差异有统计学意义(P<0.01),见图1。
2.2.2CE患者治疗前后外周血IL-21水平 利用 ELISA法检测CE组治疗前后外周血清标本中IL-21水平,结果显示治疗前IL-21表达量为(352.6±37.7)ng/L,而健康对照组表达量仅为(176.4±27.7)ng/L,两组差异有统计学意义(P<0.01),见图2。
表2两组IL-21BCL-6、BLIMP-1mRNA表达定量结果
Tab.2TwogroupsofIL-21/BCL-6/Blimp-1mRNAexpressionofquantitativeresults
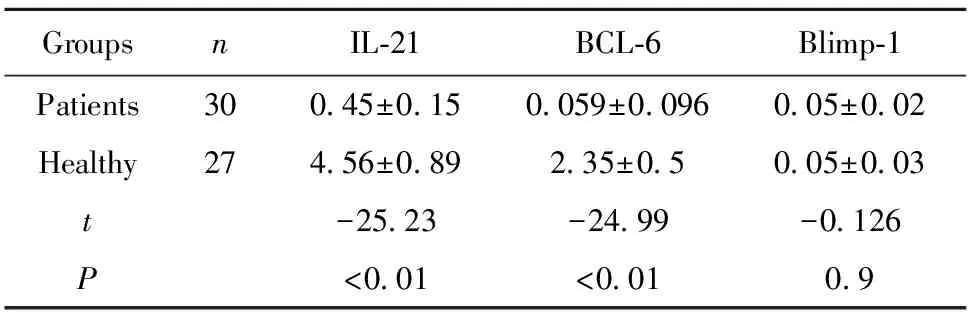
GroupsnIL⁃21BCL⁃6Blimp⁃1Patients300 45±0 150 059±0 0960 05±0 02Healthy274 56±0 892 35±0 50 05±0 03t-25 23-24 99-0 126P<0 01<0 010 9
表3CE患者治疗前后两组IL-21、BCL-6、Blimp-1mRNA表达水平定量结果
Tab.3BeforeandaftertreatmentinCEpatientswithtwogroupsofIL-21/BCL-6/Blimp-1mRNAexpressionlevelofquantitativeresults
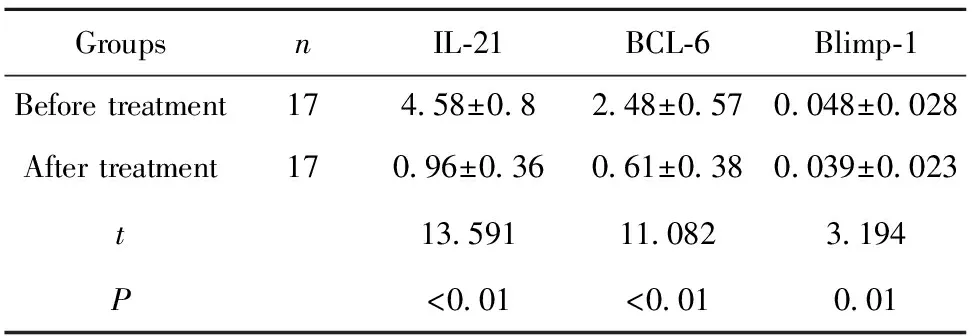
GroupsnIL⁃21BCL⁃6Blimp⁃1Beforetreatment174 58±0 82 48±0 570 048±0 028Aftertreatment170 96±0 360 61±0 380 039±0 023t13 59111 0823 194P<0 01<0 010 01
2.3相关性分析 将CE患者IL-21和Blimp-1、BCL-6 mRNA结果分别做Pearson直线相关性分析,如图3A~C显示IL-21与BCL-6的表达呈正相关(P<0.01),IL-21与Blimp-1不相关(P=0.179),并且BCL-6和Blimp-1的表达也不相关(P=0.157),分析结果见图3。
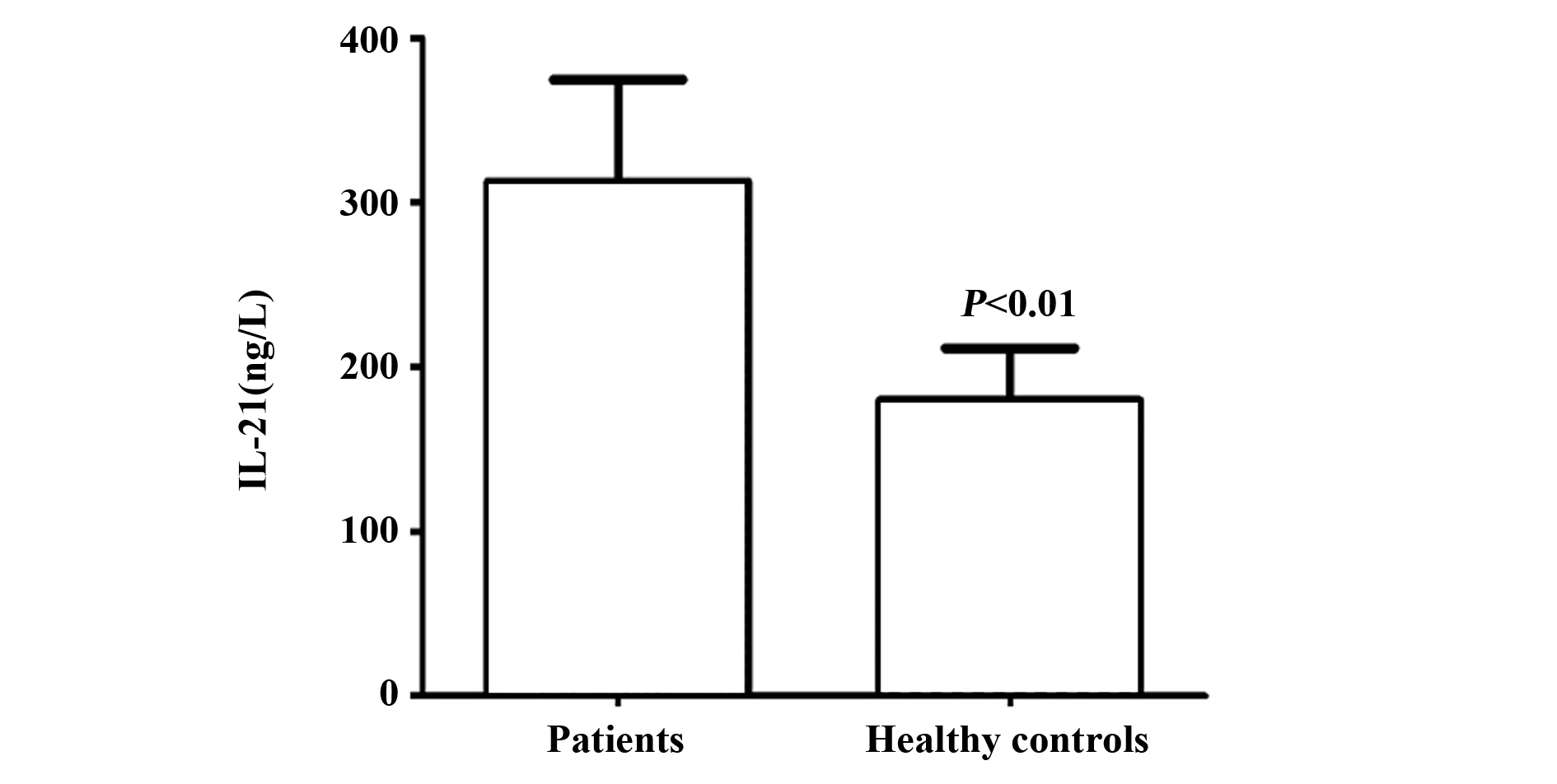
图1 CE病例组和健康对照组中IL-21水平比较Fig.1 CE cases and healthy controls level of IL-21
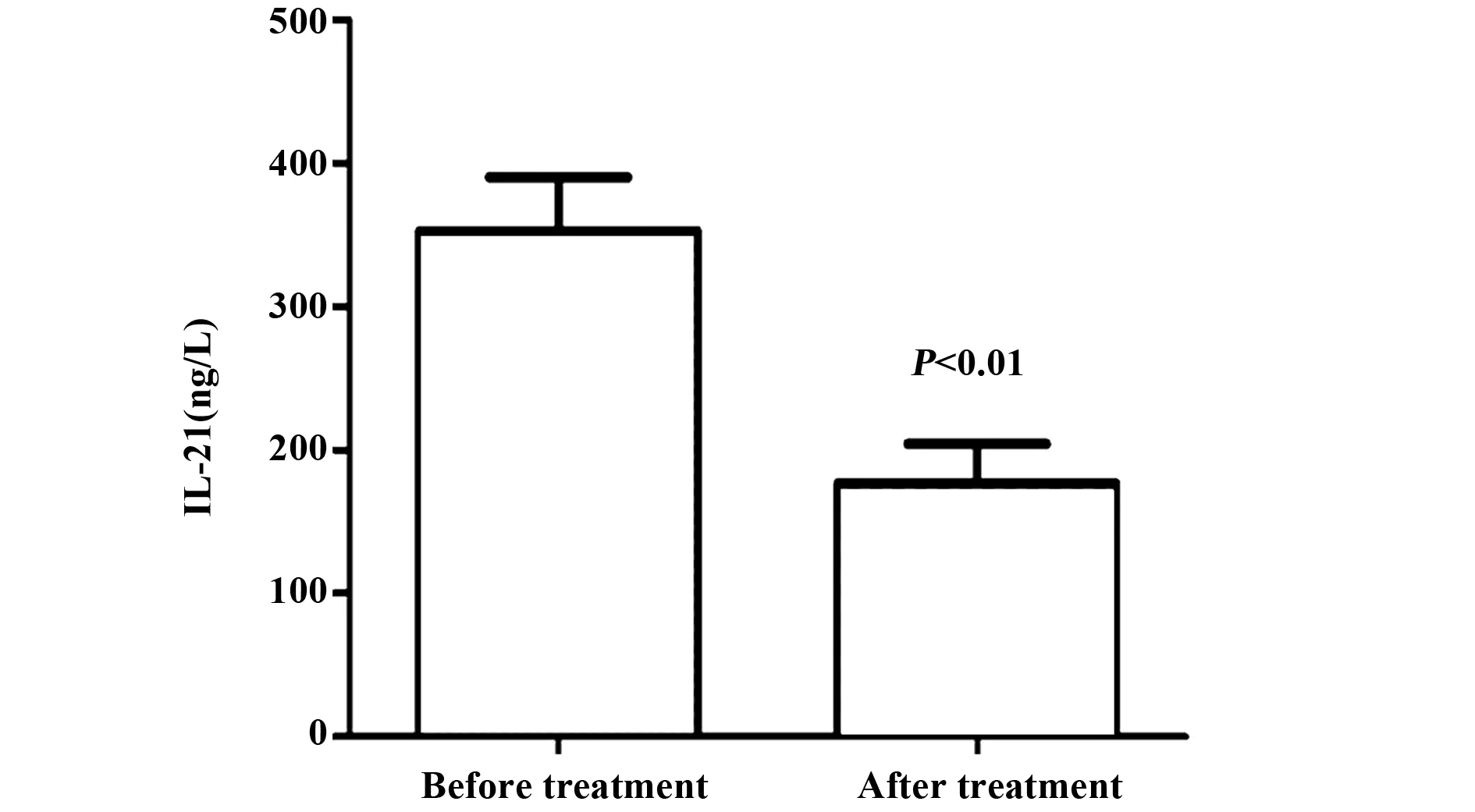
图2 CE患者治疗前后IL-21水平比较Fig.2 CE IL-21 levels before and after treatment
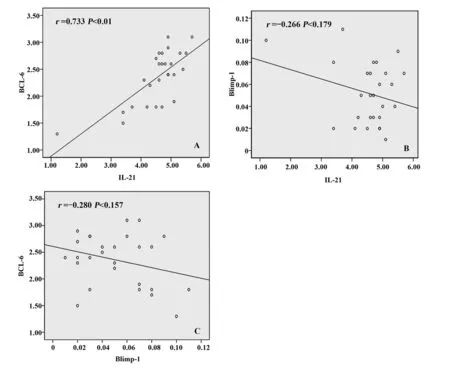
图3 三种因子的相关性分析Fig.3 Correlation analysis of three factorsNote:A.IL-21 and BCL-6;B.IL-21 and Blimp-1;C.Blimp-1 and BCL-6.
3 讨论
肝包虫病是由细粒棘球绦虫的蚴虫侵入肝脏所致,在中国主要流行于畜牧业发达的新疆、青海、宁夏、甘肃、内蒙古和西藏等省区是牧区常见病。包虫囊肿在肝内逐渐长大,可发生感染、破裂播散及空腔脏器阻塞等并发症,严重影响当地的生产和生活。人感染细粒棘球蚴后,体内原有免疫系统平衡被打破,在与包虫对抗的过程中逐渐建立起新的平衡,因此免疫系统在对抗包虫病的发生和发展中起着非常重要的作用[11]。前期研究发现慢性细粒棘球蚴感染过程中发生了Th1/Th2免疫失衡现象,以往认为,Th2细胞通过分泌IL-4刺激B细胞增殖和Ig类别转换[12],上调B细胞CD40和MHCⅡ类分子的表达,是辅助B细胞的主要T细胞[13]。现在越来越多的研究倾向于Tfh是辅助B细胞的主要T细胞亚群[14],而Th1和Th2所分泌的细胞因子在B细胞活化和Ig类别转换中只起到调节作用[15]。参与肝包虫免疫病理的因子大多数为CD4+T 细胞、也有CD8+T 细胞、B细胞、浆细胞以及巨噬细胞[16,17],其中CD4+T细胞主要为Tfh细胞,而Tfh细胞是T细胞分化和生存的重要信号[18]。IL-21是Tfh细胞分泌的主要细胞因子。能促进Tfh细胞的分化,调节B细胞和浆细胞分化,刺激免疫球蛋白的产生和类型转换,诱导BCL-6和Blimp-1的表达[19]。IL-21具有促炎作用,通过调节体液免疫参与肝包虫病的病程进展。在本次的研究中可以观察到CE患者感染棘球蚴的中晚期,在外周循环血中表达上调到基础水平的2倍左右,差异具有统计学意义。并在有效治疗后,下降到较低的水平,此水平与健康对照组基础水平基本一致。另外,我们做了IL-21和BCL-6及Blimp-1的相关性研究,在研究中发现IL-21与BCL-6呈正相关性。这与其他感染性疾病患者同样,BCL-6对Tfh细胞的表达有上调作用,而IL-21又是Tfh细胞的主要效应分子,由此我们可以推断出BCL-6、Tfh、IL-21是CE患者免疫反应中反馈调节的轴心[20]。同时,我们在IL-21与Blimp-1相关性研究中发现,他们之间无必然联系。Blimp-1能促进B细胞向浆细胞转换从而调节抗体的释放。据报道[21],与其在B细胞中的功能不同,Blimp1可能并不是T细胞发挥抗寄生虫免疫的关键蛋白。Blimp1基因的表达常与T细胞反应不同步,即在T细胞受到抗原刺激后几天才能达到峰值[22]。我们在此次结果中观察到Tfh细胞的关键因子IL-21和Blimp-1产生量不一致的现象,有待于进一步研究。
BCL-6是Tfh 细胞的关键转录因子,可调控初始T细胞转化为Tfh细胞,进一步促进Tfh细胞表达趋化因子CXCR5,共刺分子ICOS[23],进而与 B细胞相互作用,BCL-6高表达能促进Tfh细胞相关基因的表达并且抑制Th1、Th17细胞的分化。据报道,人感染蠕虫后,淋巴器官表达标记为CXCR5和ICOS 的CD4+滤泡辅助性T细胞,感染后的Tfh 细胞表达转录因子BCL-6,分泌细胞因子IL-21,还表达GATA3,这是Th2分化的转录因子[24]。在本研究中发现CE患者体内高表达BCL-6,说明与其他寄生虫感染一样,BCL-6的转录控制了T细胞的分化与分泌,与包虫感染过程密不可分。
研究发现,CD4+T细胞中的非Tfh细胞的细胞核中高表达Blimp-1[25],与Tfh细胞的转录因子BCL-6具有相互拮抗作用[26],同时B细胞中Blimp-1作为BCL-6的拮抗剂可抑制Tfh细胞分化,反之,BCL-6也抑制 Blimp-1表达,促进Tfh细胞分化。Tfh细胞数量和功能的异常使自身免疫失衡[27],在本研究中发现BCL-6和Blimp-1在疾病的发展中同时都升高,但不成正相关性,就本病来说,CE患者临床分型也较多,此次试验未做临床分型评价,或许两者之间在更细的范围内有很好的相关性,这在以后的实验当中可以进一步研究。
综上所述,我们探讨了CE病患者血清中IL-21、外周单个核细胞中IL-21、Blimp-1和BCL-6的mRNA表达水平,并在研究中发现,Tfh细胞亚群的相关因子BCL-6、Blimp-1、IL-21在CE病程中均升高,并随治疗后明显下降,这表明三种因子可能参与了细粒棘球蚴感染人体的免疫病程,尤其是BCL-6在T细胞分化及产生相关效应因子IL-21的过程中起到主要调节作用。本研究还明确了Tfh及其相关因子参与肝包虫的发病机制。为研究包虫病治病机制拓宽了思路。
[1] Zhang W,Zhang Z,Wu W,etal.Epidemiology andcontrol of echinococcosis in central Asia,with particular reference to the People′s Republic of China[J].Acta Trop,2015,141(Pt B):235-243.
[2] Rigano R,Buttari B,Profumo E,etal.Echinococcus granulosus antigen B impairs human dendritic cell differentiation and polarizes immature dendritic cell maturation towards a Th2 cell response[J].Infect Immun,2007,75(4):1667-1678.
[3] Yang Y,Ellis MK,Mc Manus DP,etal.Immunogenetics of human echinococcosis[J].Trends Parasitol,2012,28:447-454.
[4] Pang N,Zhang F,Ma X,etal.TGF-β/Smad signaling pathway regulates Th17/Treg balance during Echinococcus multilocu-larisinfection[J].Int Immunopharmacol,2014,20:248-257.
[5] 曹春宝,丁剑冰,马秀敏,等. 棘球蚴感染中的免疫逃避相关分子[J].中国病原生物学杂志,2008,3(10):788-791.
Cao CB,Ding JB,Ma XM,etal. Immune evasion associated with echinococcosis infection[J].J Pathogen Biol,2008,3(10):788-791.
[6] 李艳华,朱玥洁,朱 明,等. 感染免疫中ICOS/PD-1在Treg细胞的表达及平衡[J].细胞与分子免疫学杂志,2012,28(11)1229-1123.
Li YH,Zhu YJ,Zhu M,etal.Expression and balance of ICOS/ pd-1 in Treg cells in infection[J].Chin J Cell Mol Immunol,2012,28(11):1229-11231.
[7] 柏立欣,张子宁,付雅静,等. HIV感染者不同亚群T细胞IL-21及IL-21受体表达研究[J].中国免疫学杂志,2013,29(3):255-259.
Bo LX,Zhang ZN,Fu YJ,etal. The expression of IL-21 and IL-21 in different subgroups of hiv-infected patients was studied[J].Chin J Immunol,2013,29(3):255-259.
[8] Bentebibel SE,Lopez S,Obermoser G,etal.Induction of ICOS+CXCR3+CXCR5+TH cells correlates with antibodyresponses to influenza vaccination[J].Sci Transl Med,2013,5:176ra132.
[9] Cubas RA,Mudd JC,Savoye AL,etal.Inadequate T follicular cell help impairs B cell immunity during HIV infection[J].Nat Med,2013,19:494-499.
[10] 赵 慧,庞楠楠,马海梅,等. 泡球蚴感染中Tregs与Th17细胞相关细胞因子的平衡变化[J].中国病原生物学杂志,2012,7(2):129-132.
Zhao H,Pang NN,Ma HM,etal.The balance of cytokines in Tregs and Th17 cells in cysticercosis infection[J].J Pathogen Biol,2012,7(2):129-132.
[11] Zhang FB,Pang NN,Zhu YJ,etal.CCR7loPD-1hiCXCR5+CD4+T cells arepositively correlated with levels of IL-21 inactive and transitional cystic echinococcosis patients[J].BMC Infect Dis,2015,15:457.
[12] La XL,Zhang FB,Li YH,etal. Upregulation of PD-1 on CD4+CD25+T cells is associated with immunosuppression in liver of mice infected with Echinococcus multilocularis[J].Int Immunopharmacol,2015,26(2):357-366.
[13] 龚巧巧,朱玥洁,庞 盼,等. Blimp-1和Bcl-6在不明原因复发性流产患者蜕膜组织中表达增强[J]. 细胞与分子免疫学杂志,2016,32(7): 963-967.
Gong QQ,Zhu YJ,Pang P,etal.Blimp-1 and BCL-6 were expressed in decidual tissue of patients with recurrent miscarriage[J].Chin J Cell Mol Immunol,2016,32(7): 963-967.
[14] 段春巧,杨雯雯,雷玲彦,等. Bcl-6/Blimp-1/IL-21在原发性干燥综合征中的致病作用[J].中国免疫学杂志,2015,31(3):384-388,392.
Duan CQ,Yang WW,Lei LY,etal.The pathogenic role of bcl-6 /Blimp-1/il-21 in primary dry syndrome[J].Chin J Immunol,2015,31(3):384-388,392.
[15] 张丽娜,杨 晶,张峰波,等. 滤泡辅助性T细胞与寄生虫感染的关系[J].中国病原生物学杂志,2013,8(7):664-665,671.
Zhang LN,Yang J,Zhang FB,etal.Relationship between follicular assisted T cells and parasitic infection[J].J Pathogen Biol,2013,8(7):664-665,671.
[16] Crotty S,Johnston RJ,Schoenberger SP,etal. Effectors and memories:Bcl-6 and Blimp-1 in T and B lymphocyte differentiation[J].Nat Immunol,2010,11:114-120.
[17] Feng JY,Lu L,Hua C,etal. High frequency of CD4+CXCR5+TFH cells in patients with immune-active chronic hepatitis [J] PLoS One,2011,6:e21698.
[18] Liang HE,Reinhardt RL,Bando JK,etal.Divergent expression patterns of IL-4 and IL-13 define unique functions inallergic immunity[J].Nat Immunol,2012,13(1):58-66.
[19] He J,Tsai LM,Leong YA,etal.Circulating precursor CCR7(lo)PD-1(hi) CXCR5+CD4+T cells indicate Tfh cell activity and promoteantibody responses upon antigen reexposure[J].Immunity,2013,39:770-781.
[20] Eto D,Lao C,Di Toro D,etal.IL-21 andIL-6 are critical for different aspects of B cell immunity and redundantlyinduce optimal follicular helper CD4 T cell (Tfh) differentiation[J].PLoS One,2011,6:e17739.
[21] Linterman MA,Beaton L,Yu D,etal.IL-21 acts directly on B cells to regulate Bcl-6 expression and germinalcenter responses[J].Immunity,2010,207:353-363.
[22] Oestreich KJ,Mohn SE,Weinmann AS,etal.Molecular mechanisms that control the expression and activity of Bcl-6 in TH1 cells to regulate flexibility with a TFH-like gene profile[J].Nat Immunol,2012,13:405-411.
[23] Hollister K,Kusam S,Wu H,etal.Insightsinto the role of Bcl6 in follicular Th cells using a new conditional mutantmouse model[J].J Immunol(Baltimore,Md:1950),2013,191:3705-3711.
[24] Choi YS,Yang JA,Yusuf I,etal.Bcl6 expressing follicular helper CD4 T cells are fate committed early and have the capacity to form memory[J].J Immunol (Baltimore,Md:1950),2013,190:4014-4026.
[25] 龚巧巧,朱玥洁,庞楠楠,等. CXCR5/IL-21/Bcl-6/ Blimp-1在不明原因复发性流产患者绒毛中的表达[J]. 新疆医科大学学报,2017,40(2): 146-150.
Gong QQ,Zhu YJ,Pang NN,etal.Expression of CXCR5/ il-21 / bcl-6 / Blimp-1 in villi of patients with recurrent spontaneous abortion [J].J Xinjiang Med Uni,2017,40(2): 146-150.
[26] 杨 帆,王 红,谭保平,等.白细胞介素21在小鼠病毒性心肌炎中的表达及其与抗ANT抗体的相关性[J].中国免疫学杂志,2015,31(4):453-455,461.
Yang F,Wang H,Tan BP,etal.Expression of interleukin-21 in viral myocarditis in mice and its correlation with antiant antibody[J].Chin J Immunol,2015,31(4):453-455,461.
[27] 曹 彦,吴冬梅,王心静,等. 肺结核患者外周血CD4+、CD8+T细胞Blimp-1表达下降[J].临床肺科杂志,2015,5(20):777-780.
Cao Y,Wu DM,Wang XJ,etal.The expression of CD4+,CD8+T cell Blimp-1 was decreased in patients with pulmonary tuberculosis[J].J Clin Pulmonary Med,2015,5(20):777-780.