磁敏感加权成像对帕金森病患者的诊断价值
马松华, 邹 丽, 王小乐, 邵雅楠, 江齐群, 张玲玲, 陆健美
1. 南通市第二人民医神经内科,南通 226002 2. 如皋市人民医院神经内科,如皋 226500 3. 南通市第二人民医院影像科,南通 226002
帕金森病(Parkinson disaese, PD)是一种中老年人常见的神经系统变性疾病,在60岁以上人群中发病率为1 000/10万,且发病率随年龄增长而逐渐升高[1-3]。PD主要的病理改变是黑质多巴胺能神经元大量变性丢失,病因不明,可能与年龄、环境、遗传、氧化应激、线粒体功能缺损、泛素-蛋白酶体功能异常等有关[4]。其中,铁代谢紊乱可造成过多的铁在中脑和基底节区沉积,诱发氧化应激产生有毒的自由基,最终导致神经细胞凋亡而诱发PD[5]。因此,本研究采用磁敏感加权成像(susceptibility weighted imaging, SWI)技术检测PD患者的脑铁含量及变化,以期探讨其对PD的诊断价值。
1 资料与方法
1.1 一般资料 选取2015年1月至2016年12月在南通市第二人民医院门诊及住院诊治的PD患者30例(PD组)。其中,男性16例,女性14例;年龄45~85岁,平均(68.8±7.6)岁。所有PD患者均符合英国脑库标准,病程3~12年。按Hoehn-Yahr分级,其中Ⅰ级5例,Ⅱ级6例,Ⅲ级9例,Ⅳ级10例。选择健康志愿者30例为对照组(NC组),其中男性16例,女性14例;年龄45~80岁,平均(65.8±8.6)岁。
1.2 MRI检查方法 采用GE 3.0 T磁共振成像系统,所有受试者均完成T1WI、T2WI、FLAIR、SWI扫描。SWI参数设置:重复时间(TR)/回波时间(TE)34.0 ms/20.0 ms,视野(FOV)24 mm,矩阵 448×448,层厚2.0 mm,带宽41.67 Hz,间距0,翻转角度15°。图像与数据处理:将扫描所获图像传入GE软件分析系统,在SWI序列轴位图上测量基底节区(苍白球、壳核、尾状核)及中脑核团(红核、黑质网状带、黑质致密带)的相位值,每一部位测量2次,同一部位测量双侧,取其平均值,所有区域相位值均采用盲法测量,由2位高年资的影像科医师独立测量3次,取平均值。
2 结 果
2.1 PD组和NC组SWI信号特点 SWI结果(图1)表明:基底节区及中脑各个核团均为均匀的低信号,PD组低信号较NC组更明显,边界更清晰,提示PD组脑铁含量更高。
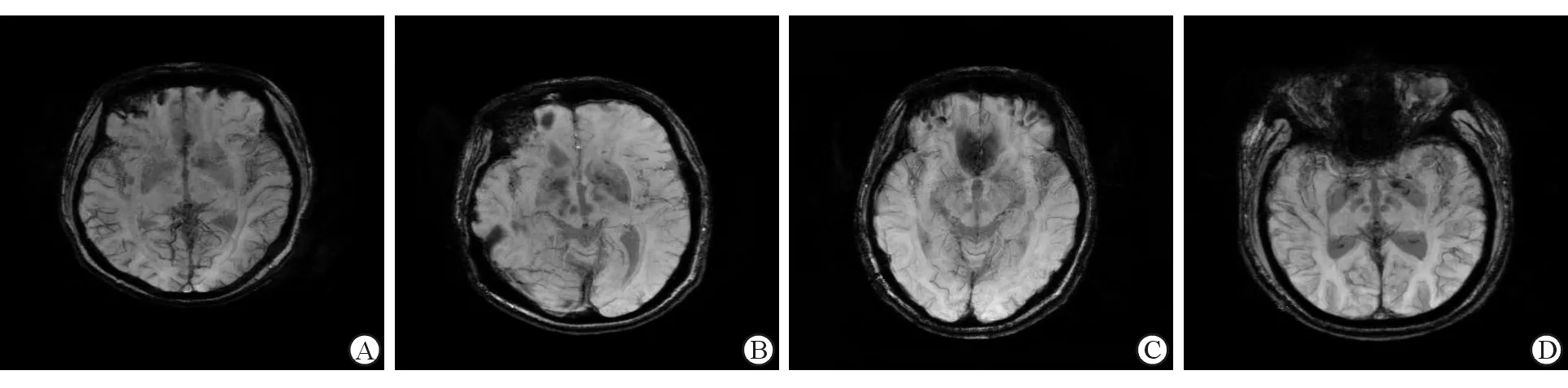
图1 健康人与PD患者SWI图像特点
2.2 两组各核团相位值比较 结果(表1)表明:PD组与NC组黑质致密带、壳核、尾状核和苍白球的相位值差异均有统计学意义(P<0.01);PD组与NC组红核和黑质网状带的相位值差异无统计学意义。
2.3 不同分级PD患者核团相位值比较 结果(表2)表明:不同Hoehn-Yahr分级的PD患者黑质网状带、黑质致密带、壳核、苍白球的相位值差异均有统计学意义(P<0.01),且两两比较差异均有统计学意义(P<0.05);不同Hoehn-Yahr分级PD患者红核、尾状核相位值差异无统计学意义。
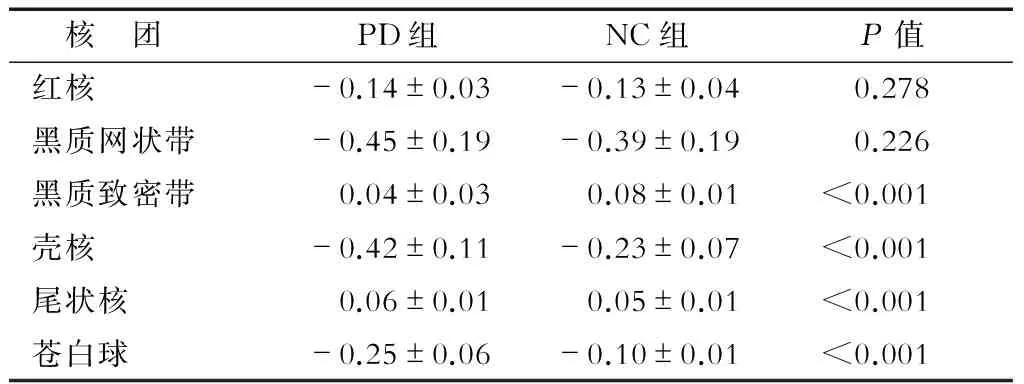
核 团PD组NC组P值红核-0.14±0.03-0.13±0.040.278黑质网状带-0.45±0.19-0.39±0.190.226黑质致密带0.04±0.030.08±0.01<0.001壳核-0.42±0.11-0.23±0.07<0.001尾状核0.06±0.010.05±0.01<0.001苍白球-0.25±0.06-0.10±0.01<0.001
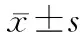
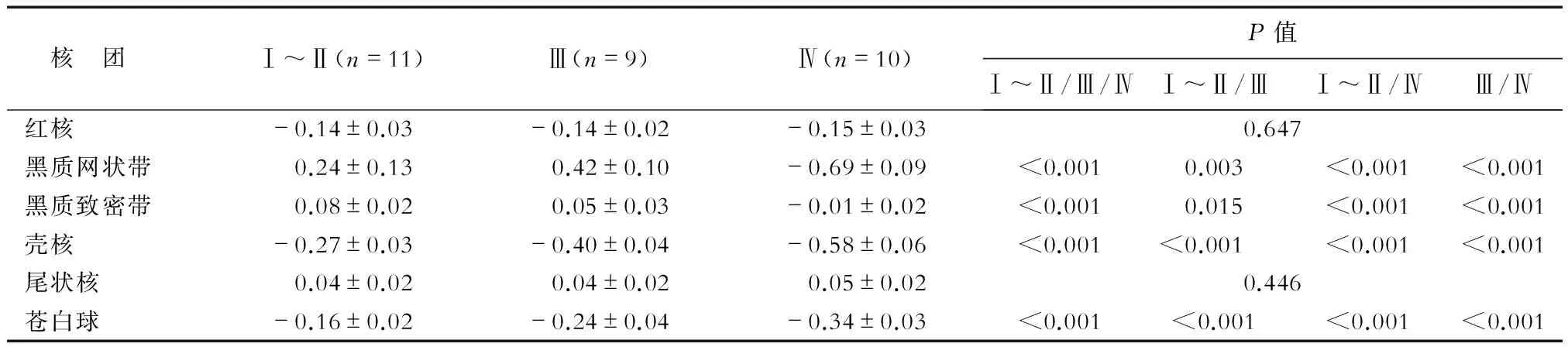
核 团Ⅰ~Ⅱ(n=11)Ⅲ(n=9)Ⅳ(n=10)P值Ⅰ~Ⅱ/Ⅲ/ⅣⅠ~Ⅱ/ⅢⅠ~Ⅱ/ⅣⅢ/Ⅳ红核-0.14±0.03-0.14±0.02-0.15±0.030.647黑质网状带0.24±0.130.42±0.10-0.69±0.09<0.0010.003<0.001<0.001黑质致密带0.08±0.020.05±0.03-0.01±0.02<0.0010.015<0.001<0.001壳核-0.27±0.03-0.40±0.04-0.58±0.06<0.001<0.001<0.001<0.001尾状核0.04±0.020.04±0.020.05±0.020.446苍白球-0.16±0.02-0.24±0.04-0.34±0.03<0.001<0.001<0.001<0.001
3 讨 论
目前,PD的早期诊断比较困难,PET或SPECT检测多巴胺转运体对早期诊断、鉴别诊断及病情监测有一定价值,但检查费用昂贵[4]。随着高磁场MRI技术的发展,通过SWI技术监测脑铁含量在PD的早期诊断及病情监测方面将有广阔的应用前景,为帕金森的诊断和治疗提供一种新的手段。
目前认为PD发病与环境因素密切相关。大量研究证实,PD患者的黑质和基底节的核团有大量的铁沉积[6]。MRI应用临床不久,便发现其图像变化与脑铁沉积有关[7]。与普通序列相比,SWI技术更加强调了组织间的磁敏感性差异,有利于观察较小的核团结构,提高了对脑铁含量测定的敏感性[8]。SWI技术能很好地显示非含铁和含铁两种组织之间磁敏感的差异性,尤其是经过处理后的校正相位图能很好地反映含铁组织导致的局部磁场不均匀引起的质子自旋相位的改变。在SWI图像上,PD患者脑铁含量与相位值负相关[9]。本研究结果显示,PD患者黑质致密带、壳核和苍白球相位值较NC组明显下降,表明PD发生与上述部位脑铁异常沉积有关。其中,黑质铁增加会导致多巴胺神经元变性[4]。铁对中枢神经系统的毒性作用主要表现为铁参与氧化应激反应,增加羟自由基,破坏多巴胺神经元的细胞膜和细胞DNA,导致神经元变性和路易小体的形成,从而导致多巴胺生成减少[10]。苍白球和壳核相位值明显下降可能由黑质投射所致。病理结果也证实了苍白球和壳核脑铁含量增高,尤其以壳核为主[11]。本研究PD患者在早期(Hoehn-Yahr Ⅰ~Ⅱ级),黑质致密带、壳核和苍白球相位值已降低,随病情加重进一步降低,表明随着PD症状的加重,脑铁含量增加。
综上所述,SWI通过相位值的变化来判断PD患者黑质、壳核和苍白球的铁沉积情况,而铁沉积与患者病情的严重程度有关。SWI显示,PD患者的基底节区、中脑核团的相位值低于健康人,这对于PD的早期诊断及早期治疗有一定意义。本研究结果也为SWI技术对PD的诊断、鉴别诊断和病情评估的监测提供了理论依据。
[ 1 ] DE LAU L M, BRETELER M M. Epidemiology of Parkinson's disease[J].Lancet Neurol, 2006,5(6):525-535.
[ 2 ] 吴 曦,胡小吾.脑深部电刺激术治疗帕金森病的进展与展望[J].中国临床医学,2017,24(6): 833-838.
[ 3 ] 吴 曦,胡小吾.帕金森病功能神经外科发展历程及现状[J].中国临床医学,2017,24(6): 839-844.
[ 4 ] 吴 江.神经病学[M].2版.北京:人民卫生出版社, 2011:18-20.
[ 5 ] ANDERSEN H H, JOHNSEN K B, MOOS T. Iron deposits in the chronically inflamed central nervous system and contributes to neurodegeneration[J].Cell Mol Life Sci, 2014,71(9):1607-1622.
[ 6 ] OAKLEY A E, COLLINGWOOD J F, DOBSON J, et al. Individual dopaminergic neurons show raised iron levels in Parkinson disease[J]. Neurology, 2007,68(21):1820-1825.
[ 7 ] HAACKE E M, CHENG N Y, HOUSE M J, et al.Imaging iron stores in the brain using magnetic resonance imaging[J].Magn Reson Imaging, 2005,23(1):1-25.
[ 8 ] ZHANG J, ZHANG Y, WANG J, et al. Characterizing iron deposition in Parkinson's disease using susceptibility-weighted imaging: an in vivo MR study[J]. Brain Res, 2010,1330:124-130.
[ 9 ] THOMAS B, SOMASUNDARAM S, THAMBURAJ K, et al. Clinical applications of susceptibility weighted MR imaging of the brain-a pictorial review[J].Neuroradiology, 2008, 50(2): 105-116.
[10] CHUNG C Y,KHURANA V,AULUCK P K, et al.Identification and rescue of α-synuclein toxicity in Parkinson patient-derived neurons[J].Science, 2013,342(6161):983-987.
[11] SOFIC E, PAULUS W, JELLINGER K, et al. Selective increase of iron in substantia nigra zona compacta of parkinsonian brains[J].J Neurochem, 1991,56(3):978-982.

