不同温度糖氧剥夺对人神经母细胞瘤细胞表达小泛素样修饰蛋白化相关蛋白的影响
吕若宁,童媛媛,刘晋萍
深低温停循环(deep hypothermic circulatory arrest,DHCA)是复杂先天性心脏病矫治手术中的关键技术,虽然近年来选择性脑灌注的应用一定程度增强脑保护效果,但DHCA的患者术后神经系统并发症仍高达8%~26%[1-2]。DHCA期间的低温可确保患者脑部代谢维持在较低水平,延长大脑缺血耐受时间。然而深低温本身具有一定副作用并且会增加降温复温所需的体外循环时间,可能增加术后神经系统并发症风险,临床工作中对于停循环温度的选择存在较大争议[3]。小泛素样修饰蛋白(small ubiquitin-like modifier,SUMO)是一种通过对翻译后蛋白进行修饰,从而发挥调节作用的小分子蛋白质[4-5]。研究发现,SUMO化是诱导大脑产生缺血缺氧耐受的关键环节,过表达SUMO1或SUMO2/3可增强细胞对缺血缺氧的耐受能力[6]。
目前为止,尚缺乏从体外循环角度对不同停循环温度影响神经细胞SUMO化方面的研究。人神经母细胞瘤细胞(SHSY5Y)是一种分化程度较低的肿瘤细胞,其细胞形态、生理生化功能类似于正常神经细胞,在人类神经系统疾病方面的基础研究应用广泛。本实验以糖氧剥夺(oxygen glucose deprivation,OGD)模拟停循环时缺血缺氧的状态,观察4 h不同程度低温干预对缺血缺氧状态下SHSY5Y细胞表达SUMO化相关蛋白的影响,并于再灌注24 h后观察细胞凋亡情况,从SUMO化这一小分子水平探讨不同停循环温度对神经系统的保护作用。
1 材料与方法
1.1 主要试剂和仪器 RPMI1640培养基、胰酶、优级胎牛血清(Gibco公司);BCA蛋白定量试剂盒、超敏电化学发光(electrochemiluminescence,ECL)试剂盒(碧云天生物科技公司);UBC9抗体、SUMO2+3抗体、SUMO1抗体、caspase-3抗体、β-actin抗体(abcam公司);Talent荧光定量检测试剂盒(天根生化科技(北京)有限公司);乳酸脱氢酶(lactic dehydrogenase,LDH)检测试剂盒(南京建成);1300A型1374生物安全柜、HERAcell150二氧化碳培养箱、Sorvall SF16R低速离心机(Thermo公司);Infinite M200pro光栅型多功能酶标仪(Tecan公司);FCE型化学发光成像系统(美国Protein Simple公司);7500荧光实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)仪(ABI公司)。
1.2 方法
1.2.1 细胞培养与实验分组 本实验所用细胞购自北京协和细胞资源中心,解冻复苏后使用RPMI 1640完全培养液(含14%灭活胎牛血清,1%双抗),以3×105/ml种于 25 cm2细胞培养瓶,在 37℃、5%CO2细胞培养箱中培养,待细胞融合度至80%左右时,以1∶3比例传代,培养10 d后,选取对数生长期细胞进行试验,实验所用细胞均介于C10至C15代。
本实验在不同温度环境中对SHSY5Y细胞进行4 h的OGD,根据体外循环常用温度管理策略,将实验细胞分为对照组、37℃ OGD组、26℃ OGD组和18℃ OGD 组[7]。
1.2.2 低温OGD模拟离体人神经细胞DHCA模型
缺氧体系由厌氧产气袋和密封培养罐组成,厌氧产气袋可在0.5~1 h内吸收氧气,将培养罐中含氧量降至0.1%,营造缺氧环境[8]。 SHSY5Y 细胞培养至融合度80%左右时,以3×105/ml铺于35 mm培养皿或六孔板中,在37℃、5%CO2培养箱中静置培养使细胞贴壁,24 h后用PBS缓冲液冲洗两次,更换无糖RPMI 1640培养液2 ml,置于密封培养罐内进行不同温度的缺氧处理。缺氧4 h后,更换培养液恢复正常培养24 h。
1.2.3 Western Blot检测蛋白水平 取 OGD 结束时及再灌注24 h细胞,进行Western Blot检测。细胞铲子铲下培养皿上的细胞,离心后用Complete Lysis-M蛋白裂解液裂解细胞提取蛋白质,BCA法测定蛋白浓度。取20 μg蛋白质上样,电泳,转膜。5%脱脂奶粉封闭液室温封闭1 h,一抗孵育过夜,次日用洗膜缓冲液(Tris Buffered Saline with Tween-20,TBST)洗膜三次后,二抗孵育1 h,再用TBST缓冲液洗膜三次,加 ECL电发光液,化学发光成像仪中显影。操作中使用的抗体分别为UBC9兔抗人单克隆抗体(1 ∶5 000),SUMO2/3兔抗人单克隆抗体(1 ∶5 000),SUMO1 兔抗人单克隆抗体(1 ∶5 000),caspase-3兔抗人单克隆抗体(1 ∶500),β-actin兔抗人单克隆抗体(1∶5 000),辣根过氧化物酶标记的山羊抗兔二抗(1∶5 000)。
1.2.4 培养液上清LDH含量测定 细胞干预结束后,取上清液,4℃离心,按LDH含量检测试剂盒说明书方法在酶标板上样,在波长450 nm处测吸光度,BCA法检测蛋白质上清液蛋白浓度,计算LDH含量。1.2.5 RT-qPCR 测定 UBC9 的 mRNA 表达 取OGD 4 h结束后细胞,弃上清,按总RNA提取试剂盒方法提取总RNA,无RNA酶水(Rnase-free水)14 μl、cDNA 第一链合成预混 Mix 5 μl、RNA 模板 1 μl配成20 μl逆转录体系,梯度 PCR仪设置程序“42℃ 15 min,95℃ 3 min”进行逆转录,所得 cDNA根据Talent荧光定量检测试剂盒进行荧光定量qPCR。根据qPCR反应的溶解曲线评价引物特异性并记录各样本的 Ct值,计算2-△△Ct结果为样本mRNA相对表达量。
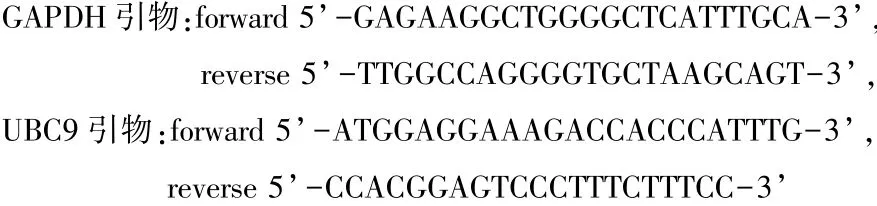
1.3 统计学分析 采用SPSS 23统计学软件,计量资料用(±s)表示,组间显著性差异采用方差分析法检验,组间两两比较用 LSD(Least Significant Difference)和 SNK(Student-Newman-Keuls)法,P<0.05认为差异有统计学意义。
2 结 果
2.1 缺血再灌注损伤细胞效果
2.1.1 形态学观察 光学显微镜相位差模式下观察,可见正常培养的SHSY5Y细胞呈梭型或多边形,形态饱满、较为透亮;OGD使细胞缩小、变圆并聚集成团,细胞内可见暗色空泡,且OGD温度越高,细胞形态变化越明显(见图1)。
2.1.2 OGD 4 h再灌注 24 h后细胞培养液上清LDH浓度 培养液LDH浓度测定结果显示,与对照组相比,各实验组LDH漏出均明显增多(P<0.05,n=6),其中37℃ OGD组LDH漏出明显较低温组增多(P<0.05,n=6),而低温干预组中 30℃组 LDH 漏出明显少于 18℃及26℃组(P<0.05,n=6)(见图2)。
2.1.3 OGD 4 h 再灌注 24 h 后 Caspase-3 蛋白表达情况 Western Blot结果显示:与对照组相比,37℃OGD组Caspase-3蛋白表达水平明显增高(P<0.05,n=6),低温干预下调 Caspase-3 表达(P<0.05,n=6),见图 3。

图1 SHSY5Y细胞正常培养及OGD干预后细胞状态

图2 微板法检测OGD/再灌注后细胞培养液上清中LDH漏出情况(n=6)
2.2 温度对SUMO相关蛋白表达的影响
2.2.1 SUMO1 蛋白表达情况 Western Blot结果显示:OGD损伤4 h后,结合态SUMO1蛋白表达水平变化无统计学意义(P>0.05,n=6),低温干预上调结合态 SUMO1蛋白表达(P<0.05,n=6),且温度越低表达量越高,其中18℃组结合态SUMO1蛋白表达水平明显高于30℃组(P<0.05,n=6);OGD 损伤4 h后,游离态SUMO1蛋白表达水平明显降低(P<0.05,n=6),低温组对游离态 SUMO1蛋白表达水平影响无统计学意义(P>0.05,n=6);低温使SUMO1蛋白结合态与游离态比值增加(P<0.05,n=6),但各低温组间差异无统计学意义(P>0.05,n=6)(见图 4)。
2.2.2 SUMO2/3 蛋白表达情况 Western Blot结果显示:OGD损伤4 h后,结合态SUMO2/3蛋白表达水平变化无统计学意义(P>0.05,n=6),低温干预上调结合态 SUMO2/3 蛋白表达(P<0.05,n=6),各低温组组间差异无统计学意义(P>0.05,n=6);OGD损伤4 h后,游离态SUMO2/3蛋白表达水平降低(P<0.05,n=6),低温干预上调游离态 SUMO2/3蛋白表达(P<0.05,n=6),各低温组组间差异无统计学意义;OGD使SUMO2/3结合态与游离态比值增加(P<0.05,n=6),增加低温干预后 SUMO2/3结合态与游离态比值变化无统计学意义(见图5)。

图3 不同温度OGD的SHSY5Y细胞Caspase-3蛋白表达情况
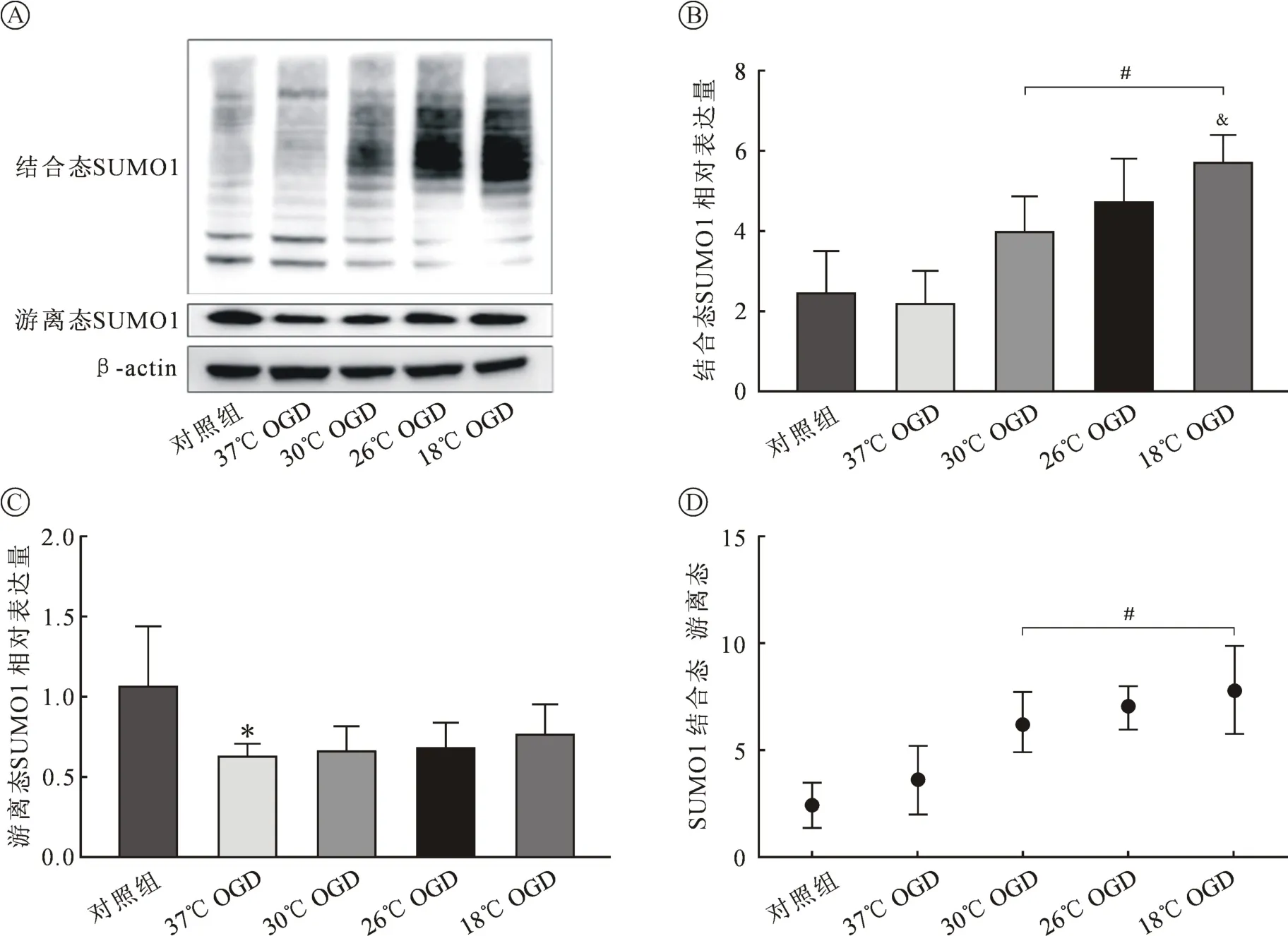
图4 不同温度下OGD的SHSY5Y细胞SUMO1蛋白表达情况
2.3.3 UBC9 蛋白表达情况 Western Blot结果示,与对照组相比,OGD干预4 h后UBC9蛋白表达水平差异无统计学意义,且低温组UBC9蛋白表达水平变化无统计学差异(P>0.05,n=6)(见图 6A 和图6B)。qPCR结果与Western Blot结果一致,各组UBC9的mRNA表达水平无统计学差异(P>0.05,n=3)(见图 6 C)。
3 讨 论
DHCA条件下的大脑与哺乳动物冬眠时所处环境相似,均为低温、缺血、缺氧状态,且都需经历复温、再灌注环节,但动物大脑却可耐受这些变化,未遭致神经系统损伤。对冬眠期地松鼠和非冬眠期地松鼠脑组织的检测发现,冬眠期动物脑组织SUMO化水平和UBC9(SUMO化过程唯一的结合酶)表达显著升高,提示SUMO化可能参与哺乳动物冬眠期缺血耐受的调控[9]。他们的研究还发现,单纯低温可增加SUMO1结合蛋白的表达,低温预处理可增强细胞对OGD的耐受能力。基于以上背景,本实验选择神经系统病理状态研究常采用的SHSY5Y细胞,依据体外循环手术常见管理策略设定温度梯度及干预时间,有针对性的研究温度对SUMO化的影响。
本研究发现,三种损伤指标结果均说明,低温确实可减轻缺血缺氧造成的细胞损伤,但浅低温、中低温及深低温的细胞保护作用差异并不大。形态学方面,细胞缩小、聚集、内含暗色空泡均为损伤性形态改变,低温干预的温度越低缺血缺氧期细胞形态学改变越小。LDH多存在于细胞质内,细胞死亡或细胞膜受损时,会释放到细胞外。OGD后细胞培养液中LDH含量增加,但低温干预降低培养液中LDH水平。但笔者发现,中低温组培养液中LDH含量最少,这可能与复温时剧烈的温度改变,增加细胞膜损伤有关。从凋亡蛋白Caspase-3结果看,经历37℃缺氧的细胞,凋亡蛋白表达明显增高,而低温可减少细胞凋亡。值得一提的是,Caspase-3蛋白在刚结束OGD时表达量极低难以检测,于再灌注期间逐渐升高,至复氧24 h时可充分表达。而SUMO化相关蛋白的表达方面的结果显示,在缺血缺氧条件下,营养物质缺乏,常温状态下神经细胞SUMO1、SUMO2/3蛋白表达量总体呈减少趋势,且缺血缺氧对SUMO1结合状况影响较小,但可增加SUMO2/3 结合率,这一结果与 Hochrainer[10]等人2015年动物实验结论相符。另一方面,低温对SUMO1蛋白影响较大,可显著增加结合态SUMO1蛋白表达量及SUMO1蛋白结合率,温度越低影响越大,但26℃和18℃间差异不显著;且低温可进一步增加SUMO2/3结合蛋白的表达量,但温度梯度的影响不明显。Western Blot结果显示缺血缺氧和低温干预后UBC9变化均不显著,为验证这一结果可靠性,笔者又通过RT-qPCR在mRNA水平检测了UBC9表达,结果与Western Blot一致,提示低温促进SUMO蛋白结合的作用,可能不通过UBC9蛋白表达量变化体现,而是与UBC9蛋白或SUMO蛋白的位置变动有关。
SUMO化是一种可逆的内源性调节过程,通过对翻译后的功能性蛋白进行修饰,参与蛋白质相互作用、信号转导、核转位、维持基因组稳定和抗泛素化等多种生物学功能调节过程[4]。许多研究结果显示,结合态SUMO蛋白可保护细胞抵抗缺血缺氧损伤,减少结合态SUMO蛋白,增加OGD后细胞死亡率[11-13]。 Wang[14]等人的动物实验表明,低温可引起UBC9蛋白向细胞核内转移,SUMO2/3蛋白由游离态转化为结合态在细胞核内积聚,发挥主动的神经保护作用。以往多数观点肯定了SUMO化的保护作用,但最近也有研究显示,缺血再灌注时期,SUMO特异性蛋白酶的去SUMO化作用也可减少细胞死亡[15]。SUMO化的作用与其修饰的功能性蛋白密切相关,其最终效果以保护性为主,但不乏涉及一些损伤性调节通路,不同细胞、不同培养方式、在体离体都有可能对SUMO化检测产生一定影响[16-17]。
本实验由于条件限制,无法控制降温复温速度,导致温度变化过快,未能完全模拟DHCA的温度变化过程。但结果可初步证实,低温可增加SUMO蛋白总体表达水平,促进SUMO1蛋白结合能力,提高神经细胞抗缺血缺氧耐受能力。短时间缺血缺氧情况下,中低温和浅低温的神经保护作用可能不比深低温效果差。在外科医生技术纯熟的情况,可考虑将停循环温度提升至中低温,在缩短体外循环时间的同时,可达到与深低温相近的神经保护效果。少数外科操作用时短的术式,甚至可以考虑将停循环温度调整至浅低温。
[1] Li B, Hu X, Wang Z.The neurologic protection of unilateral versus bilateral antegrade cerebral perfusion in aortic arch surgery with deep hypothermic circulatory arrest:A study of 77 cases[J].Int J Surg, 2017, 40:8-13.
[2] 许海雁.主动脉夹层全弓置换术脑部并发症的预防及护理[J].实用临床医药杂志.2017;14(21).
[3] Luehr M,Baehet J, Mohr FW,et al.Modem temperature management in aortic arch surgery:the dilemma of moderate hypothermia [J].Eur J Cardiothorae Surg, 2014, 45(1):27-39.
[4] Feligioni M, Nistico R.SUMO: a(oxidative) stressed protein[J].Neuromolecular Med, 2013, 15(4):707-719.
[5] Droescher M,Chaugule VK,Pichler A.SUMO rules:Regulatory concepts and their implication in neurologic functions[J].Neuromol Med, 2013, 15(4):639-660.
[6] Lee YJ, Castri P, Bembry J, et al.SUMOylation participates in induction of ischemic tolerance [J].J Neurochem, 2009, 109(1):257-267.
[7] Wu Y, Xiao L, Yang T,et al.Aortic arch reconstruction: deep and moderate hypothermic circulatory arrest with selective antegrade cerebral perfusion [J].Perfusion, 2017, 32(5):389-393.
[8] 杨轶,麦丽萍,吴岳恒,等.安宁包缺氧体系用于构建乳鼠心肌细胞缺氧/复氧损伤模型的研究 [J].岭南心血管病杂志.2013;19(4):498-501.
[9] Lee YJ, Miyake S, Wakita H, et al.Protein SUMOylation is massively increased in hibernation torpor and is critical for the cytoprotection provided by ischemic preconditioning and hypothermia in SHSY5Y cells[J].J Cereb Blood Flow Metab, 2007, 27(5):950-962.
[10] Hochrainer K,Jackman K,Benakis C,et al.SUMO2/3 is associated with ubiquitinated protein aggregates in the mouse neocortex after middle cerebral artery occlusion [J].J Cereb Blood Flow Metab, 2015, 35(1):1-5.
[11] Datwyler AL, Lättig-Tünnemann G, Yang W, et al.SUMO2/3 Conjugation is an Endogenous Neuroprotective Mechanism [J].J Cereb Blood Flow Metab, 2011, 31(11):2152-2159.
[12] Lee YJ,Mou Y,Maric D,et al.Elevated global SUMOylationin Ubc9 transgenic mice protects their brains against focal cerebral ischemic damage [J].PLoS One, 2011, 6(10):e25852.
[13] Cimarosti H,Ashikaga E,Jaafari N,et al.Enhanced SUMOylation and SENP-1 protein levels following oxygen and glucose deprivation in neurones[J].J Cereb Blood Flow Metab, 2012, 32(1):17-22.
[14] Wang L,Ma Q,Yang W,et al.Moderate hypothermia induces marked increase in levels and nuclear accumulation of SUMO2/3-conjugated proteins in neurons[J].J Neurochem, 2012, 123(3):349-359.
[15] Zhang H, Wang Y, Zhu A,et al.SUMO-specific protease 1 protects neurons from apoptotic death during transient brain ischemia/reperfusion [J].Cell Death Dis, 2016, 7(11):e2484.
[16] Yang W,Sheng H,Wang H.Targeting the SUMO pathway for neuroprotection in brain ischaemia [ J].Stroke Vasc Neurol,2016, 1(3):101-107.
[17] Peters M,Wielsch B,Boltze J.The role of SUMOylation in cerebral hypoxia and ischemia [J].Neurochem Int, 2017, 107:66-77.

