3D胸腔镜技术在二尖瓣手术中的应用
浮志坤,张向立,王立成,朱勇锋,杨 恒,杜 鹏,刘 奇
随着心脏外科技术发展,越来越多心脏外科患者选择创伤小、美容效果好的胸腔镜手术(video-assisted thoracoscopic surgeury,VATS)[1]。 然而传统的VATS存在手术视野失真,手术操作学习曲线长等缺点,在传统VATS基础上应用于临床的3D VATS技术,即保留了其传统优势,又提供了类似于开放手术的3D视野,使术者操作更加准确、安全[2]。现将本科2014年1月至2016年12月行3D VATS技术治疗和同期行常规手术治疗的二尖瓣病变患者临床资料进行对比分析,以探讨3D VATS在二尖瓣手术中的应用效果。
1 资料与方法
1.1 临床资料 行3D VATS技术治疗二尖瓣病变患者总计 35 例,年龄 12~54(21.2±19.5)岁,体重32.2~76.5(40.3±16.4)kg。 常规开胸手术患者总计127 例,年龄 32~66(47.2±14.6)岁,体重 36.2~80.7(65.3±17.9)kg。 所有患者术前均完善心电图、超声心动图、胸部X线片和胸部CT。
1.2 手术方法
1.2.1 患者术中体位与手术入路 两组患者均仰卧位,采用静脉复合麻醉,后背贴置体外除颤板,放置食道超声。3D VATS组右肩背垫高20~30°左右,右上肢上抬固定手于头侧。成人采用双腔气管插管,镜下胸内操作时行单肺通气;小儿采用单腔气管插管,术中减小潮气量、增加呼吸频率。胸壁做3个孔(1~2 cm)安置保护套。第一操作孔位于右胸骨旁第3肋间,第二操作孔位于右腋中线第4肋间,第三孔腔镜插入孔位于右腋前线第5肋间。常规开胸组采用胸骨正中切口进胸。
1.2.2 建立体外循环和心肌保护 3D VATS组游离右侧股动、静脉。静脉肝素化,经股动脉切开插入股动脉插管。股静脉插入双极股静脉插管,尖端一级引流口位于上腔静脉,二级引流口位于下腔静脉。经第二操作孔在主动脉根部插入灌注针,降温后阻段升主动脉,灌注心肌保护液。常规开胸组予以升主动脉、上下腔静脉插管建立体外循环,升主动脉放置灌注针,降温后阻断升主动脉,灌注冷血高钾心肌保护液。
1.2.3 心脏操作 3D VATS组于右侧膈神经上缘2~3 cm处平行切开心包予以悬吊。阻闭上、下腔静脉后,平行房间沟切开右房,左房切口经房间隔或房间沟进行;房壁切口缝合牵引线两针,显露心内结构;经房间隔放置左心引流管,二尖瓣置换间断缝合植入人工瓣膜,二尖瓣成形的患者术中间断缝合植入二尖瓣人工成形环。对于合并三尖瓣关闭不全的患者,同期行三尖瓣成形手术。停止左心吸引,头低位,左心房切口缝闭前鼓肺排气;按摩心脏排气,开放升主动脉,心脏复跳。如果出现室颤通过胸外电击除颤。
常规开胸组采用右房及房间隔切口,探查二尖瓣病变,二尖瓣置换的患者予以切除二尖瓣,连续缝合植入人工瓣膜;二尖瓣成形患者间断缝合植入人工成形环,探查三尖瓣,对于三尖瓣关闭不全患者同期行三尖瓣成形术。排气方法同3D VATS组。
1.2.4 体外循环的撤离 两组患者均于心脏切口缝合完毕、彻底止血后考虑脱机。停机后食道超声评估二尖瓣有无明显返流及瓣周漏,无异常后将双腔气管插管更换成单腔气管插管,清除呼吸道痰液,双肺充分膨胀。术毕于胸腔镜切口置胸腔闭式引流管。常规开胸组放置心包及胸骨后引流管。
1.3 统计方法 采用SPSS 17.0软件进行统计分析,所有计量资料均以均数±标准差(±s)表示,统计方法采用配对t检验,计数资料采用卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般临床资料 两组患者间年龄、病种、心功能、手术方式对比无统计学差异(P>0.05),见表1。
2.2 患者术后资料 3D VATS组35例患者术后早期无死亡(30 天内),手术并发症 2.9%(1/35)。 对比常规开胸组127例患者的体外循环时间、主动脉阻断时间、手术操作时间、体外循环预充量、术后呼吸机辅助时间、并发症发生率、病死率没有明显差异(P >0.05),术后 ICU 滞留时间、围术期引流量、住院时间有明显差异(P<0.05)。存活患者术后随访6~38(10.5±12.7)个月,无明显瓣膜返流及瓣膜功能障碍,心功能I~Ⅱ级。详见表2。
3 讨 论
国内最早VATS体外循环下心脏手术在2000年由西京医院完成[3],最早是局限于简单的先天性心脏病治疗。随着技术的进步,国内部分中心相继报道用于治疗心脏瓣膜病、心脏肿瘤及再次心脏瓣膜手术的治疗,而且临床对比传统手术其并发症及死亡率均明显降低[4-6]。与传统的开胸手术方式相比,VATS具有切口小、减少机体创伤、避免胸廓畸形等优势。但传统的VATS技术是在平面结构的视觉下操作,存在手术视野的失真,手术操作学习曲线较长的缺点。2011年3D VATS技术应用于胸心外科手术,不但拥有传统的VATS技术优势,而且其手术野更清晰、明亮度较传统VATS有明显提高。使组织器官及其图像立体投放到视野中,不仅使术者操作变得简单,学习曲线缩短,同时为年轻医师的培养也提供了良好的技术支持[7-8]。特别是在术者拥有传统的VATS操作基础后,在3D的影像下手术的操作准确性会进一步提高,同时死亡率及相关并发症的发生率也会明显的降低。本组患者中无死亡得益于笔者前期的传统的VATS手术基础,以及麻醉和体外循环的术中配合。
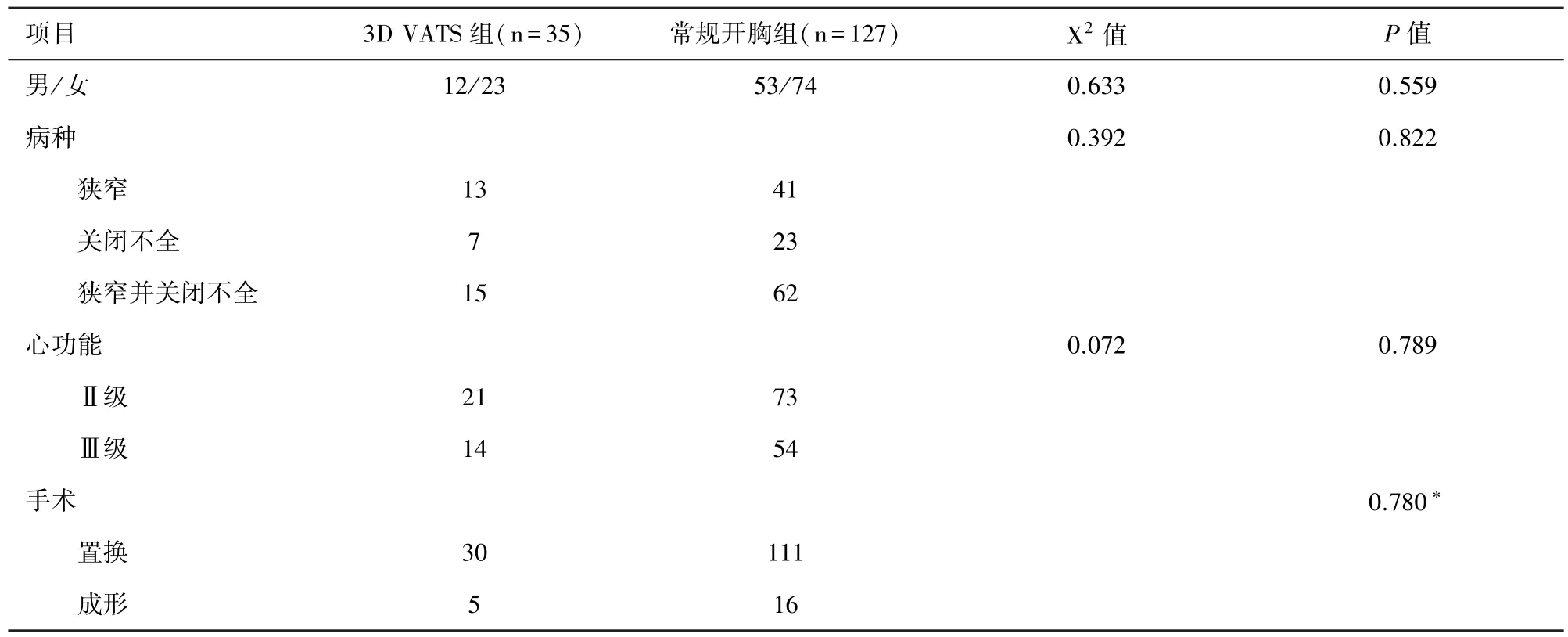
表1 二尖瓣病变患者基本资料(n)

表2 3D VATS组和常规开胸组术后疗效对比
3D VATS技术与常规开胸手术的体外循环时间、主动脉阻断时间、手术操作时间、体外循环预充量、术后呼吸机辅助时间、并发症发生率、病死率没有明显差异(P>0.05),表明该技术应用于二尖瓣手术来讲安全性可靠。术后ICU滞留时间和住院时间较前缩短,有统计学差异(P<0.05)。围术期血液制品应用相关风险及数量降低,红细胞的输注率28.57%vs 52.76%,与 Matzelle 等[9]报道的结果相似。患者围术期的相关并发症降低,利于患者术后的恢复,降低整体的住院周期。
在临床应用中要严格掌握适应证,主要是以右心系统的先天性心脏病和二尖瓣病变为主。除了传统的手术禁忌证以外还包括:①体重<15 kg或过度肥胖者;②严重胸廓畸形;③术侧胸腔广泛粘连者;④严重的血管病变,包括腹主动脉、髂动脉或股动脉疾病,或严重的主动脉粥样硬化、升主动脉内径>40 mm,主动脉缩窄、动脉导管未闭者;⑤合并冠脉病变者[10]。因此,术前常规对患者行胸部X线和CT检查,充分评估入路胸腔和升主动脉的情况,对于长期抽烟、高血压病、糖尿病、高脂血症患者进一步予以股动脉超声评估,排除局部狭窄或癍块形成,避免灌注管插管时出现动脉损伤,降低并发症的发生。术中选择合适的股静脉插管是保证安全、顺利进行手术的保障,对于股静脉插管的选择参考徐学增[11]报道的标准:体重15~30 kg患者通常选用18 Fr/20 Fr插管,30~60 kg选用24 Fr/29 Fr插管,体重60 kg以上应用30 Fr/33 Fr插管,插管时要轻柔,必要时以导丝引导,避免暴力导致静脉损伤。在儿童满足静脉引流时经右房再插入一根上腔静脉插管,利于静脉充分的回流,保证术野的清晰,减少术中操作的时间及副损伤。
术者要注意精细操作,注意相关并发症的防治。笔者建议从房间隔或房间沟入路,应缝置房间隔牵引线充分显露;如部分瓣环暴露不清,可以在瓣叶上缝合牵引线由助手控制角度,有利于缝合。术中采用间断缝合的方式缝合瓣环,采用推结器进行打结植入瓣膜或人工瓣环。术野持续二氧化碳吹气至关闭心腔,配合适当的体位排除心室内残留气体,降低脑血管意外的发生。术后充分排气,持续主动脉根部引流至鱼精蛋白中和肝素。主动脉灌注荷包也是导致出血的原因,采用Osmancik P[12]报道的双荷包技术,以带垫片缝合线缝合两道,避免打结时出现局部血肿及出血。对于术中发现胸膜粘连、动静脉畸形、主动脉钙化、出血无法处理或合并复杂畸形时,应及时改为胸骨正中切口手术,避免不良事件发生。
随着微创理念的发展,在科技和社会需求的推动下,微创手术治疗二尖瓣疾病必将是心脏外科发展的趋势[13-14]。国外多数心脏中心采用机器人辅助外科系统[15],国内最早由解放军总医院报道[16]的机器人微创手术治疗心脏病,但治疗病种及技术仍在逐步的探索中,同时由于该设备昂贵也限制其未能广泛开展。而3D VATS技术因经济及技术优势在我国逐渐开展,本研究对比发现其在微创治疗二尖瓣疾病中安全可靠,对机体创伤小、恢复快,美容效果好,临床应用前景广阔。同时也要在临床工作中加强基础技术的锻炼,不断总结相关经验,保证手术的质量,使更多患者受益。
[1] 袭洁,马增山,孙厚荣,等.200例全胸腔镜心脏手术的体外循环管理[J].中国体外循环杂志,2016,14(2):83-86.
[2] Storz P,Buess GF,Kunert W, et al.3D HD versus 2D HD:surgical task efficiency in standardized phantom tasks[J].Surg Endosc, 2012, 26(5):1454-1460.
[3] 俞世强,徐学增,易蔚,等.全胸腔镜微创心脏手术单中心临床经验[J].中国体外循环杂志, 2016,14(2): 87-90.
[4] 张志刚,张晓慎,李伦明,等.全胸腔镜下左心房黏液瘤切除15例[J].中国心血管病研究,2014,12(1):53-55.
[5] 贾宝成,程云阁,兰怀,等.胸腔镜辅助下主动脉瓣置换术临床分析[J].中国胸心血管外科临床杂志,2015,22(4):385-387.
[6] 钟执文,雷迁,张晓慎,等.胸腔镜再次心脏瓣膜手术的体外循环管理[J].实用医院临床杂志,2016,13(1):16-19.
[7] 赵晨,骆金华,陈亮,等.3D胸腔镜技术在胸心外科教学中的应用与研究[J].中国高等医学教育,2016,(9):87-88.
[8] 于修义,姜杰,耿国军,等.3D电视胸腔镜肺占位病变切除术[J].中国微创外科杂志,2014,14(4):359-361.
[9] Matzelle SJ, Murphy MJ, Weightman WM, et al.Minimally invasive mitral valve surgery using single dose antegrade custodiol cardioplegia[J].Heart Lung Circ, 2014, 23(9): 863-868.
[10] Wang F,Li M,Xu X,et al.Totaiiy thoracoscopic surgical closure of atrial septal defect in small children[J].Ann Thorac Surg,2011, 92(1): 200-203.
[11] 徐学增,石广永,陈亚武,等.全胸腔镜下先天性心脏病手术1281 例[J].中华胸心血管外科杂志, 2012, 28(4):195-197.
[12] Osmancik P,Budera P,Zdarska J,et al.Electrophysiological findings after surgical thoracoscopic atrial fibrillation ablation[J].Heart Rhythm, 2016, 13(6):1246-1252.
[13] Watanabe G,Ishikawa N.Use of barbed suture in robot-assisted mitral valvuloplasty[J].Ann Thorac Surg, 2015, 99(1): 34-35.
[14] 李鸿浩,刘雪梅,昝懿恒,等.达芬奇机器人手术系统在我国胸心外科应用的科学性和伦理学系统评价[J].中国胸心血管外科临床杂志,2014, 21(3):380-388.
[15] 贺清,金屏,俞世强,等.完全胸腔镜技术在中国心脏外科领域的发展现状[J].中国胸心血管外科临床杂志,2017,24(1):65-68.
[16] 高长青,杨明,王刚,等.全机器人不开胸心脏手术4例[J].中华胸心血管外科杂志, 2007,23(1):19-21.

