经皮股静脉插管在微创主动脉瓣置换术中的应用效果
王现强,王 德,刘凯飏,孙志强,田美策,吉冰洋,胡盛寿
随着外科观念和技术的进步,微创化已经成为主动脉瓣膜外科发展的主要趋势,不仅要找到创伤更小的手术方式,还要保证与传统手术相同的疗效与安全性。自上世纪90年代起,全世界众多心脏外科中心对微创主动脉瓣手术进行了不断地探索和研究[1-6],目前已经为众多的心脏外科医生所接受,并成为一项日益成熟的技术得到推广和普及。其中,胸骨上段切口是目前应用最为广泛的微创主动脉瓣手术入路,适合于几乎所有单纯主动脉瓣甚至部分升主动脉的手术,近几年国外几个较大规模的研究报道了良好的近远期结果[7-9]。另外,为尽可能地减小手术切口和手术创伤同时又能获得最佳的手术视野,体外循环的建立可采用各种不同的插管部位和不同的组合方式。本研究主要探讨经皮股静脉插管在胸骨上段微创切口主动脉瓣置换术中的应用。
1 资料与方法
1.1 研究对象 回顾性纳入中国医学科学院阜外医院心脏外科2012年5月至2017年1月的全部胸骨上段切口行主动脉瓣置换术的病例资料,共计65例。根据术中静脉引流的插管方式,分为股静脉组(n=26)和右心耳组(n=39)。 股静脉插管指经皮穿刺的方式经股静脉将二阶梯式引流管插入右心房;右心耳插管指在右心耳缝合荷包线直视下插入心房引流管。所有入选患者均在体外循环下行主动脉瓣置换术。收集两组患者术前、术中资料及术后早期结果进行对比分析。
1.2 手术方法
1.2.1 术前准备及麻醉 患者采取仰卧位,常规单腔气管插管,贴体表除颤电极片,消毒范围包括双侧股动静脉插管位置。术前置入经食道超声心动图(transesophageal echocardiography,TEE)探头备用。手术在全身麻醉,浅低温体外循环下进行。开胸后静脉注射肝素400 U/kg,测量活化凝血时间(activated coagulation time,ACT)>410 s开始体外循环,转机过程中每1 h追加肝素200 U/kg。
1.2.2 手术操作 皮肤切口位于胸骨中线上段,长度6~8 cm。自上而下纵行劈开胸骨至第3或第4肋间处向右侧横断,使胸骨切口近似呈反“L”形。纵行剪开心包并悬吊,充分暴露升主动脉及主动脉根部。右心耳组采用常规的升主动脉-右心房插管建立体外循环。股静脉组采用升主动脉插管,经皮股静脉穿刺插管建立体外循环。根据患者体重选择合适的静脉套管,通常是20~24 F。经股静脉穿刺置入导丝,在TEE引导下进入上腔静脉,应用阶段式扩张导管逐步扩张皮下组织及股静脉。套管经皮沿导丝置入右心房后尖端在TEE引导下插入上腔静脉,必要时可以经切口按压上腔静脉协助引导静脉套管的进入,静脉引流管的顶端要部分进入上腔静脉内。体外循环开始后,股静脉引流应用负压(<40 mm Hg)辅助引流装置,心脏引空后经右上肺静脉放左心引流管。阻断升主动脉后用4∶1的含血冷停搏液灌注,单纯主动脉瓣狭窄的患者采用主动脉根部直接灌注,对存在主动脉瓣关闭不全的患者,则切开主动脉后经冠状动脉开口分别进行灌注,之后每间隔30 min灌注一次,同时心包腔内放冰屑降温。心脏停跳后,通过一个斜行的主动脉切口进行标准的主动脉瓣置换术,手术器械与操作过程同常规主动脉瓣手术相同。心内充分排气后,开放升主动脉阻断钳,TEE监测瓣膜及心脏功能良好、心腔内无残留气体,可以撤除体外循环。鱼精蛋白中和后,常规止血关胸。如果是经股静脉插管,在拔出引流管后,需要对股静脉穿刺部位压迫止血15~20 min,以免造成局部血肿或术后出血。
1.2.3 术后处理 术后处理与常规主动脉瓣置换术相同,包括拔除气管插管、引流管、起搏导线等操作,药物治疗以及术后并发症的预防和处理原则也均相同。对于股静脉插管的患者,术后需局部加压包扎,沙袋压迫6 h。术后监测腿围、颜色、温度,观察有无血肿、出血、血栓、动静脉瘘、肺栓塞等并发症。必要时行股静脉超声或肺动脉CT检查进行排除。
1.3 研究指标 研究指标包括住院死亡、心、脑、肾、肺等重大并发症、体外循环时间、阻断时间、手术时间、呼吸机使用时间、ICU停留时间、术后住院时间、住院费用、出血量、输血率等。
1.4 统计分析应用SPSS 20.0统计软件进行统计学分析。计量资料用独立样本t检验进行分析,以均数±标准差(±s)表示;计数资料用卡方检验(Chisquare)检验进行分析,以百分率表示。P<0.05认为差别有统计学意义。
2 结 果
共入选65例患者,其中股静脉组26例,右心耳组39例。全部患者均在体外循环下,经胸骨上段小切口行主动脉瓣置换术,其中3例同期行升主动脉成形术,1例行主动脉根部加宽术,1例行胸腺肿物切除术。两组间基线资料比较无显著统计学差异,见表1。
两组均无住院期间死亡、肾功能衰竭、神经系统并发症、再次气管插管、Ⅲ度房室传导阻滞、插管局部并发症、股静脉血栓或肺栓塞等重大并发症。股静脉组因主动脉根部出血二次开胸1例(3.8%);右心耳组术中转为常规切口1例,术后出现少量瓣周漏1例(2.6%)。
两组间体外循环时间、阻断时间、手术时间、呼吸机使用时间、ICU停留时间、住院费用、术后住院时间、出血量、输血率等均无显著统计学差异,见表2。

表1 两组患者基线资料比较
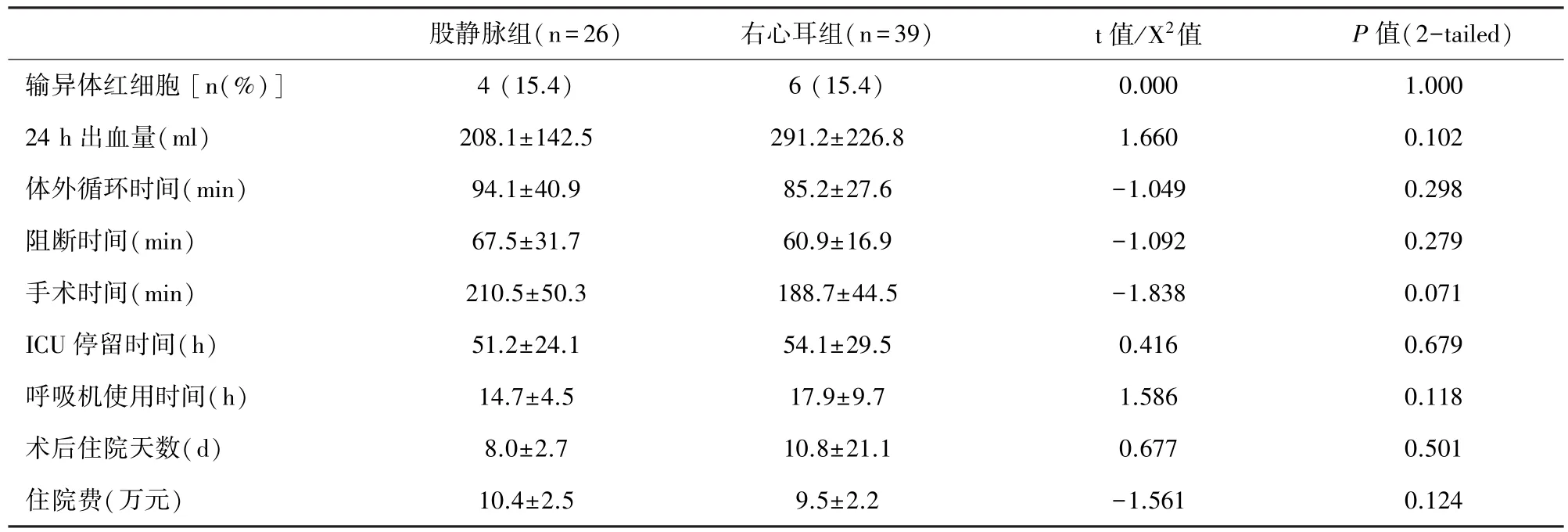
表2 两组围术期结果的比较
3 讨 论
本研究的结果表明,经皮穿刺股静脉插管在微创主动脉瓣置换术中的应用是安全的,无明显操作相关并发症,也未影响手术效果。与常规的右心耳插管相比,术后并发症及相关指标无显著统计学差异。股静脉组手术时间、体外循环及阻断时间均稍高于右心耳组,可能与早期几例股静脉插管操作不熟练有关,但无统计学显著差异。股静脉组住院费用也稍高于右心耳组,与股静脉插管本身收费较高有关,但也未形成统计学显著差异。因此,经胸骨上段切口的微创主动脉瓣置换术,可以应用经皮股静脉插管代替右心耳插管,能够获得更大的手术操作空间。同时,切口内没有静脉插管,可以将切口做得更小,达到更高的美容效果。尤其是对右心耳显露困难者更为适用,如右心耳位置较低或升主动脉扩张向右压迫右心耳的病例。国外报道经胸骨上段切口行再次主动脉瓣置换手术,采用股静脉插管,不用游离右心耳,减少手术操作和难度[9-10]。
经皮股静脉插管操作较为简单,在导丝和TEE的引导下,操作更为安全可靠。这项技术比切开股静脉插管更方便快捷,减少不必要的操作和创伤。但有几点细节需要注意:①穿刺位置在腹股沟韧带下方2 cm,股动脉内侧1 cm处。可以在肝素化之前留置穿刺针,以免肝素化后误穿股动脉止血困难。②股静脉应用负压(<40 mm Hg)辅助引流装置,用较细插管即可达到满意的引流效果,减少了插管过粗对股静脉的损伤。③如果经皮穿刺股静脉置管困难,不要反复扩张或粗暴插管,以免撕裂股静脉造成严重并发症。这种情况下可以把扩张导管放置在股静脉内止血,局部做切口暴露股静脉,直视下进行插管。④股静脉引流管的顶端要达到上腔静脉入口处,否则会影响引流效果。⑤术后穿刺点需要压迫止血,否则可能造成局部出血或血肿。压迫位置应该在皮肤穿刺点上方约2 cm处(即股静脉上穿刺点的位置)才能起到良好的效果。
虽然本组病例无明显并发症,但经皮股静脉插管仍有一些潜在的并发症。股静脉插管后可能会造成局部出血、血肿,髂静脉或下腔静脉破裂出血,腹膜后血肿,术后血管内血栓甚至肺栓塞等。因此,术中操作需要规范、轻柔,不能有任何暴力操作,有困难者需及时切开插管或换另一侧插管。术后严密观察有无并发症,必要时可以行股静脉超声或肺动脉CT检查,如发现问题需要积极处理。
本研究存在一些局限性:①非随机对照研究,研究资料存在选择性偏倚,会影响研究结果。②单中心研究,且术者均为经验丰富的外科医生,该技术能否推广普及还需要更多的研究来验证。③本研究例数较少,该技术的安全性和效果还需要大样本量的研究来证实。
总之,本研究的结果表明,经皮穿刺股静脉插管在胸骨上段切口微创主动脉瓣置换术中的应用是安全有效的,可以替代常规的经右心耳插管,尤其在右心耳显露困难或有更高美容要求的患者更为适用。
[1] Furukawa N, Kuss O, Aboud A,et al.Ministernotomy versus conventional sternotomy for aortic valve replacement:matched propensity score analysis of 808 patients[J].Eur J Cardiothorac Surg,2014, 46(2):221-226.
[2] Gilmanov D,Farneti PA,Ferrarini M,et al.Full sternotomy versus right anterior minithoracotomy for isolated aortic valve replacement in octogenarians: a propensity-matched study[J].Interact Cardiovasc Thorac Surg, 2015, 20(6):732-741.
[3] Hassan M,Miao Y, Maraey A,et al.Minimally Invasive Aortic Valve Replacement:Cost-Benefit Analysis of Ministernotomy Versus Minithoracotomy Approach[J].J Heart Valve Dis, 2015, 24(5):531-539.
[4] Glauber M, Gilmanov D, Farneti PA, et al.Right anterior minithoracotomy for aortic valve replacement:10-year experience of a single center[J].J Thorac Cardiovasc Surg, 2015, 150(3):548-556.
[5] DalénM, Biancari F, Rubino AS, et al.Aortic valve replacement through full sternotomy with a stented bioprosthesis versus minimally invasive sternotomy with a sutureless bioprosthesis[J].Eur J Cardiothorac Surg, 2016, 49(1):220-227.
[6] Shehada SE, Elhmidi Y, Mourad F,et al.Minimal access versus conventional aortic valve replacement:a meta-analysis of propensity-matched studies[J].Interact Cardiovasc Thorac Surg, 2017,25(4):624-632.
[7] Johnston DR, Atik FA, Rajeswaran J,et al.Outcomes of less invasive J-incision approach to aortic valve surgery[J].J Thorac Cardiovasc Surg, 2012, 144(4):852-858.
[8] Merk DR, Lehmann S, Holzhey DM,et al.Minimal invasive aortic valve replacement surgery is associated with improved survival:a propensity-matched comparison[J].Eur J Cardiothorac Surg,2015, 47(1):11-17.
[9] Tabata M,Umakanthan R, Cohn LH,et al.Early and late outcomes of 1000 minimally invasive aortic valve operations[J].Eur J Cardiothorac Surg, 2008, 33(4):537-541.
[10] Tabata M, Khalpey Z,Shekar PS,et al.Reoperative minimal access aortic valve surgery:minimal mediastinal dissection and minimal injury risk[J].J Thorac Cardiovasc Surg, 2008, 136(6):1564-1568.

