miR-372-3p低表达对胰岛素抵抗细胞糖代谢的影响及机制
李伟,胡可胜,邓小凤
(武警广东省总队医院,广州510507)
胰岛素抵抗是妊娠期糖尿病的发病机制之一,改善胰岛素信号传导可有助于预后。微小RNA(miRNA)是一类核苷酸长度为18~23 nt的单链非编码RNA,通过结合3′非翻译序列影响mRNA的稳定和(或)翻译而发挥转录后修饰作用。据估计,miRNA约占有核生物基因组的1%,并且靶基因调节范围达全部基因的30%[1]。近年来研究发现,miRNA可通过调节胰岛素合成、分泌、信号转导而在糖尿病的发病中起重要作用[2]。前期对妊娠期糖尿病妇女胎盘组织中miRNA的差异表达谱进行了探讨,发现有100多种miRNA在妊娠期糖尿病患者胎盘组织中高表达,miR-372-3p是其中之一[3]。生物信息学分析提示差异表达的miRNA调控的靶基因有胰岛素信号通路相关因子。2016年12月~2017年4月,本研究探讨降低miR-372-3p表达对胰岛素抵抗细胞糖代谢的影响及机制,阐明miR-372-3在胰岛素信号通路的调节靶点。
1 材料与方法
1.1 材料 人肝癌细胞系HepG2、DMEM培养基、TRIzol试剂购自广州吉妮欧生物公司;胎牛血清购自赛齐(上海)生物工程有限公司;BCA蛋白定量试剂盒购自Thermo公司;葡萄糖试剂盒购自上海荣盛生物技术公司;β-actin抗体购自Thermo公司;PI3K p85和GLUT4抗体购自abcam公司;二抗羊抗兔IgG(H+L)购自Bioworld Technology公司。根据miRBase中提供的miR-372序列,设计扩增的引物和反义寡核苷酸序列,引物、miR-372-3p反义寡核苷酸(miR-372-3p ASO)和阴性对照物(NC ASO)由上海意果科技公司合成。
1.2 胰岛素抵抗细胞模型构建 用高糖培养法。HepG2细胞按常规方法培养,用含10%胎牛血清的RPMI1640培养液在5% CO2、37 ℃、饱和湿度条件下培养,每日换液,用0.25%胰蛋白酶进行消化,按1∶3比例传代培养,取对数生长期的细胞用于实验。将HepG2细胞随机分为胰岛素抵抗组及正常对照组。制备好的HepG2细胞悬液用PBS 洗涤2次,然后按3×105/孔接种于6孔细胞培养板中。胰岛素抵抗组每孔加入含25 mmol/L人葡萄糖无血清无酚红培养液2 mL,对照组加入普通含糖量(6 mmol/L)的无血清无酚红培养液,继续培养16 h。
1.3 细胞内miR-372-3p表达检测 采用RT-PCR法。用TRIzol法提取各组细胞总RNA,加入无RNA酶50 μL水溶解RNA,取样品1 μL用分光光度计测量RNA浓度,RNA溶液于-80 ℃冷冻保存备用。取总RNA 2 μg,按试剂盒进行加尾操作,1 h后取尾后的样本进行反转录合成miR-372-3p单链cDNA。用TaqMan microRNA探针和ABI7500荧光定量PCR仪进行逆转录和PCR扩增。PCR反应条件:95 ℃ 5 min,95 ℃ 15 s、60 ℃ 1 min进行45个循环。以 U6 snRNA做内参。用2-ΔΔCt法计算目标基因相对表达量。
1.4 miR-372-3p靶基因预测 用Mireap软件进行靶基因预测。miRNA的靶基因预测规则:小RNA与靶基因间的错配不得超过4个(G-U配对认为0.5个错配);在miRNA/靶基因复合体相邻位点的错配不得超过2处;在miRNA/靶基因复合体中,从miRNA的5′端起第2~12个位点相邻位点不得都发生错配;miRNA/靶基因复合体的第10~11个位点不得发生错配;在miRNA/靶基因复合体中,从miRNA的5′端起第1~12个位点错配不得超过2.5个;miRNA/靶基因复合体的最低自由能(MFE)应不小于该miRNA与其最佳互补体结合时MFE的75%。
1.5 胰岛素抵抗细胞转染 胰岛素抵抗HepG2细胞在6孔板中培养,1×106/孔。随机分为hsa-miR-372-3p ASO组、NC ASO组,24 h后,采用脂质体转染试剂Lipofectamine 2000将100 nmol/L的hsa-miR-372-3p ASO、NC ASO分别转染至hsa-miR-372-3p ASO组、NC ASO组,每组设6孔。
1.6 胰岛素抵抗细胞内PI3K、GLUT4蛋白表达检测 采用Western blotting法。转染48 h后,于4 ℃下收集细胞,每孔加入细胞裂解液100 μL(50 mmol/L Tris-HCl、150 mmol/L NaCl、5 mmol/L pH 8.0 EDTA、1% NP40、0.05% PMSF、2 μg/mL Aprotinin、0.15 μg/mL Leupeptin),超声破碎,4 ℃ 12 000 r/min离心5 min,收集上清液。紫外分光光度仪测定蛋白质浓度。取提取物(含50 μg蛋白),采用3%浓缩胶、12%分离胶SDS聚丙烯酰胺凝胶电泳,然后电转染至纤维素膜。纤维素膜用含有5%脱脂奶的TBS封闭1.5 h,一抗(兔抗人pi3k 1∶500、兔抗人GLUT4 1∶1 000)4 ℃孵育过夜,倒去一抗,摇床上TBST洗2次,每次10 min,再用TBS洗10 min。加入辣根过氧化物酶链接的二抗羊抗兔 IgG(H+L),于28 ℃摇床上孵育1.5 h。倒去二抗后用TBST洗涤4次,每次5 min。将膜装入塑料袋,加入ECL试剂,暗室曝光、显影、定影,以β-actin作为内参分析结果。以目的蛋白和内参蛋白灰度值比值作为目的蛋白的相对表达量。
1.7 胰岛素抵抗细胞葡萄糖消耗检测 采用葡萄糖过氧化物酶法。将胰岛素抵抗细胞随机分为阴性对照组、miR-372-3p ASO抑制组和二甲双胍处理组(加入1 μmol/L二甲双胍),各培养10 h。根据葡萄糖检测试剂盒说明书进行操作,计算培养液中葡萄糖含量。培养液中葡萄糖含量=样品吸光度值/标准管吸光度值×标准品浓度(g/L)×1 L/g蛋白。
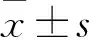
2 结果
2.1 胰岛素抵抗细胞中miR-372-3p的表达水平及靶基因 胰岛素抵抗组miR-372-3p相对表达量为2.39±0.57、对照组为1.23±0.34。胰岛素抵抗组miR-372-3p相对表达量高于对照组(P<0.05)。Mireap分析显示miR-372-3p的靶基因有PI3K调节亚单位β、GLUT4、PKA和MAPK等。
2.2 miR-372-3p低表达对胰岛素抵抗细胞内PI3K、GLUT4蛋白表达的影响 miR-372-3p ASO抑制组PI3K、GLUT4蛋白相对表达量(1.79±0.17、1.52±0.25)均较NC ASO组(1.35±0.18、0.73±0.13)高(P均<0.05)。
2.3 miR-372-3p对胰岛素抵抗细胞糖代谢的影响 miR-372-3p ASO抑制组体外细胞葡萄糖消耗(0.77±0.09)较阴性对照组(0.41±0.06)高(P<0.05);较二甲双胍处理组(0.86±0.05)低,但差异无统计学意义(P>0.05)。
3 讨论
胰岛素信号传导障碍是胰岛素抵抗的重要因素[4]。以往研究显示妊娠期糖尿病胰岛素抵抗明显升高,胰岛素信号通路相关蛋白表达异常[5]。前期我们对妊娠期糖尿病产妇胎盘组织中miRNA表达谱进行探索,发现调节胰岛素信号通路的许多miRNA差异表达[3]。提示妊娠期糖尿病的发病机制与miRNA在胰岛素信号通路调节作用有关。本研究发现,HepG2胰岛素抵抗细胞内miR-372-3p表达升高,靶基因预测显示miR-372-3p与胰岛素信号通路相关。miR-372是定位于19号染色体的mir-371-372基因簇的产物。血糖控制良好与控制差的患者血液中miR-372-3p表达有明显差异,miR-372-3p是2型糖尿病发病的危险因素之一[6]。
胰岛素信号通路蛋白PI3K和GLUT-4在糖代谢中起重要作用,并被预测为miR-372-3p的靶基因。胰岛素信号的激活包括胰岛素结合胰岛素受体(IR)、产生细胞质的受体酪氨酸残基自体磷酸化和胰岛素受体底物(IRS)的酪氨酸磷酸化。这使得IRS与下游效应子如PI3K相关联[7]。PI3K蛋白是异二聚体脂酶,有调节(p85)和催化单元(p110)。静息状态下p85对p110起抑制作用,在胰岛素刺激下IRS-1上特异的酪氨酸残基可与p85亚基结合,进而激活p110亚基,后者经磷酸化PKB/AKT激活,进一步使PKB的丝氨酸残基磷酸化,导致GLUT4从胞内易位至胞膜而促进葡萄糖的利用[8]。PI3K作为胰岛素信号转导通路的焦点,表达减少或活性降低将导致胰岛素信号转导异常,发生胰岛素抵抗。而GLUT4是胰岛素作用下主要的葡萄糖转运蛋白。本研究结果显示,体外细胞中miR-372-3p表达被抑制后,PI3K和GLUT-4表达升高,其分子机制可能是由于反义寡核苷酸解除了miR-372-3p对PI3K、GLUT-4的抑制作用,升高了PI3K和GLUT4蛋白表达。当胰岛素抵抗细胞转染miR-372-3p ASO后,细胞葡萄糖消耗明显高于NCASO转染组,与二甲双胍处理组无明显差别,可能由于miR-372-3p ASO解除了靶基因对胰岛素信号通路蛋白表达的抑制作用,从而改善了胰岛素抵抗。
综上所述,miR-372-3p在胰岛素抵抗细胞中高表达,降低miR-372-3p表达可促进胰岛素抵抗细胞糖代谢,其机制可能与miR-372-3p抑制PI3K、GLUT4表达有关。

