红景天苷对缺氧诱导乳鼠海马神经元凋亡的抑制作用及机制
张金平,汪丽云,王永梅,韩巨
(1山东省千佛山医院,济南250014;2海北藏族自治州第二人民医院)
大量研究证实,神经元凋亡在缺血性脑卒中的发病中至关重要。因此,寻找方法来抑制缺血缺氧造成的神经元凋亡,是目前缺血性脑卒中研究的焦点和热点[1,2]。红景天苷是“适应原性”药物红景天的有效提取物之一。研究证实,红景天苷不仅具备抗缺氧、抗细胞凋亡、抗炎、抗氧化、抗肿瘤、抗疲劳、抗辐射等作用,还具有良好的神经保护作用[3~5]。2016年9月~2017年12月,本研究拟通过缺氧建立神经元凋亡体外模型,观察红景天苷对缺氧诱导的原代海马神经元细胞凋亡的抑制作用,并通过探究缺氧诱导因子1α(HIF-1α)信号通路变化进一步揭示可能的作用机制。
1 材料与方法
1.1 动物、试剂 新生1 d SD乳鼠,体质量7~12 g,雄雌各半,购自山东省千佛山医院实验动物中心。红景天苷购自中国药品生物制品检定所,纯度>99%,用三蒸水溶解配成800 μg/mL母液,过滤,4 ℃保存。DMEM/F12培养基、胎牛血清、谷氨酰胺(Hyclone公司);胰蛋白酶、Neurobasal培养基、B27(Gibco公司);阿糖胞苷、多聚赖氨酸、MTT、DMSO、DAPI(Sigma公司);神经元特异性标记物微管相关蛋白(MAP-2)(Abcom公司);FITC标记二抗、封闭用羊血清(武汉博士德公司);HIF-1α抗体(Novus公司);其他试剂均为国产分析纯。
1.2 原代海马神经元分离、培养及鉴定 取乳鼠,用75%乙醇消毒、断头,用小剪和镊子逐层分离乳鼠皮肤及颅骨,取出脑组织并在冰上分离海马,清洗并加入0.125%的胰蛋白酶2 mL,直剪剪碎,放入37 ℃、5% CO2孵箱中消化15 min,用含10%新生牛血清的DMEM/F12培养液终止消化并离心,吸弃上清并重新悬浮,钢筛过滤后将细胞接种于培养板,24 h后全量换液继续培养2 d,加10 μmol/L的阿糖胞苷处理24 h后Neurobasal+B27培养基全量换培养液,每周2次半量换液,第6~8天取细胞进行后续实验。用0.01 mol PBS清洗海马神经元,用4%多聚甲醛4 ℃孵育15 min,0.2% TritonX-100透化5 min,PBS清洗后用10%羊血清封闭1 h,MAP-2一抗4 ℃孵育过夜,室温下FITC标记二抗,孵育30 min,0.5 g/L DAPI染色5 min。用MAP-2标记海马神经元,用DAPI标记细胞核。选取5个不同区域拍照,用Image-Pro Plus 6.0软件分析神经元纯度。
1.3 海马神经元缺氧凋亡模型构建 将培养好的细胞随机分为正常对照组、缺氧组及10、50、100 μg/mL红景天苷预处理组。正常对照组用常规培养液培养;缺氧组构建缺氧凋亡模型;红景天苷预处理组加入不同剂量(10、50、100 μg/mL)红景天苷预培养24 h,参照构建缺氧凋亡模型的方法[6]进行处理。配制缺氧液:NaH2PO40.9 mmol/L、NaHCO36.0 mmol/L、CaCl21.0 mmol/L、MgSO41.2 mmol/L、乳酸钠 40 mmol/L、N-2-羟乙基哌嗪-N′-2-乙磺酸溶液20 mmol/L、NaCl 98.5 mmol/L、KCl 10.0 mmol/L,pH 6.8,37 ℃,以高浓度氮气饱和(>99.9%,1 L/min×30 min),测其血气PO2≤4.0 kPa。用缺氧液置换正常培养液为缺氧,缺氧6 h,用正常培养液置换缺氧液为复氧,复氧12 h。建立缺氧凋亡细胞模型。
1.4 海马神经元凋亡检测 采用MTT法。取各组细胞,加入MTT母液使其终浓度为0.5 mg/mL,孵化2 h后用酶联免疫检测仪于490 nm波长处测定其吸光度值,计算细胞存活率。细胞存活率=(实验组吸光度值-空白对照组吸光度值)/(对照组吸光度值-空白对照组吸光度值)×100%。
1.5 海马神经元培养上清液乳酸脱氢酶(LDH)、肌酸激酶(CK)活性测定 取处理后细胞培养上清液,参照南京建成LDH、CK测试盒步骤,用分光光度计测定各管吸光度值,计算上清液中LDH、CK活性。
1.6 神经元内HIF-1α蛋白表达检测 采用Western blotting法。用裂解液裂解各组神经元收集蛋白。蛋白定量后行SDS-PAGE凝胶电泳并转移蛋白至PVDF膜。HIF-1α一抗4 ℃过夜孵育后加入HRP标记的二抗,37 ℃孵育1 h,凝胶成像系统ECL发光成像,并用Lab Image version 2.7.1软件分析各组条带灰度值。目标蛋白相对表达量=目标蛋白灰度值/β-actin灰度值。
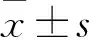
2 结果
2.1 元代海马神经元细胞的鉴别结果 培养第5~7天,神经元生长良好,可见清晰的胞核及核仁,延伸的树棘突形成神经细胞网络。免疫荧光染色法检测神经元纯度>95%,可以用于后续实验。
2.2 红景天苷对缺氧诱导海马神经元凋亡的影响 与正常对照组比较,缺氧组及10、50、100 μg/mL红景天苷预处理组海马神经元存活率分别为1、47.4%±9.7%、63.5%±9.5%、77.5%±9.0%、90.6%±17.2%。与正常对照组比较,缺氧组海马神经元存活率低(P<0.05);与缺氧组比较,50、100 μg/mL红景天苷预处理组海马神经元存活率高(P均<0.05),且呈剂量依赖性;正常对照组与100 μg/mL红景天苷预处理组比较差异无统计学意义(P>0.05)。
2.3 红景天苷对细胞培养基上清液中LDH、CK活性的影响 正常对照组、缺氧组及10、50、100 μg/mL红景天苷预处理组细胞培养基上清液中LDH活性分别为(333.4±142.1)、(985.0±177.8)、(655.0±185.1)、(576.6±154.7)、(492.5±147.5)U/L,CK活性分别为(199.3±75.83)、(3 532±689.5)、(1 935±362.9)、(1 488±154.7)、(909.0±90.74)U/L。与正常对照组比较,缺氧组LDH、CK活性高(P均<0.05);与缺氧组比较,50、100 μg/mL红景天苷预处理组LDH、CK活性低(P均<0.05),且呈剂量依赖性;正常对照组与100 μg/mL红景天苷预处理组比较差异无统计学意义(P>0.05)。
2.4 红景天苷对海马神经元内HIF-1α蛋白表达的影响 正常对照组、缺氧组及10、50、100 μg/mL红景天苷预处理组HIF-1α蛋白相对表达量分别为1、4.5±0.8、8.2±0.9、15.5±1.6、19.9±2.8。与正常对照组比较,缺氧组HIF-1α蛋白相对表达量高(P<0.05);与缺氧组比较,10、50、100 μg/mL红景天苷预处理组HIF-1α蛋白相对表达量高(P均<0.05),且呈剂量依赖性。
3 讨论
脑卒中是最常见的严重神经系统疾病,2018年美国心脏联合会最新公布数据显示,2015年全球大约有0.424亿人罹患脑血管疾病,有630万脑血管患者死亡。脑血管疾病为全球第二大致死性疾病,给家庭和社会带来了巨大的负担[7,8]。与西方国家相比,我国脑卒中危害更甚。2010年调查发现,脑卒中已成为我国首位致死疾病(170万人死亡)[9]。而缺血性脑卒中占所有脑卒中的80%。
研究证实,神经元凋亡参与了大部分神经系统疾病发生发展过程,在缺血性卒中发病过程中起关键性作用[1]。红景天苷是传统中药红景天的提取物之一。研究证实,"适应原性"药物红景天具有抗凋亡、抗缺氧、抗肿瘤、抗辐射等多种作用,其神经保护作用也被研究所证实。红景天苷可通过上调PI3K/Akt/HIF信号通路相关蛋白表达进而抑制白细胞介素6(IL-6)、IL-1β、肿瘤坏死因子α、CD14、CD44等炎症因子的表达,从而减轻大鼠缺氧性全脑损害[10]。Biswal等[11]研究证实,红景天苷可促进Bcl-xL稳定表达,进一步抑制PGAM5磷酸化和pFUNDC1的去磷酸化,从而抑制缺氧诱导的大鼠海马区神经元脂褐素沉积导致的神经元退行及自噬现象。Wu等[5]认为,Wnt/β-catenin信号通路激动剂LiCl可通过升高谷胱甘肽过氧化物酶水平,促进糖原合酶激酶3磷酸化等减轻氧化应激反应,改善6-羟基多巴胺单侧损伤大鼠的行为缺陷和多巴胺能神经元损失。红景天苷在体内体外均可增强LiCl的神经保护作用,提示红景天苷将来可能用于治疗帕金森病。但红景天苷是否可通过抑制神经元凋亡来抑制缺氧造成的神经损害至今仍无定论,其相关的作用机制也有待于进一步证实。本研究采用缺氧诱导体外元代培养的海马神经元建立神经缺氧模型,证实分离的元代海马神经元纯度高,可用于后续实验。用MTT法检测各组神经元凋亡情况,经过缺氧处理后,海马神经元存活率低于正常对照组;经红景天苷预处理后,神经元存活率较缺氧组高,且具有剂量相关性。
LDH、CK是存在于细胞质的酶,当细胞膜受到损伤时,LDH、CK会释放到培养基中,因此培养基中LDH、CK的活性可反映死细胞和受损细胞的数量。为验证红景天苷的保护作用,进一步检测了各组细胞培养基上清液中LDH、CK活性。与正常对照组比较,缺氧组LDH、CK活性高;与缺氧组比较,50、100 μg/mL红景天苷预处理组LDH、CK活性低,且呈剂量依赖性;正常对照组与100 μg/mL红景天苷预处理组比较差异无统计学意。证实红景天苷可抑制缺氧诱导的海马神经元凋亡,且该作用具有剂量依赖性,剂量越高作用越强。提示可采用100 μg/mL剂量进行后续相关机制的研究。
HIF-1是存在于人类和哺乳动物体内的关键性缺氧应答调控因子,其可通过调控血管内皮生长因子、重组人促红素、糖原合成酶激酶3等一系列下游靶基因的表达,从而使机体对缺氧、缺血产生适应。HIF-1由α和β两个亚基组成,其中,HIF-1β为基础表达蛋白,不因缺氧环境改变而变化;HIF-1α蛋白的表达与细胞氧浓度有关。常氧状态下,HIF-1α羟基化,与泛激素结合酶复合物结合后迅速降解;而在缺氧或螯合剂存在状态下,HIF-1α羟基化被抑制,表达升高,与HIF-1β结合进一步激活下游一系列蛋白表达,从而使机体适应缺氧改变[12,13]。本研究证实,缺氧组HIF-1α蛋白表达高,红景天苷预处理组HIF-1α蛋白降解被进一步抑制,蛋白表达进一步升高,且蛋白表达同红景天苷处理剂量呈正相关关系,证实红景天苷可能通过促进HIF-1α蛋白的表达从而抑制缺氧诱导的神经元凋亡。HIF-1为机体缺氧适应的上游靶基因,红景天苷具体通过HIF下游的哪条信号通路起到抑制神经元凋亡的作用,这是后续实验需要进一步验证的。
总之,研究证实红景天苷具有神经保护作用,其可通过抑制神经元凋亡从而减轻缺氧诱导的神经损害,其作用机制可能与上调HIF-1α蛋白表达进而调控其下游的靶蛋白表达密切相关。

