miR-29a过表达对胶质瘤细胞迁移的作用及机制
张利超,卢忠胜,张强
(1青海大学研究生院,西宁810000;2青海省人民医院)
胶质瘤是中枢神经系统常见的恶性肿瘤,Ⅲ、Ⅳ级为高级别胶质瘤[1,2]。近年来,胶质瘤的发病率逐年递增,尤其胶质母细胞瘤的发病率最高,约为3.20/10万[3]。目前,临床治疗多采取手术、术后放化疗等。但由于胶质瘤具有浸润性,术中难以全切,且放化疗效果亦不理想[4],术后复发率高、生存期短[5]。因此,研究胶质瘤的转移及侵袭机制至关重要。microRNA的异常表达与多种肿瘤的增殖和转移有密切关系[6]。研究发现,miR-29a能使胶质瘤的转移和侵袭受到显著抑制,miR-29a通过靶向DNMT3A/3B来抑制胶质瘤的转移[7~10]。研究发现,转录因子Sp1的异常表达与肝癌、胃癌等密切相关。Sp1在胶质瘤组织中过表达,通过调控基因MMP-2来促进肿瘤的转移及侵袭[11]。基于胶质瘤中miR-29a低表达和Sp1高表达,两者是否存在某种机制来调控胶质瘤的发生发展尚未见相关研究。2017年1~12月,本研究对miR-29a对胶质瘤细胞迁移的抑制作用及机制进行探讨。
1 材料与方法
1.1 细胞、试剂及仪器 人正常神经胶质细胞株OLN93,胶质瘤细胞株U87、A172、U251、SHG44,均由上海中科院细胞所提供。DMEM细胞培养基购自HyClone;DMSO购自上海碧云天生物技术研究所;Lipofectamine 2000购自Invitrogen公司;细胞裂解液购自Fermentas;胎牛血清、胰酶购自HyClone;蛋白酶/磷酸酶抑制剂购自Sigma公司;TRIzol试剂盒购自宝生物工程有限公司;M-MLV逆转录试剂盒、SYBR购自Invitrogen公司;Tris、硼酸、琼脂糖、蛋白上样缓冲液(5×)、Tween-20、Acr/Bis(29∶1)、Glycine、SDS、10% SDS、引物、TEMED、DTT、EDTA、琼脂粉、浓盐酸、乙醇、异丙醇、甲醇购自上海生工科技有限公司;氯化钠、氯化钾、Na2HPO4、KH2PO4购自国药集团化学试剂有限公司;microRNA mimics、microRNA NC购自苏州吉玛公司;Dual-Luciferase®Reporter Assay购自美国Promega公司;psiCHECKTM-2购自上海吉玛生物有限公司;抗Sp1兔多克隆抗体购自Abcam;抗β-actin鼠单克隆抗体、山羊抗鼠IgG、山羊抗兔IgG购自北京康为生物有限公司;超敏ECL化学发光试剂盒购自美国Pierce公司;大肠杆菌菌株DH5α购自Tiangen公司;酶Xhol Ⅰ和Not Ⅰ、T4 DNA连接酶购自MBI Fermentas;Transwell小室、Matrigel 基质胶购自美国BD Bioscience公司;质粒抽提试剂盒购自美国Axygen 公司。
1.2 细胞培养 细胞均用含10% FBS和0.1%双抗的RPMI 1640或DMEM培养基培养,置于37 ℃、5% CO2的培养箱中进行培养,并保持适当湿度。定时查看细胞生长状态,当细胞生长至70%~80%时,用胰酶消化并传代。
1.3 细胞中Sp1 mRNA及miR-29a表达检测 采用实时定量PCR技术。细胞中RNA按六孔板试剂盒法进行操作;使用M-MLV逆转录试剂盒,按照试剂盒说明书进行cDNA第一链的合成;PCR过程按Invitrogen的SYBR实时定量PCR试剂盒说明书在Real-Time PCR仪上进。用2-ΔΔCt法(Ct为循环阈值)计算目的基因相对表达量。合成cDNA第一链所用的引物序列,miR-29a :5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTAACCGAT-3′,U6 :5′-CGAGCACAGAATCGCTTCACGAATTTGCGT-GTCAT-3′。实时定量PCR反应体系20 μL:SYBR premix 10 μL,microRNA上游引物(2.5 μmol/L)0.5 μL,microRNA下游引物(2.5 μmol/L)0.5 μL,cDNA 1 μL,无菌水8 μL。实时定量PCR所用引物序列,U6 上游引物:5′-CGAGCACAGAATCGCTTCA-3′、下游引物:5′-CGAGCACAGAATCGCTTCA-3′;miR-29a 上游引物:5′-CCGTCCTCCGTAGCACCATCTGAAAT-3′、下游引物:5′-CTCAACTGGTGTCGTGGAGTCGGC-3′;Sp1 上游引物:5′-CCTCCAGACCATTAACCTCAG-3′、下游引物:5′-TCCACCTGCTGTGTCATCAT-3′;β-actin 上游引物:5′-GGCGGCACCACCATGTACCCT-3′、下游引物:AGGGGCCGGACTCGTCATACT-3′。反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 10 s,60 ℃ 1 min,40个循环。
1.4 细胞中Sp1蛋白表达检测 采用Western blotting法。细胞去掉培养基后加入蛋白裂解液,行蛋白定量后用于上样跑胶或者-80 ℃保存备用。恒压电泳,浓缩胶70 V,30 min;分离胶110 V电泳,电泳时间依据实验所需蛋白的相对分子质量进行选择;调节恒流300 mA转膜2~3 h;室温封闭1~2 h;一抗4 ℃孵育过夜;二抗室温孵育2~3 h;用ECL Solution在暗室中X线片显影,依据信号强弱调整曝光的时间长短,曝光后,洗片机冲洗胶片,取胶片放入X线片自动洗片机中显影。将显影好的内参与目的基因的胶片在扫描仪上扫描并记录。目的蛋白灰度值/β-actin灰度值作为蛋白相对表达量。
1.5 细胞转染 以胶质瘤细胞U87和A172作为研究对象,用脂质体法进行转染。取部分U87、A172细胞,均随机分为miR-29a过表达组、阴性对照组,分别转染外源性miR-29a mimics、miR-NC mimics。分别用实时定量PCR技术、Western blotting法检测细胞中Sp1 mRNA、蛋白表达,方法同1.3、1.4。另取部分U87、A172细胞,均随机分为si-Sp1-1组、si-Sp1-2组、阴性对照组,分别转染si-Sp1-1、si-Sp1-2、si-NC。
1.6 miR-29a对Sp1的直接靶向作用检测 用TargetScanHuman v7.0软件确定了miR-29a与Sp1的结合位点,将Sp1的3′-UTR区(包含与miR-29a的结合序列)克隆到psiCHECK-2质粒载体上,由苏州金唯智生物公司合成。直接合成Sp1 3′-UTR区并连接到psiCHECK-2质粒载体上,将野生型/突变型质粒载体分别与miR-29a/NC共转染至U87、A172细胞中。双荧光实验检测细胞内荧光强度。
1.7 细胞迁移能力检测 采用Transwell实验。将存放于-80 ℃的Matrigel基质胶转移至冰盒内放置4 ℃过夜;冰上包被基底膜置于37 ℃的培养箱内孵育2~5 h;水化基底膜置于培养箱内30 min。用含1% FBS的DMEM重悬细胞,调整细胞为5×105/mL;向准备好的上室内加入混匀的细胞悬液200 μL,下室内加含20% FBS的DMEM 600 μL,置于培养箱中24 h。观察细胞染色并计数迁移细胞数。实验重复3次。
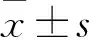
2 结果
2.1 OLN93细胞及U87、A172、U251、SHG44细胞中Sp1表达比较 OLN93细胞及U87、A172、U251、SHG44细胞中Sp1 mRNA相对表达量分别为0.001 40±0.000 053、 0.018 16±0.000 183、0.035 04±0.001 251、0.030 54±0.000 307、0.011 81±0.000 072,蛋白相对表达量分别为0.087 7±0.003 32、0.430 2±0.018 6、 0.870 5±0.031 3、0.736 4±0.024 9、 0.510 7±0.011 9,U87、A172、U251、SHG44细胞中Sp1 mRNA及蛋白相对表达量均高于OLN93细胞(P均<0.05)。
2.2 OLN93细胞及U87、A172、U251、SHG44细胞中miR-29a表达比较 OLN93细胞及U87、A172、U251、SHG44细胞中miR-29a相对表达量分别为0.000 134 5±0.000 022 44、0.000 022 9±0.000 000 83、0.000 004 0±0.000 000 34、 0.000 009 0±0.000 000 68、0.000 030 4±0.000 001 78,U87、A172、U251、SHG44细胞中miR-29a相对表达量均低于OLN93细胞(P均<0.05)。
2.3 miR-29a过表达对U87、A172细胞中Sp1表达的影响 U87细胞miR-29a过表达组、阴性对照组中Sp1 mRNA相对表达量分别为0.000 466 0±0.000 026 67、0.000 838 6±0.000 027 23,蛋白相对表达量分别为0.439 8±0.018 63、0.908 3±0.024 17;A172细胞miR-29a过表达组、阴性对照组中Sp1 mRNA相对表达量分别为0.001 565±0.000 093 24、0.003 171±0.000 097 03,蛋白相对表达量分别为0.488 5±0.019 1、0.918 4±0.016 52。U87、A172细胞miR-29a过表达组中Sp1 mRNA、蛋白相对表达量均较阴性对照组低(P均<0.05)。
2.4 miR-29a对Sp1的直接靶向作用 双荧光实验结果显示在U87和A172细胞中miR-29a能明显抑制野生型载体的荧光强度,且突变型载体上的荧光强度无变化。miR-29a能直接作用于Sp1 3′-UTR区,并能下调Sp1的表达。
2.5 miR-29a过表达对U87、A172细胞迁移的影响 U87细胞miR-29a过表达组、阴性对照组中迁移细胞数分别为(506±19)、(125 5±103)个/视野;A172细胞miR-29a过表达组、阴性对照组中迁移细胞数分别为(483±21)、(1 317±23)个/视野;U87、A172细胞miR-29a过表达组中迁移细胞数较阴性对照组少(P均<0.05)。
2.6 Sp1基因沉默后对U87、A172细胞迁移的影响 U87细胞si-Sp1-1组、si-Sp1-2组、阴性对照组中迁移细胞数分别为(268±8)、(249±10)、(653±16)个/视野;A172细胞si-Sp1-1组、si-Sp1-2组、阴性对照组中迁移细胞数分别为(648±17)、(680±32)、(1 883±23)个/视野;U87、A172细胞si-Sp1-1组、si-Sp1-2组中迁移细胞数较阴性对照组少(P均<0.05)。
3 讨论
研究表明,miRNA在多种肿瘤细胞中异常表达,可通过影响细胞的多种基因,进而参与肿瘤的生物学功能,同时异常表达的miRNA与胶质瘤的关系密切[12,13]。随着现代医学的不断发展,在神经导航、术中MRI、功能定位、电生理监测以及实时荧光等现代技术的支持下,可实现手术精准切除,术后再行化放疗的综合临床治疗,但该类患者的预后仍然很差。胶质瘤的治疗已成为神经外科临床工作中的一项难题,胶质瘤分子机制的探讨有可能为胶质瘤的诊疗提供一种新的方法。
研究表明Sp1与肿瘤的诸多生物学进程有关,并发挥重要作用,比如肿瘤细胞的增殖、凋亡、转移和细胞的血管再生等[14,15]。Sp1的异常表达有可能导致人类某些疾病的发生。研究表明,在肝癌、胃癌等肿瘤组织中Sp1高表达[16,17],在本研究胶质瘤细胞中Sp1也呈高表达。在干扰Sp1后胶质瘤细胞增殖可受到抑制[14],但Sp1的异常表达能否也对胶质瘤细胞的转移及侵袭产生作用目前尚不清楚。本研究结果表明,干扰Sp1表达后胶质瘤细胞迁移能力受到明显抑制。
本研究对miRNA调节Sp1发挥调控作用进行探讨。miRNA在基因转录的调控方面起重要作用,且通过预测软件显示在Sp1的3′-UTR区存在miR-29a的特定结合位点;同时细胞依赖的生化分析也进一步证实。本研究首次提出并验证了在胶质瘤细胞中miR-29a能用直接结合的方式来抑制Sp1的表达。在胶质瘤细胞株中miR-29a后过表达,Sp1的表达下降。通过双荧光素酶实验证实miR-29a可直接靶向Sp1 3′-UTR区来抑制基因的表达。还发现miR-29a过表达能抑制胶质瘤细胞迁移,这种现象与干扰Sp1后细胞迁移受到抑制相符。即miR-29a在细胞内模拟了Sp1干扰后的效果,进而表明miR-29a可通过下调Sp1的表达来抑制胶质瘤细胞迁移。事实上,miR-29a也可靶向基因DNMT3A/3B使胶质瘤细胞迁移受到抑制[18]。原因可能为1个miRNA能调控不同的靶基因[19~21]。同样在其他肿瘤细胞中也出现类似情况。在胃癌组织中miR-29a可直接靶向调节基因p42.3、Robo1、VEGF-A等[9,18,19],通过阻断迂回指导受体1[20],上调miR-29a的表达来降低细胞转移和侵袭能力。另外,miR-29抑制胃癌细胞增殖,其机制为下调细胞周期蛋白依赖性激酶CDK2、CDK4和CDK6的表达[21]。在前列腺癌中,通过直接靶向组蛋白赖氨酸脱甲基酶5B,上调miR-29a的表达来抑制细胞增殖并增强细胞凋亡[22]。在肾细胞癌组织中miR-29a表达下降,并通过靶向赖氨酸氧化酶同系物2抑制细胞转移、侵袭[23]。Tréhoux等[24]证明,在胰腺癌组织中,miR-29a通过直接靶向黏蛋白1抑制细胞增殖、迁移和侵袭,并使细胞对吉西他滨敏感。在口腔鳞状细胞癌组织中miR-29a负性调节基质金属蛋白酶2的表达,从而抑制细胞侵袭并促进细胞凋亡[25]。在非小细胞肺癌组织中miR-29a表达下调,且其表达下调与肿瘤TNM分期和转移相关。另外,抑制miR-29a表达抑制了非小细胞肺癌迁移和侵袭[26]。然而,在结直肠癌组织中miR-29a通过靶向Krüppel样因子4来促进细胞迁移和侵袭,从而调节基质金属蛋白酶2和上皮钙黏蛋白的表达[27]。以上研究结果表明,miR-29a对肿瘤的作用是可变的,并且表现出组织特异性。miR-29a可能在以上类型肿瘤中起重要作用,并且可能是潜在的治疗靶基因。miR-29a低表达提示肿瘤患者预后不良,并与淋巴结的转移有关,其中包括胶质瘤[7,9]。本研究也发现,在胶质瘤细胞中miR-29a表达下调。本研究证实Sp1参与胶质瘤细胞迁移,且Sp1的表达至少部分受miR-29a的调控。然而,并未发现Sp1调控胶质瘤细胞迁移下游的作用机制。过表达miR-29a或干扰Sp1后均能明显抑制胶质瘤细胞迁移,这有可能为今后治疗胶质瘤提供新的方向。
综上所述,Sp1在生物体内有可能作为促癌因子发挥作用,Sp1的异常表达使肿瘤细胞的恶化程度进一步增强;miR-29a在生物体内扮演着抑癌因子的角色,其高表达能明显抑制肿瘤细胞迁移,进而发挥着抑癌的重要作用。肿瘤的发生发展是多个基因参与的复杂程序化过程,不是单个基因或单个调节机制所决定的。本研究证明Sp1至少部分受miR-29a的调控,且在干扰Sp1及miR-29a表达后,均能明显抑制胶质瘤细胞的恶性行为。这有可能为胶质瘤的诊疗提供了靶向位点及新的思路。

