IL-2激活的NK细胞对胶质瘤的杀伤作用
吴帅帅, 乔小放, 赵红梅, 王晓科, 王海亮, 于 翔, 刘 军
胶质瘤(glioma)是指上皮组织来源的肿瘤,是最常见的原发性颅内肿瘤[1],成人中的发病率为8/10万。依据WHO分级系统,其分为WHOⅠ~Ⅳ级,Ⅰ级和Ⅱ级属于低级别胶质瘤,Ⅲ级和Ⅳ级属于高级别胶质瘤,其中胶质母细胞瘤(glioblastomamultiforme,GBM)是恶性程度最高的高级别胶质瘤。临床表明,手术治疗是脑胶质瘤的首选方法,但胶质母细胞瘤浸润生长,与脑组织界限不清等特点,造成外科手术难以全部切除。加上恶性脑胶质瘤对放化疗的治疗不是很敏感,因此,为了延长患者生存期及改善远期生活质量,胶质母细胞瘤的治疗需要其他辅助方案。本实验从生物治疗方法出发,以动物实验模型,研究白细胞介素2(IL-2)激活的自然杀伤细胞(NK细胞)对脑胶质具有一定程度的杀伤作用,希望为今后进一步研究提供有利依据。
1 材料与方法
1.1 NK细胞分离与纯化 细胞提取:采集静脉血50 ml →肝素抗凝→PBS稀释抗凝外周血→加10 ml淋巴细胞分离液,离心15 min →取界面层细胞→再次离心10 min →PBS洗涤液混匀、离心弃上清→重复洗涤细胞操作1次→将细胞用PBS悬浮,待用。
NK细胞纯化:(1)将以上所得细胞→加入分离缓冲液和抗CD56免疫磁珠比例混合→避光孵育15 min→加入1 ml 的PBS磷酸缓冲液离心,去上清→ PBS缓冲液悬浮细胞,备用。(2)PBS磷酸缓冲液细胞→加入ACS磁场分离→收集分选的阴性细胞→加入RPMI 1640培养基1 ml→分选的CD3-CD56+阳性细胞→获得NK细胞→培养基悬浮细胞,待用。
NK细胞培养:100 U/ml青霉素和100 μg/ml链霉素的RPMI1640细胞培养基悬浮NK 细胞→接种于适量培养基的培养瓶→置37 ℃,5%二氧化碳的培养箱中培→以培养24 h后的NK细胞作为备用细胞。
1.2 GBM选择培养与鉴定 肿瘤组织取自吉林大学第二医院神经外科胶质瘤患者手术切除新鲜病理组织,术后病理报告诊断为胶质母细胞瘤,WHO分级Ⅳ级。免疫组化染色结果:Olig-2(+)、EMA(弱+)、GFAP(+)、S-100(+)、KI67(阳性率20%)、IDH-1(-)、CK(AE1/AE3)(-)。
GBM培养方法参考Parney 等[2]实验设计。无菌条件取肿瘤组织块约10 g→高压灭菌分块后0.25%胰蛋白酶消化→充分消化15 min成单个细胞→加含10%胎牛血清的DMEM/F12培养基中止、滤过→2000 r/min,离心5 min,弃上清→取沉淀细胞,以每毫升3×105个细胞的密度接种于培养瓶→无菌37 ℃培养箱中培养12 h→取贴壁细胞→无菌PBS冲洗细胞2~3次,弃不合格细胞→再次加胰蛋白酶和培养基,成单细胞悬液→取悬液接种在新的培养瓶接种→无菌培养箱中培养、备用。
经培养的GBM经HE染色显示:细胞呈分化差形态多样的不规则形或星形细胞,细胞分化差、大小不一,细胞结构复杂,核异型性明显,核分裂象多见。免疫细胞化学结果显示Olig-2(+)、EMA(弱+)、GFAP(+)、S-100(+)、KI67(阳性率20%)与新鲜肿瘤组织大致相似。
1.3 小鼠模型 裸鼠分组:BALB/c裸鼠无菌环境下饲养→随机分组,每组6只(A、B、C、D、E、F、G、H组)→A:无菌裸鼠对照组;B:体内移植GBM组织组;C:体内注射IL-2组;D:体内注射NK细胞组;E:同时移植GBM组织和NK细胞组;F:同时移植IL-2和NK细胞组;G:GBM组织、NK细胞和IL-2移植组。
建立动物模型:(1)取培养的GBM组织→胰蛋白酶消化、离心→无血清DMEM/F12培养基→GBM细胞的悬液→微量注射器将0.1 ml GBM细胞悬液→皮下注射于BALB/c裸鼠背部皮下。(2)取纯化的NK细胞悬液→无血清培养基中计数→配制细胞的悬液→微量注射器0.2 ml NK细胞悬液→尾静脉注射于BALB/c裸鼠体内。(3)取0.2 ml IL-2→微量注射器经尾静脉注射裸鼠体内。经尾静脉注射IL-2、NK细胞和皮下注射GBM同一天进行,且先注射GBM组织悬液。
肿瘤组织生长监测:自肿瘤组织、NK细胞与IL-2移植之日起,每天密切观察裸鼠生长情况及是否体内成瘤生长。记录裸鼠体内开始产生瘤体时间,每日测量肿瘤组织的最大长径(mm)与最大宽度(mm),分别记为α、β,肿瘤体积计算公式:V=αβ2/2(mm3)[3]。肿瘤出现后21 d处死带瘤裸鼠,解剖裸鼠取完整肿瘤组织,测量肿瘤重量[4]。
肿瘤组织病理:取裸鼠肿瘤组织HE染色,观察病理组织细胞形态,行免疫组化。
1.4 统计学分析 采用SPSS 19.0分析实验数据。各组数据行小样本t检验,P<0.05表示差异性具有统计学意义。
2 结 果
2.1 实验裸鼠生长情况及成瘤情况 实验结果:各组实验裸鼠无非正常死亡。裸鼠成瘤情况:B组(体内移植GBM组);E组(同时移植GBM组织和NK细胞组);G组(GBM组织、NK细胞和IL-2移植组)小鼠体内有均瘤体产生(见表1)。
2.2 B组、E组与G组裸鼠首次出现瘤体时间情况 实验结果表明:B组、 E组、G组、小鼠体内有均瘤体产生,肿瘤出现时间为(8.91±1.42)d、(14.22±2.12)d、(17.56±1.89)d。B组与 E组相比,小鼠体内注射NK细胞后成瘤时间延长,二组比较有明显差异。E组与G组相比,小鼠体内注射IL-2后体内成瘤时间会延长,具有明显差异(见表2、表3)。
2.3 各成瘤裸鼠组体内肿瘤生长情况 实验结果表明:NK细胞能有效抑制胶质瘤在裸鼠体内生长。图表显示移植GBM组织后出现胶质瘤的裸鼠体内肿瘤细胞生长受NK细胞的抑制作用,且IL-2可以增强NK细胞抑制作用(见图1),横轴表示瘤体出现时间(d),纵轴表示瘤体体积(×100 mm3)。
2.4 B组、E组与G组裸鼠体内肿瘤重量分析 实验表明:肿瘤出现21 d后,处死裸鼠取完整肿瘤组织,并分别称重、计算瘤体重量。结果显示:E组比B组小鼠体内的肿瘤重量小,二组比较有明显差异。G组比E组小鼠体内肿瘤重量要小,两组P<0.05,具有明显差异(见表4、表5)。
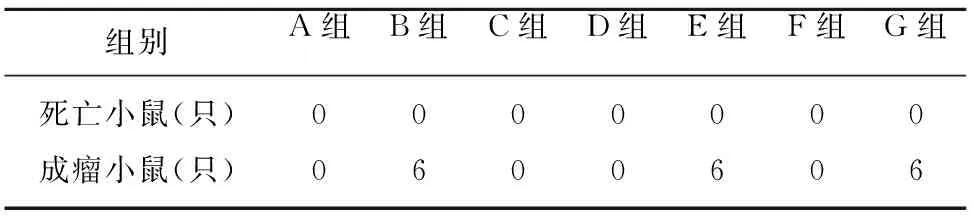
表1 各组小鼠生长及成瘤情况
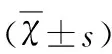
表2 B组与E组小鼠出现瘤体时间
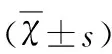
表3 E组与G组裸鼠出现瘤体时间
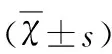
表4 B组与E组小鼠体内肿瘤重量
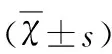
表5 E组与G组小鼠体内肿瘤重量
2.5 移植CBM组织裸鼠体内肿瘤组织病理分析 肿瘤组织病理:结合免疫组化染色结果及形态学特征考虑胶质母细胞瘤。免疫组化染色结果:Olig-2(+)、EMA(弱+)、GFAP(+)、S-100(+)、KI67(阳性率20%)、CK(AE1/AE3)(-),考虑胶质母细胞瘤Ⅳ级(见图2)。

图1 B组、 E组、G组裸鼠肿瘤生长速度情况

图2 肿瘤组织病理
3 讨 论
GBM是星形细胞谱系恶性程度最高、侵袭性最强的弥漫性胶质瘤[5],占恶性原发性脑和中枢神经系统肿瘤的45.2%,占所有胶质瘤的54%[6]。由于GBM恶性度高细胞生长快,侵袭脑组织严重,病程短等特点造成脑组织水肿、颅内压增高症状明显,基本所有患者前期都会出现头痛、恶心呕吐、视物模糊等症状;随着病情加重渐渐表现出精神改变或意识障碍。如果肿瘤进一步浸润性破坏脑组织,患者出现不同程度的肢体瘫痪、偏身感觉障碍、感觉或运动性失语等,甚至引起脑出血及脑疝,直接危及患者生命。GBM的诊疗方式一直是研究的热点,虽然手术、放疗还是化疗,都取得了相对发展,但临床治疗效果还是无法满足患者及家属的预期,中位生存期为15 m[7],相对生存期仅为2 y的占13.7%[6],5 y生存率低于5%[8]。因此,探究新型生物免疫治疗的可能是改善患者预后的关键性治疗方法。
本次实验通过体外培养人GBM细胞,将体外培养的GBM细胞进行动物体内移植,建立神经胶质瘤裸鼠移植模型并进行免疫细胞治疗(提取健康人体内NK细胞同GBM细胞与IL-2共培养),观察NK细胞对神经胶质瘤动物模型的治疗作用。研究显示:人脑胶质母细胞瘤组织经过体外培养,然后经过移植小鼠体内生长出的肿瘤组织,经过病理分析基本一致,显示了神经胶质瘤细胞的体外培养、传代及神经胶质瘤分化的潜能;E、G组的裸鼠出现肿瘤时间比B组裸鼠的成瘤时间明显变长;裸鼠体内肿瘤体积较B组裸鼠的明显减小,说明NK细胞具有抵抗GBM的生长作用,同时也证明了IL-2能增强NK细胞对GBM细胞增殖及生长的抑制作用,在某种机制上减慢了肿瘤的生长。资料显示,Stupp等[9]将IL-2激活的人NK细胞注射神经母细胞瘤的小鼠体内,实验发现NK细胞可以进入瘤体组织中,而且发现了体内注射NK细胞的成瘤小鼠生长时间较对照组明显延长。
NK细胞是非特异性免疫细胞,不需要抗原致敏,可以直接杀死肿瘤和病毒感染的靶细胞。NK细胞表面存在抑制性杀伤受体,靶细胞表面存在人白细胞抗原I类分子(HLA-I)类分子,当受体和此类分子结合时NK细胞的杀伤作用被抑制。当NK细胞结合的细胞表面缺少HAL类分子时才表现出NK细胞的作用。IL-2是免疫系统中的一类细胞生长因子,能调控免疫细胞活性,也参与抗体反应、造血和肿瘤监视,但没有直接杀死肿瘤的作用。本实验研究结果表明:IL-2激活的NK细胞对GBM抑制、杀伤效应,可能是NK细胞抑制胶质瘤细胞表面HLA-I类分子,从而诱发了其活性。有学者发现[9,10],NK细胞存在协同效应的活化机制,如在小鼠的LAK细胞上的NKG2D是一种潜在的协同刺激受体,认为IL-2可通过促进NKG2D的表达活化NK细胞,从而增强了NK细胞对GBM的抑制及杀伤作用。因此,目前IL-2激活的NK细胞的机制还不清楚,关于IL-2激活的NK细胞对胶质瘤的杀伤作用还需进一步研究,希望NK细胞成为治疗脑胶质瘤的关键生物免疫疗法。
综上所述,本次实验初步证明了NK细胞对GBM细胞的抑制杀伤作用,希望通过本篇研究能为脑胶质瘤免疫疗法的进一步研究和治疗提供方向和帮助。
[1]Boiardi A,Bartolomei M,Silvani A,et al. Intratumoral delivery of mitoxantrone in association with 90-Y radioimmunotherapy (RIT) in recurrent glioblastoma[J]. J Neurooncol,2005,72(2):125-131.
[2]Parney IF,Farr-Jones MA,Koshal A,et al. Human brain tumor cell culture characterization after immunostimulatory gene transfer[J]. Neurosurgery,2002,50(5):1094-1102.
[3]Vanhaesebroeck B,Mareel M,Van Roy F,et al. Expression of the tumor necrosis factor gene in tumor cells correlates with reduced tumorigenicity and reduced invasiveness in vivo[J]. Cancer Res,1991,51(8):2229-2238.
[4]Mivechi NF,Dewey WC. DNA polymerase alpha and beta activities during the cell cycle and their role in heat radiosensitization in Chinese hamster ovary cells[J]. Radiat Res,1985,103(3):337-350.
[5]Louis DN,Ohgaki H,Wiestler OD,et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol,2007,114(2):97-109.
[6]Ostrom QT,Gittleman H,Farah P,et al. CBTRUS statistical report:Primary brain and central nervous system tumors diagnosed in the United States in 2006-2010[J]. Neuro Oncol,2013,15(Suppl 2):1-56.
[7]Koshy M,Villano JL,Dolecek TA,et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries[J]. J Neurooncol,2012,107(1):207-212.
[8]Smoll NR,Schaller K,Gautschi OP. Long-term survival of patients with glioblastoma multiforme (GBM)[J]. J Clin Neurosci,2013,20(5):670-675.
[9]Stupp R,Mason WP,van den Bent MJ,et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med,2005,352(10):987-996.
[10]Ishikawa E,Tsuboi K,Takano S,et al. Intratumoral injection of IL-2-activated NK cells enhances the antitumor effect of intradermally injected paraformaldehyde-fixed tumor vaccine in a rat intracranial brain tumor model[J]. Cancer Sci,2004,95(1):98-103.

