颅内小动脉瘤患者基于心动周期的血流动力学特点及其对瘤体破裂的预测价值
王琪,王云,谢杰,赵天,李月峰
江苏大学附属医院,江苏镇江 212001
颅内动脉瘤(IA)破裂是临床急诊中严重的脑血管意外事件,亦是急性蛛网膜下腔出血的最主要原因[1-3]。IA破裂发病危急但起病隐匿,仅有少数患者可表现出动眼神经麻痹等先兆症状,故对其破裂风险实现早期精准预测具有极高的临床防治意义。现有的IA临床指南要求对瘤体直径较大的动脉瘤进行外科干预[4],但最近研究表明破裂可能发生在更小直径的动脉瘤[5]。与此同时,学界亦格外强调重视颅内未破裂小动脉瘤的临床和基础研究。围绕IA破裂预测的报道中,血流动力学参数被认为是最具应用前景的指标[6-7]。然而,其依存的机械式血管仿真模型限制了临床价值的进一步发掘,尤其是忽略了对流体参数极具影响的心动周期。基于此,课题组借助医工结合的学科交叉优势,拟建立一种基于心动周期驱动的血流参数特点对颅内小动脉瘤破裂风险进行预测,以期进一步提升血流动力学参数的预测精准性和应用可行性。
1 资料与方法
1.1 临床资料 本研究为前瞻性设计,经江苏大学附属医院医学伦理委员批准。自2016年1月—2019年12月在江苏大学附属医院和江苏大学第四附属医院收集698例IA患者资料,并对其进行为期3年的随访。入组标准:①性别不限,年龄41~86岁;②经头颅CTA检查确诊为IA;③经神经外科医师评估为低破裂风险(动脉瘤直径<5.0 mm、未处于血管分叉处、无明显膨出面或脂囊),仅需随访观察;④具备完整的随访影像学资料;⑤无躯体重大器质性疾病;⑥无精神类疾病及药物依赖和服用史;⑦受试者均知情并签署同意书。排除标准:①头颅血管畸形或发育异常;②曾行颅脑外科手术或金属类器材植入术后;③动脉瘤多发且瘤体位置毗邻;④颈动脉岩部段动脉瘤。
1.2 随访方法与终点判断 每隔6个月,受试者复查头颅CTA或者MRA。随访终点:①瘤体增大,进入治疗程序,予以排除;②瘤体破裂;③瘤体未破裂。
1.3 基于心动周期驱动的血管流体模型的建立
1.3.1 头颅CTA成像 入组后采用美国GE 256排Revolution CT设备进行头颅CTA成像。扫描参数:管电压120 kV,管电流250 mA,层厚0.625 mm,层距0.625 mm,螺距0.938,矩阵512×512。患者取仰卧位,头部固定、上肢弯曲于胸前。用高压双筒注射器将对比剂(碘海醇350 mg I/mL)40 mL以5 mL/s注入右前臂肘静脉,后以同等流速追加生理盐水30 mL。先进行定位相和预扫描,在颈动脉分叉位置进行平扫。全脑扫描后确定延长时间20 s,选取主动脉弓下层面降主动脉作为感兴趣区;触发阈值120 HU时自动进行增强扫描,并采集图像传入工作站得到原始DICOM影像数据。所有操作各由1名经验丰富的影像科医师和护师共同完成。
1.3.2 IA模型的建立 将DICOM图像导入Mimics 17.0(Materialise)软件,并对其进行空间定位标记。利用阈值检测工具在横断面测量感兴趣区的血管灰度值分布并选取阈值范围,采用阈值分割、区域生长及手动分割方法获得脑血管横断面的Mask,后通过容积重建获得三维动脉瘤模型。使用3-matic后处理对重建好的三维模型进行平滑等初步处理后,以stl格式导入Geomagic软件光顺、填充、修复。见图1。
1.4 基于心动周期的血流动力学参数分析 将优化后的模型导入ICEM CFD(ANSYS运算平台),定义入口、出口及壁面,网格类型采用非结构化六面体网格进行划分,将其导入CFX进行分析。血管壁设为无滑动的刚性壁,血液设为不可压缩的牛顿流体及层流[密度为1 056 kg/m3,黏度为0.003 5(Pa·s)],不考虑能量传递。出口设为自由边界,入口设为随时间变化的脉动曲线。本研究对不同动脉瘤所施加的入口条件是根据各个体在一个心动周期内各时刻的颈内动脉血流速度拟合出的脉动速度曲线。本研究将模拟3个时长为0.8 s、时间步长为0.01 s的心动周期,取最后1个心动周期的结果。在脉动速度曲线中取快速射血期末t1(t=0.08 s)、减慢射血期末t2(t=0.24 s)和舒张期后期t3(t=0.34 s)3个经典时刻[8],分别记录1个心动周期内这3个时刻内的壁面压力(P)、剪切力(WSS)、涡流数(Nv)。
1.5 统计学方法 采用SPSS22.0统计软件。在瘤体破裂与未破裂者的临床资料、基线水平血流动力学参数中,计量资料以-x±s表示,组间比较采用独立样本t检验。计数资料以百分率表示,组间比较采用χ2检验。瘤体破裂与未破裂者差异性血流动力学参数与颅内小动脉瘤瘤体破裂者动脉瘤瘤体大小及破裂时间的关系采用Pearson相关分析。以多因素Logistic回归分析筛选IA破裂的独立危险因素,对有统计学意义的连续变量进行受试者工作(ROC)曲线分析,并计算ROC曲线下面积(AUC)以确定区分破裂与未破裂的最佳阈值。P<0.05为差异有统计学意义。

图1 颅内动脉瘤模型的构建过程
2 结果
2.1 颅内小动脉瘤患者随访结果及瘤体破裂与未破裂者的临床资料比较 698例患者中完成随访计划674例,其中3年内发生瘤体破裂38例、未发生瘤体破裂594例、瘤体增大42例(排除)。瘤体破裂者年龄41~86(69.1±6.5)岁,瘤体大小(3.4±0.3)mm3,瘤体位于大脑前动脉12例、其他部位26例,破裂时间3.4~35.1个月、中位时间为26.2个月;瘤体未破裂者年龄41~73(55.4±7.1)岁,瘤体大小(3.3±0.5)mm3,瘤体位于大脑前动脉147例、其他部位447例;两者比较,瘤体破裂者年龄大于未破裂者(P<0.05)。颅内小动脉瘤患者随访3年瘤体破裂与未破裂者其他临床资料比较,见表1。
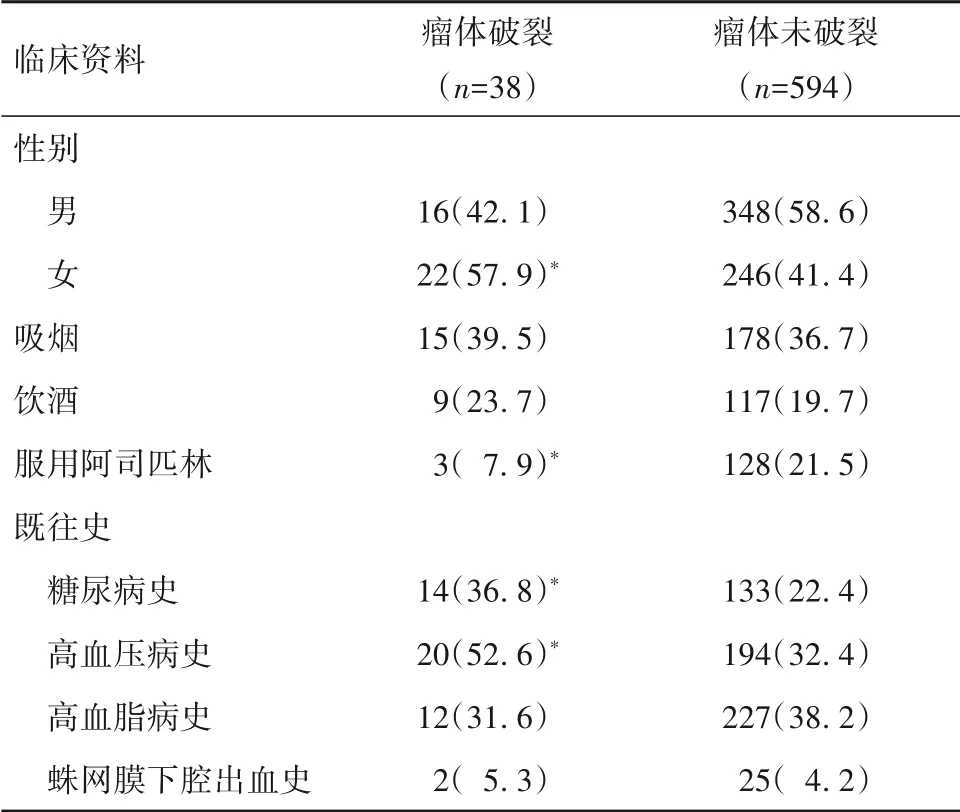
表1 颅内小动脉瘤患者随访3年瘤体破裂与未破裂者的临床资料比较[例(%)]
2.2 颅内小动脉瘤瘤体破裂与未破裂者基线水平血流动力学参数比较 颅内小动脉瘤瘤体破裂者t2WSS低于未破裂者,t3WSS、t3Nv均高于未破裂者(P均<0.05)。见OSID码图1、表2。
表2 颅内小动脉瘤瘤体破裂与未破裂者基线水平血流动力学参数比较(±s)

表2 颅内小动脉瘤瘤体破裂与未破裂者基线水平血流动力学参数比较(±s)
注:与瘤体未破裂者比较,*P<0.05。
瘤体情况破裂未破裂n 38 594 t1 P(Pa)2 686±197 2 729±221 t1 WSS(Pa)3.04±1.07 2.97±1.16 t1 Nv 1.02±0.41 0.96±0.37 t2 P(Pa)1987±216 2 013±197 t2 WSS(Pa)2.31±1.25*2.79±1.24 t2 Nv 1.21±0.36 1.14±0.27 t3 P(Pa)1734±352 1 807±269 t3 WSS(Pa)2.48±1.29*2.09±1.16 t3 Nv 1.34±0.75*0.85±0.67
2.3 差异性血流动力学参数与颅内小动脉瘤瘤体破裂者动脉瘤瘤体大小及破裂时间的相关性 瘤体破裂者t3Nv与瘤体大小呈正相关(r=0.239,P<0.05)、破裂时间呈负相关(r=-0.275,P<0.05),t3WSS与破裂时间呈正相关(r=0.216,P<0.05)。见表3。

表3 破裂组差异性血流动力学参数与动脉瘤瘤体大小、破裂时间的相关性
2.4 差异性血流动力学参数对颅内小动脉瘤瘤体破裂的预测价值 多元Logistic回归分析显示,高血压(OR=1.37,95%CI:1.231~2.485)、阿司匹林服用率(OR=0.74,95%CI:0.352~0.898)、t2WSS(OR=1.65,95%CI:1.460~3.879)和t3Nv(OR=2.03,95%CI1.714~4.296)是颅内小动脉瘤瘤体破裂的独立危险因素。ROC曲线提示,t2WSS和t3Nv预测颅内小动脉瘤瘤体破裂的曲线下面积分别为0.723(95%CI0.605~0.837)和0.707(95%CI0.581~0.741),灵敏度分别为0.654、0.843,特异度分别为0.763、0.756,而两者联合曲线下面积为0.842(95%CI0.801~0.926)、灵敏度为0.862、特异度为0.821。见OSID码图2。
3 讨论
本研究突破机械式血管仿真模型的限制,结合流体力学分析特点,成功将心动周期引入IA的血流动力学模型,不仅筛查出破裂组和未破裂组患者间的差异性血流动力学参数,还探讨了关键参数与瘤体特征的关系,更在此基础上成功构建出直径<5 mm的IA破裂风险的预测模型。本研究结果显示,破裂组比未破裂组的t2WSS更低,t3WSS和t3Nv更高;同时,t3Nv与瘤体大小及破裂时间均相关,t3WSS亦与破裂时间相关;另外,回归模型提示t2WSS和t3Nv是预测瘤体破裂的可靠指标;而且,根据回归模型绘制的ROC曲线提示t2WSS和t3Nv联合的模型对直径<5 mm的IA破裂的预测价值更高。
WSS是血流动力学中最重要的参数,又称血流与血管壁之间的摩擦力。目前,关于WSS在动脉瘤中的作用及意义存在两种主流机制:一方面,增高的WSS可使血管内皮细胞释放一氧化氮等舒血管物质,强烈扩张血管,使局部血管壁退化,从而造成动脉瘤的产生和生长,大幅提高瘤体破裂风险;另一方面,过低的WSS将导致内皮细胞凋亡、管壁损伤,引起动脉瘤破裂[9-12]。这些已有的报道将WSS塑造成双刃剑的角色,即其过高过低均与动脉瘤体的破裂密切相关。而本研究结果发现,破裂组瘤体内的WSS呈多样化,即在t2时刻较低、t3时刻较高。这一发现在解释上述文献报道结果相左的同时,进一步提示具有高破裂风险的瘤体内更可能存在以时间节点为导向的WSS振荡,这种模式或许是动脉瘤破裂的根本原因。
本研究另外发现,破裂组的t3Nv高于未破裂组,且提示其是影响动脉瘤破裂的另一重要风险因素。Nv本质上是对瘤体内血流模式的具体量化,反映了瘤体内的流型复杂性,其值越高流型越复杂[13]。Nv参数代表的涡流可使瘤颈处加速的血流速度在到达瘤顶时显著减慢甚至停滞,而减慢停滞的血流为红细胞、白细胞和血小板聚集并黏附在动脉瘤壁内侧形成附壁小血栓浸润动脉瘤壁提供了病理条件,在破坏管壁的同时显著增加了动脉瘤的破裂风险[14],这同时验证了临床上多数动脉瘤破裂部位在瘤顶。而当动脉瘤瘤体较大时,瘤腔内的血流速度变慢可致涡流长时间存在,加重血管内皮细胞的清除负荷,并显著提升瘤体破裂的风险[15-16]。
与既往有关动脉瘤破裂的研究不同,本文没有采用横断面或回顾性收集入组样本,而是选择对经临床评估进入随访期的带瘤受试者资料进行前瞻性随访,因此本研究均为瘤体直径<5 mm的受试者资料。此种入组方式虽然未能纳入大瘤体样本,但其或更具临床研究价值。此外,在本文的随访中,在最终纳入的674例受试者资料中,其中有38例在3年内发生破裂,年破裂率为1.8%,远高于已有的报道[17],这可能是由于本组受试者多存在高龄、高血压等与动脉瘤破裂相关的危险因素。值得一提的是,本组发生破裂的受试者在破裂前瘤体直径并未增大,提示IA小且稳定的直径可能并不是瘤体的安全锁,临床工作中应充分重视随访期内形态未增大的携瘤患者发生破裂的可能性。
本研究仍存在些许不足之处:①虽然采用前瞻性研究,但是随访时间仅为3年,破裂率并未趋于稳定,未能评价更长周期的破裂风险;②本研究最终纳入的受试者略显不足,仍需要多中心大样本工作深入探索;③随着成像技术的研发和改进,血流动力学模型及其动脉瘤破裂仍有进一步优化的空间。

