电针预处理对慢性炎性痛大鼠脊髓背角组织中mTOR-自噬通路活性的影响
吕丹,栾静,杨艳梅,贺永进
天津市第一中心医院,天津 300192
炎性痛广泛存在于各种急慢性疾病的进程中[1],严重影响患者的生活质量。已有研究表明,电针对炎性痛具有抗炎、镇痛的作用[2-4],但其具体机制目前尚不明确。本课题组前期工作表明,自噬通路障碍参与了大鼠炎性痛的形成和维持[5]。细胞通过自噬形成自噬体,进而利用溶酶体降解细胞质中的大分子物质和受损细胞器,对维持细胞形态结构、代谢和细胞功能的自身稳态有重要作用[6]。哺乳动物雷帕霉素靶蛋白(mTOR)信号通路参与自噬的负调控过程,在相关信号调节中起关键调节作用。mTOR信号通路通过调控局部蛋白合成,对于慢性炎性痛所致的疼痛敏化起重要作用。目前,电针的抗炎镇痛作用是否通过调控mTOR-自噬通路完成尚无相关报道。2018年1月—2020年1月,本研究拟观察电针预处理对慢性炎性痛大鼠脊髓背角组织中mTOR-自噬通路的影响,为明确其抗炎镇痛作用机制提供参考。
1 材料与方法
1.1 主要材料 健康成年雄性SD大鼠(体质量180~240 g,天津医科大学实验动物中心)32只,饲养于室温(22~26℃)、昼夜交替的环境中。主要试剂:蜜蜂毒和RIPA细胞裂解液(Sigma公司,美国);自噬相关蛋白(LC3Ⅱ、Beclin-1、p62)及mTOR相关信号通路蛋白(mTOR、p-mTOR、S6K、p-S6K)一抗(Cell Signaling technology公司,美国);二抗为HRP标记的山羊抗兔或鼠抗体(北京中杉金桥公司);内参β-Tubulin一抗(Sigma公司,美国)。主要仪器:von-Frey纤维(Stoelting公司,美国);电针治疗仪(G6805,上海涵飞医疗器械有限公司);热刺激仪(RTY 3型,西安凤岚仪器厂);低温离心机(Beckman公司L-90K,美国);电泳仪和半干转膜仪(Bio-Rad公司Mini-Pro和Trans-Blot SD,美国);凝胶成像分析系统(Alpha Innotech公司,美国)。
1.2 动物分组与造模处理 适应性喂养1周后,将SD大鼠按随机数表法分为对照组(C组)、炎性痛组(IP组)、电针预处理组(EA组)、非穴位电针预处理组(NE组)各8只。IP组、EA组、NE组大鼠左侧后肢足底皮下注射蜜蜂毒溶液0.2 mg/50μL制备慢性炎性痛模型[7],C组同部位注射等体积无菌生理盐水;EA组造模前3 d每天给予左侧阳陵泉、足三里电针刺激(疏密波,频率2 Hz,电流2 mA,刺激时间30 min),电针结束后1 h造模;NE组左侧阳陵泉、足三里旁开5 mm给予电针刺激,余方法同EA组。
1.3 痛阈测定 造模后2 h,测定各组大鼠机械刺激缩足阈(MWT)和热刺激缩足潜伏期(TWL)。将待测大鼠置于金属网格垫(30 cm高)上并适应30 min,使用Von-Frey纤维按由小到大(1.0、2.5、3.5、4.0、4.5、5.0、7.5、10.0、15.0、20.0、30.0、40.0、50.0、60.0 g)的刺激强度顺序反复刺激大鼠足底中心10次,每次间隔3~5 s,MWT为出现50%以上缩足反射的强度。热刺激仪设置100 W卤素投射灯和10 V电压,调整灯源与玻璃板的距离直至获得5 mm足底照射光圈直径。TWL为从开始照射至出现缩足逃避反射的时间(s),同一部位间隔10 min测量1次,重复3~5次,取平均值作为最终指标;为避免足底组织过度热损伤,>30 s无反应则停止照射。
1.4 脊髓背角组织中自噬及mTOR相关信号通路蛋白检测 痛阈测定结束后,处死大鼠;液氮冷冻研磨脊髓背角组织后,加入预冷的RIPA细胞裂解液;冰上匀浆后,低温离心机内4℃下20 000 r/min离心10 min,上清即为组织总蛋白。取蛋白样品,行SDS-PAGE凝胶电泳;将电泳后的凝胶与NC膜、超厚转移用滤纸一起置于半干电转槽上转膜,转膜后用5%脱脂牛奶室温下封闭1 h;分别加入LC3Ⅱ、Beclin-1、p62抗体一抗(1∶1 000),mTOR、p-mTOR、S6K、p-S6K抗体一抗(1∶500),β-Tubulin抗体(1∶10 000),4℃过夜;PBST漂洗,加入HRP标记的山羊抗兔或鼠抗体(1∶5 000)室温孵育1 h;采用凝胶成像分析系统拍照,使用FluorChemⅡ分析软件分析图像,以目的蛋白与内参条带灰度值比值表示目的蛋白相对表达量。
1.5 统计学方法 采用SPSS25.0统计软件。计量资料以±s表示,多组间比较行单因素方差分析,组间两两比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组MWT、TWL比较 与C组比较,IP组和NE组MWT降低、TWL缩短(P均<0.01),EA组各指标差异无统计学意义;与IP组比较,EA组MWT升高、TWL延长(P均<0.01),NE组各指标差异无统计学意义。见表1。
表1各组MWT、TWL比较(±s)
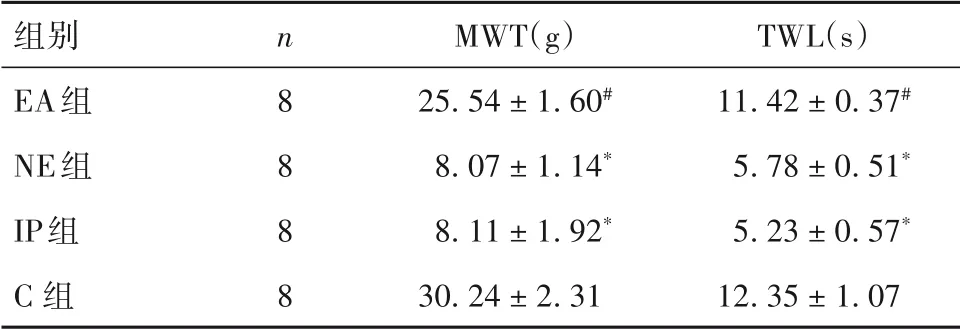
表1各组MWT、TWL比较(±s)
注:与C组比较,*P<0.01;与IP组比较,#P<0.01。
组别EA组NE组IP组C组n 8 8 8 8 MWT(g)25.54±1.60#8.07±1.14*8.11±1.92*30.24±2.31 TWL(s)11.42±0.37#5.78±0.51*5.23±0.57*12.35±1.07
2.2 各组大鼠脊髓背角组织中自噬及mTOR相关信号通路蛋白表达比较 与C组比较,其余各组脊髓背角组织中LC3Ⅱ、Beclin-1和p62表达上调,IP组和NE组脊髓背角组织中p-mTOR、p-S6K表达上调(P均<0.05);与IP组比较,EA组脊髓背角组织中LC3Ⅱ和Beclin-1表达上调而p62、p-mTOR、p-S6K表达下调(P均<0.05),NE组各指标差异无统计学意义。见表2。
表2 各组大鼠脊髓背角组织中自噬及mTOR相关信号通路蛋白表达比较(±s)

表2 各组大鼠脊髓背角组织中自噬及mTOR相关信号通路蛋白表达比较(±s)
注:与C组比较,*P<0.05;与IP组比较,#P<0.05。
组别EA组NE组IP组C组n 8 8 8 8 LC3Ⅱ0.79±0.15*#0.61±0.11*0.65±0.24*0.37±0.08 Beclin-1 1.04±0.23*#0.70±0.19*0.73±0.28*0.46±0.11 p62 0.69±0.21*#1.21±0.26*1.38±0.17*0.54±0.14 p-mTOR 0.87±0.11 1.57±0.14*1.89±0.19*0.82±0.24 mTOR 0.83±0.21 0.98±0.19 1.19±0.14 0.91±0.15 p-S6K 0.79±0.15#1.62±0.08*1.54±0.15*0.85±0.22 S6K 1.01±0.16 0.99±0.22 1.09±0.24 0.88±0.17
3 讨论
针灸疗法是一种传统的中医治疗方法,临床治疗和相关研究均表明电针刺激可以缓解慢性持续性疼痛,例如慢性炎性痛、神经性痛和癌性痛等。有研究表明,电针可抑制脊髓中外周炎症诱导的Fos蛋白表达[8],还可抑制脊髓阿片类物质、血清素、去甲肾上腺素、谷氨酸、胶质细胞/细胞因子及信号分子等引起的脊髓水平伤害性信息的传递[9-11]。然而,电针抗炎镇痛作用的分子信号机制尚不明确,对于该机制的研究为本文的研究重点。
本课题组前期研究已证实,自噬通路障碍参与了大鼠炎性痛的形成和维持[5]。自噬是真核细胞维持其自身稳态的高度保守行为,主要调节方式为降解细胞内受损的大分子物质或者细胞器[6]。在生理状态下,自噬处于较低水平;在各种病理刺激下(感染、创伤、营养缺乏、缺氧、缺血等),自噬会被激活,从而启动细胞相应的应激防御[12]。细胞自噬涉及多种信号通路,其中mTOR信号通路在调节抑制自噬方面起着关键作用。在中枢神经系统中,当神经系统受到损害时,增强自噬能抑制神经元凋亡[13],而抑制自噬则会导致凋亡增加[14]。
LC3是哺乳动物细胞中酵母自噬相关基因8的同源物,是最常用的自噬蛋白标志物[15];Beclin-1通过调节自噬的起始来调节自噬水平,细胞内Beclin-1表达水平增高意味着细胞自噬增强;p62作为一种特异的泛素结合蛋白,在自噬过程中可与LC3选择性结合并转入到自噬体,进而形成自噬溶酶体并被降解,p62的蓄积增多表明自噬过程受到抑制[16]。另外,现有研究表明,自噬主要通过mTOR依赖的细胞信号转导途径进行调控[17]。作为一种重要的信号调节通路,mTOR-自噬通路参与基因转录、蛋白质翻译起始、核糖体合成、细胞周期调控以及细胞能量代谢等多种途径,进而在生理病理过程中发挥重要作用。
本研究结果表明,与C组比较,IP组、EA组、NE组脊髓背角组织中LC3Ⅱ、Beclin-1和p62表达上调;与IP组比较,EA组脊髓背角组织中LC3Ⅱ和Beclin-1表达上调而p62表达下调。这提示在大鼠炎性痛形成和维持过程中脊髓背角细胞自噬功能受到抑制,电针预处理可诱导自噬增强;从而证实mTOR通路是调控自噬功能的重要信号途径,电针预处理对大鼠炎性痛的改善作用是通过增强脊髓背角细胞自噬功能实现的。本研究结果还发现,与C组比较,IP组和NE组脊髓背角组织中p-mTOR和p-S6K表达上调;与IP组比较,EA组脊髓背角组织中p-mTOR和p-S6K表达下调。这提示在大鼠炎性痛形成和维持过程中mTOR信号通路被激活,脊髓背角细胞自噬功能被抑制。因此,我们认为电针预处理通过调节mTOR信号通路,进而增强脊髓背角细胞自噬功能,最终产生抗炎镇痛的作用。

