白细胞介素-22在猪螺杆菌感染的肥胖小鼠胃黏膜相关淋巴组织中的表达及意义
孔玲玲,田字彬,杨 林,张翠萍,于亚男,杨若明,刘亚倩,张帅庆
1.青岛大学附属医院消化内科,山东 青岛 266003; 2.山东大学齐鲁医院(青岛)消化内科
猪螺杆菌(Helicobacter suis,H.suis),即海尔曼螺杆菌(Helicobacter heilmannii,Hh)1型,是一种螺旋状但不同于幽门螺杆菌(Helicobacter pylori,H.pylori)的革兰氏阴性杆菌,因其主要定植于猪胃黏膜中,故又称猪螺杆菌。除H.pylori外,这类细菌在人类胃黏膜中感染率最高,与胃炎、胃溃疡、胃黏膜相关淋巴组织(mucosa associated lymphoid tissue,MALT)淋巴瘤等疾病的发生密切相关。与H.pylori不同的是,H.suis感染引起胃腺癌较为少见[1]。研究[2]表明,H.suis可稳定定植于小鼠胃黏膜,感染6个月后绝大多数小鼠胃中可出现胃MALT淋巴瘤特征性的淋巴上皮病变。
目前,全球肥胖的发病率逐年升高,作为一种慢性低度炎症状态,肥胖是多种癌症发生的危险因素。相关研究[3]发现,肥胖与胃MALT淋巴瘤的发生也密切相关;抑制或逆转肥胖状态可以降低与肥胖相关的胃MALT淋巴瘤的发病风险。我们的前期研究[4]表明,高脂饮食诱导的肥胖可能通过上调脂肪因子瘦素(leptin)及相关炎症因子与趋化因子在胃黏膜的表达,促进了H.suis感染后胃MALT的形成。
异位淋巴组织(tertiary lymphoid organs,TLOs),也称为三级淋巴器官,是某些自身免疫疾病、慢性炎症反应刺激的区域中发现的一种新生淋巴组织,其结构和功能类似于淋巴结和脾脏等二级淋巴器官,其由大量免疫细胞组成,能诱发多种免疫性疾病,加快疾病的发展进程并诱导恶性克隆性B淋巴细胞表达。国外研究[5]发现,IL-22可诱导趋化因子CXCL12、CXCL13表达上调及B淋巴细胞定植,参与肠黏膜相关淋巴样组织(gut-associated lymphoid tissue,GALT)的形成。此外,在H.pylori感染相关性胃炎患者胃黏膜IL-22 mRNA的表达水平较无H.pylori感染者明显增高,且其表达水平与H.pylori的毒力因素呈正相关[6]。
本研究通过检测IL-22及其受体IL-22R1在H.suis感染的肥胖小鼠胃MALT中的表达情况,初步探讨肥胖促进H.suis感染后胃MALT形成的可能机制,为H.suis感染相关性疾病的诊治提供理论依据。
1 材料与方法
1.1实验动物及分组40只8周龄SPF级C57BL/6雌性小鼠,购自济南朋悦实验动物繁育有限公司,体质量为17~19 g,饲养于青岛大学附属医院动物中心实验室(SPF级)。小鼠随机分为4组,即正常对照组(NC组)、感染组(HS组)、高脂饮食组(HFD组)、感染+高脂饮食组(HS+HFD组),每组10只。HS组与HS+HFD组予本实验室已感染H.suis供体小鼠的胃黏膜匀浆液灌胃(0.2 ml/只,根据文献[7]方法已行PCR检测证实供体小鼠胃内仅有H.suis而无H.pylori等其他螺杆菌感染定植)。NC组与HS组小鼠给予普通饲料喂养,HFD组与HS+HFD组小鼠自感染后第3周开始给予高脂饮食(高脂饲料购自Research Diets Inc,脂肪占总热量的45%),每周测1次小鼠体质量。差异性饮食24周后处死小鼠。
1.2小鼠胃组织标本的收集各组小鼠采用腹腔注射质量浓度为100 g/L的水合氯醛(400 mg/kg)麻醉后取胃组织,沿着胃大弯剪开,一半胃组织石蜡包埋行苏木精-伊红染色(HE染色),另一半胃组织用于提取RNA。
1.3主要试剂反转录试剂盒与PCR试剂购自大连宝生物工程有限公司,Sybr Green qPCR Mix与组织DNA提取试剂盒购自北京天根生化科技有限公司。Real-time PCR引物均由上海生工生物工程技术服务有限公司合成。
1.4相关指标检测胃组织标本经石蜡包埋后连续10 μm切片,行HE染色后检测单位长度胃黏膜内淋巴滤泡的数量及大小。采用Trizol法提取胃组织总RNA,检测RNA纯度和浓度后,取1 μg RNA反转录成cDNA(操作方法按照反转录试剂盒进行)。采用Sybr荧光定量PCR技术(Quantitative Real-time PCR)及ΔΔCt法检测确定各组小鼠胃黏膜中H.suis16S rRNA、IL-22、IL-22R1及趋化因子CXCL13 mRNA的相对表达量。所用引物如下:IL-22 上游:5′-CTGCTTCTCATTGCCCTGT-3′,下游:5′-ATCGTCAACCGCACCTTTAT-3′;IL-22R1上游:5′-AGGTCCATTCAGATGCTGGT-3′,下游:5′-TAGGTGTGGTTGACGTGGAG-3′;CXCL13 上游:5′-CATAGATCGGATTCAAGTTACGCC-3′;下游:5′-TCTTGGTCCAGATCACAACTTCA-3′;β-actin 上游:5′-AAGGCCAACCGTGAAAAGAT-3′,下游:5′-GTGGTACGACCAGAGGCATAC-3′。反应体系(25 μl)包括:Sybr qPCR Mix 12.5 μl、无菌蒸馏水8.2 μl,上下游引物各0.4 μl(终浓度0.2 μmol/L),ROX 2.5 μl。
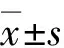
2 结果
2.1各组小鼠的体质量变化差异性饮食24周后,HFD组较NC组、HS+HFD组较HS组体质量明显增加(P<0.01,见表1);NC组与HS组、HFD组与HS+HFD组体质量比较,差异无统计学意义(P>0.05),表明H.suis未显著影响小鼠的体质量变化。
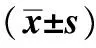
表1 各组小鼠的体质量变化Tab 1 Changes of body mass in each mice group(±s) g
注:与NC组相比,*P<0.01;与HS组相比,#P<0.01。
2.2各组小鼠胃黏膜淋巴滤泡形成情况与胃内菌量H.suis感染24周后的小鼠胃黏膜中可见淋巴滤泡生成,且HS+HFD组小鼠的胃黏膜淋巴滤泡较HS组明显增大、增多,而NC组与HFD组小鼠未见胃淋巴滤泡形成(见表2、图2)。采用H.suis特异性的16S rRNA引物检测HS组与HS+HFD组小鼠胃黏膜中的相对菌量,发现两组小鼠胃黏膜H.suis16S rRNA的表达水平比较,差异无统计学意义(P>0.05,见表2),表明高脂饮食未显著影响H.suis在胃内的定植量。
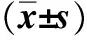
表2 小鼠胃黏膜淋巴滤泡的形成及感染H.suis后胃内菌量Tab 2 The formation of lymphoid follicles in the gastric mucosa of miceand the amount of bacteria in the stomach after infection (±s)

图1 各组小鼠胃黏膜淋巴滤泡形成情况(HE 100×) A:NC组;B:HFD组;C:HS组;D:HS+HFD组
2.3IL-22及其受体IL-22R1、趋化因子CXCL13在H.suis感染的肥胖小鼠胃MALT中的表达差异性饮食24周后,HS组与HS+HFD组小鼠胃黏膜IL-22 mRNA、CXCL13 mRNA的表达水平分别较NC组和HFD组明显升高(P<0.05),且HS+HFD组的表达水平显著高于HS组(P<0.01);而HS组中IL-22R1的表达明显高于其他各组,在HFD组中的表达水平最低(见表3)。
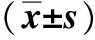
表3 各组小鼠胃黏膜IL-22及其受体IL-22R1与CXCL13mRNA表达水平Fig 3 The expressions of IL-22 and its receptor IL-22R1, CXCL13 mRNA in each group(±s)
注:与NC组相比,*P<0.01;与HFD组相比,&P<0.01;与HS组相比,#P<0.01。
3 讨论
H.suis是人胃内除H.pylori之外最常见的螺杆菌,虽感染率较低,但能自然定植于人和动物胃内并诱发疾病。由于H.pylori较难长期稳定定植于小鼠胃内,诱导胃黏膜癌变或胃MALT淋巴瘤的形成耗时较长、成功率较低,极大地阻碍了相关胃部疾病致病机理与治疗效果的研究。国外研究[1,8-9]报道,H.suis可稳定定植于C57BL/6小鼠胃内并引起胃MALT淋巴瘤形成,而国内对H.suis感染后胃MALT淋巴瘤形成的机制研究甚少[10]。H.suis可作为H.pylori研究的替代工具,阐明螺杆菌与特异宿主之间的相互作用关系,为研究胃MALT淋巴瘤的发病机制提供了一个重要途径[7]。
肥胖与全身慢性炎症状态密切相关。目前,大量流行病学资料[11-13]显示,肥胖是多种肿瘤发病的重要危险因素,且能增加其死亡风险,其机制可能与胰岛素样生长因子-1(IGF-1)、瘦素(leptin)、血管内皮生长因子(VEGF)等炎性因子的表达量增加有关[14]。另外,肥胖时脂肪组织中T细胞、巨噬细胞浸润增多,活化后可分泌多种促炎因子与趋化因子,如IL-6、IFN-γ、CCL2等,诱导参与了异位淋巴样组织的形成。相关研究[15]报道,IL-22在肥胖患者及小鼠体内表达量增加,发挥促炎作用,促进疾病的发生。
IL-22在参与调节人体黏膜内稳态及促进上皮组织修复中发挥了重要作用[16-17]。近期研究[18]表明,IL-22可促进恶性上皮细胞增殖,但其在慢性炎症中的研究仍然较少。国外研究已揭示了黏膜IL-22的表达与人体体液免疫之间的关系,而BARONE等[5]研究发现,IL-22是异位淋巴组织形成过程中一种重要的趋化因子,可通过促进CXCL13的分泌诱导肠黏膜异位淋巴组织的形成,给予小鼠腹腔注射IL-22抗体后异位淋巴组织被明显抑制。同样,我们前期研究[19]发现,给予H.suis感染小鼠腹腔注射CXCL13抗体后可明显抑制胃淋巴滤泡的形成,说明CXCL13是胃淋巴滤泡形成的关键因子。本研究发现,高脂饮食诱导的肥胖可促进H.suis感染后胃MALT的形成,并伴有IL-22及CXCL13表达水平的增高。HS组小鼠胃黏膜IL-22、CXCL13的表达水平均较NC组升高,但显著低于HS+HFD组,说明肥胖与H.suis感染共同促进了IL-22与CXCL13的表达,上调的IL-22可能通过诱导CXCL13的表达进而募集B淋巴细胞迁移至胃黏膜,参与了胃MALT形成。国外研究[20]发现,肥胖小鼠IL-22R1的表达量低于正常小鼠,且IL-22R1基因缺陷的肥胖小鼠较无IL-22R1基因缺陷的肥胖小鼠更易导致体质量的增加及罹患胰岛素抵抗的风险。在本研究中,HFD组IL-22R1的表达水平均低于其他各组,其原因可能也与肥胖抑制IL-22R1表达有关,有待今后进一步研究。
综上所述,高脂饮食诱导的肥胖可能通过上调IL-22,促进CXCL13的表达,参与H.suis感染后胃MALT的形成。今后利用IL-22缺陷小鼠或进行IL-22抗体阻断研究将有助于进一步阐明IL-22在肥胖促进H.suis感染后胃MALT形成过程中的具体作用机制。
[1] HAESEBROUCK F, PASMANS F, FLAHOU B, et al. Gastric helicobacters in domestic animals and nonhuman primates and their significance for human health [J]. Clin Microbiol Rev, 2009, 22(2): 202-223. DOI: 10.1128/CMR.00041-08.
[2] NAKAMURA M, MURAYAMA S Y, SERIZAWA H, et al. “Candidatus Helicobacter heilmannii” from a cynomolgus monkey induces gastric mucosa-associated lymphoid tissue lymphomas in C57BL/6 mice [J]. Infect Immun, 2007, 75(3): 1214-1222. DOI: 10.1128/IAI.01459-06.
[3] 许松欣, 邓彬, 陈姚生, 等. 减重手术是否降低肥胖相关肿瘤发病风险的Meta分析[J]. 中华胃肠外科杂志, 2015, 18(11): 1144-1148. DOI: 10.3760/cma.j.issn.1671-0274.2015.11.019.
XU S X, DENG B, CHEN Y S, et al. Does bariatric surgery decrease the risk of obesity-related tumor: a meta-analysis [J]. Chin J Gastrointest Surg, 2015, 18(11): 1144-1148. DOI: 10.3760/cma.j.issn.1671-0274.2015.11.019.
[4] 杨若明, 田字彬, 杨林, 等. 肥胖对猪螺杆菌感染后胃黏膜相关淋巴样组织形成的影响[J]. 中华微生物学和免疫学杂志, 2016, 36(11): 807-811. DOI: 10.3760/cma.j.issn.0254-5101.2016.11.002.
YANG R M, TIAN Z B, YANG L, et al. Effects of obesity on the formation of gastric mucosa associated lymphoid tissue (MALT) during Helicobacter suis infection [J]. Chin J Microbiol Immunol, 2016, 36(11): 807-811. DOI: 10.3760/cma.j.issn.0254-5101.2016.11.002.
[5] BARONE F, NAYAR S, CAMPOS J, et al. IL-22 regulates lymphoid chemokine production and assembly of tertiary lymphoid organs [J]. Proc Natl Acad Sci U S A, 2015, 112(35): 11024-11029. DOI: 10.1073/pnas.1503315112.
[6] ZHUANG Y, CHENG P, LIU X, et al. A pro-inflammatory role for Th22 cells in Helicobacter pylori-associated gastritis [J]. Gut, 2015, 64(9):1368-1378. DOI: 10.1136/gutjnl-2014-307020.
[7] 杨若明, 杨林, 田字彬, 等. Helicobacter suis感染小鼠模型的建立及其意义[J]. 中国人兽共患病学报, 2016, 32(7): 604-607. DOI: 10.3969/j.issn.1002-2694.2016.07.003.
YANG R M, YANG L, TIAN Z B, et al. Establishment of mice model with Helicobacter suis infection and its significance [J]. Chinese Journal of Zoonoses, 2016, 32(7): 604-607. DOI: 10.3969/j.issn.1002-2694.2016.07.003.
[8] NOBUTANI K, YOSHIDA M, NISHIUMI S, et al. Helicobacter heilmannii can induce gastric lymphoid follicles in mice via a Peyer’s patch-independent pathway [J]. FEMS Immunol Med Microbiol, 2010, 60(2): 156-164. DOI: 10.1111/j.1574-695X.2010.00731.x.
[9] YANG L, YAMAMOTA K, NISHIUMI S, et al. Interferon-γ-producing B cells induce the formation of gastric lymphoid follicles after Helicobacter suis infection [J]. Mucosal Immunol, 2015, 8(2): 279-295. DOI: 10.1038/mi.2014.66.
[10] 周志韶, 马澄城, 廖赞豪, 等. 广东潮阳地区海尔曼螺杆菌感染与食管疾病的相关性研究[J]. 世界华人消化杂志, 2004, 12(7): 1593-1595. DOI: 10.3969/j.issn.1009-3079.2004.07.019.
ZHOU Z S, MA C C, LIAO Z H, et al. Relationship between Helicobacter heilmannii infection and esophageal diseases in Chaoyang, Guangdong Province, China [J]. World Chin J Digestol, 2004, 12(7): 1593-1595. DOI: 10.3969/j.issn.1009-3079.2004.07.019.
[11] IYENGAR N M, HUDIS C A, DANNENBERG A J. Obesity and cancer: local and systemic mechanisms [J]. Annu Rev Med, 2015, 66: 297-309. DOI: 10.1146/annurev-med-050913-022228.
[12] LEE C H, WOO Y C, WANG Y, et al. Obesity, adipokines and cancer: an update [J]. Clin Endocrinol (Oxf), 2015, 83(2): 147-156. DOI: 10.1111/cen.12667.
[13] SONG M, CHOI J Y, YANG J J, et al. Obesity at adolescence and gastric cancer risk [J]. Cancer Causes Control, 2015, 26(2): 247-256. DOI: 10.1007/s10552-014-0506-z.
[14] LI Q, ZHANG J, ZHOU Y, et al. Obesity and gastric cancer [J]. Front Biosci (Landmark Ed), 2012, 17: 2383-2390.doi:10.3969/j.issn.1006-5709.2018.02.019
[15] DALMAS E, VENTECLEF N, CAER C, et al. T cell-derived IL-22 amplifies IL-1β-driven inflammation in human adipose tissue: relevance to obesity and type 2 diabetes [J]. Diabetes, 2014, 63(6): 1966-1977. DOI: 10.2337/db13-1511.
[16] SONNENBERG G F, FOUSER L A, ARTIS D. Functional biology of the IL-22-IL-22R pathway in regulating immunity and inflammation at barrier surfaces [J]. Adv Immunol, 2010, 107: 1-29. DOI: 10.1016/B978-0-12-381300-8.00001-0.
[17] SONNENBERG G F, FOUSER L A, ARTIS D. Border patrol: regulation of immunity, inflammation and tissue homeostasis at barrier surfaces by IL-22 [J]. Nat Immunol, 2011, 12(5): 383-390. DOI: 10.1038/ni.2025.
[18] KIRCHBERGER S, ROYSTON D J, BOULARD O, et al. Innate lymphoid cells sustain colon cancer through production of interleukin-22 in a mouse model [J]. J Exp Med, 2013, 210(5): 917-931. DOI: 10.1084/jem.20122308.
[19] YAMAMOTO K, NISHIUMI S, YANG L, et al. Anti-CXCL13 antibody can inhibit the formation of gastric lymphoid follicles induced by Helicobacter infection [J]. Mucosal Immunol, 2014, 7(5): 1244-1254.
[20] WU H, BALLANTYNE C M. Inflammation versus host defense in obesity [J]. Cell Metab, 2014, 20(5): 708-709. DOI: 10.1016/j.cmet.2014.10.013.

