31例嗜酸粒细胞胃肠炎的临床病理分析
周颖蕾, 弋东敏, 张海辉, 龚智泉, 丁松泽, 李 健
河南省人民医院 1.消化内科; 2.病理科,河南 郑州 450003
嗜酸粒细胞胃肠炎(eosinophilic gastroenteritis,EG)是一种临床上少见的、以外周血嗜酸粒细胞(eosinophils,Eos)异常浸润胃肠道黏膜为特征的原发性消化道疾病,其病因目前尚未明确,且临床表现缺乏特异性,常因临床医师对该病认识不足而延误病情[1-2]。本文通过对2011年6月至2016年7月河南省人民医院确诊的31例EG患者的临床资料进行回顾性分析,并结合相关文献总结临床经验,以提高临床医师对该病的认识及诊疗水平,降低误诊、漏诊率。
1 资料与方法
1.1一般资料收集2011年6月至2016年7月河南省人民医院共诊治的EG患者31例,男19例,女12例,男女比例1.58∶1,年龄(41.6±15.7)岁(12~65岁),其中30~50岁18例(58.1%),发病至确诊时间为3 d~6年。
1.2纳入标准31例EG患者均符合以下诊断标准[3-6]:(1)存在消化道症状:腹痛、恶心、呕吐、腹胀、腹泻;(2)胃肠道组织病理见Eos计数≥20/HPF或腹水见大量Eos;(3)排除寄生虫感染、高嗜酸粒细胞综合征、恶性肿瘤、炎症性肠病、结缔组织疾病及利福平、硫唑嘌呤等药物应用。
1.3临床分型标准根据临床症状和辅助检查对31例EG患者进行以下临床分型[5-6]:(1)黏膜型:临床表现为腹痛、恶心、呕吐、腹泻、蛋白丢失性肠病、贫血、营养不良、体质量减轻,内镜下表现以黏膜皱襞局部或弥漫性增厚常见,也可表现为息肉、溃疡、肠腔狭窄,组织病理见黏膜层或黏膜下层Eos异常浸润;(2)肌层型:主要表现为幽门或肠梗阻症状,影像学表现为狭窄、梗阻、胃肠动力障碍,组织病理见肌层Eos异常浸润;(3)浆膜型:表现为明显腹胀,腹水病理见大量Eos,影像学表现为中等量以上腹水,也可表现为肠系膜增厚、模糊。
1.4分析方法采用回顾性分析方法,对31例确诊EG患者的临床症状及体征、过敏史、影像资料、病理结果及治疗用药情况进行综合分析,并从性别、临床分型、有无过敏史、是否激素治疗等不同方面进行分组比较。

2 结果
2.1过敏体质31例EG患者中,过敏体质12例(38.7%),其中食物过敏1例且为本病发病的诱因,药物过敏7例(1例兼有尘螨过敏史),哮喘病史2例(1例兼有荨麻疹病史),过敏性鼻炎2例(1例兼有酒精过敏史)。2例EG患者每次过敏性鼻炎发作时均诱发本病。
2.2临床表现及分型31例患者均存在不同程度的胃肠道症状。腹痛29例(93.5%)以中上腹间断性隐痛常见,其次为脐周阵发性绞痛,程度剧烈;腹泻9例(29.0%),其中稀水样便8例,黏液脓血便1例;腹胀13例(41.9%);恶心和呕吐16例(51.6%);2个月内体质量下降5 kg以上者4例;反酸、烧心3例;发热2例均为低热;黑便1例。腹部压痛20例,其中中上腹及脐周压痛16例;腹肌紧张2例,反跳痛2例;移动性浊音阳性3例;振水音阳性1例;肠鸣音活跃8例,减弱甚至消失2例。本文中,黏膜型26例,肌层型2例,浆膜型3例。
2.3实验室检查31例EG患者外周血白细胞计数(3.2~29.7)×109L-1,平均(12.4±7.4)×109L-1,Eos绝对值(0~19.79)×109L-1,平均(4.17±4.92)×109L-1,其中升高者23例(74.2%),血红蛋白降低6例(<110 g/L),白蛋白明显降低者6例(<35 g/L),大便潜血阳性10例,大便寄生虫卵检查均阴性。CA125明显升高者7例(>正常上限值2倍)。20例行血沉检测,4例升高;26例行C-反应蛋白(CRP)检测,4例升高。11例行结核抗体、8例行T-SPOT检查均阴性。5例行腹腔穿刺术,腹水均为渗出液,其中3例腹水沉渣见大量Eos(>90.0%),未见肿瘤细胞。17例行13C呼气试验检测幽门螺杆菌(H.pylori),1例阳性。6例行过敏原检测,2例阳性,其中1例提示对头孢类、尘螨过敏,1例提示对鸡蛋、西红柿、大豆过敏。7例行甲烷-氢呼气试验(检测肠道菌群),5例提示有小肠细菌过度增长。
2.4骨髓细胞学及影像学检查15例行骨髓细胞学检查,结果均提示Eos比值明显增高(6.4%~44.%),且以成熟型为主,外周血涂片Eos比值为12%~68%。2例行FIP1L1-PDGFRα融合基因检测均为阴性。
2.5影像学检查28例行腹部超声,其中7例腹腔积液,13例胆囊炎或胆囊结石,8例脂肪肝,1例腹膜后淋巴结增大,1例胃潴留,1例脾大。4例行消化道造影,其中1例示空肠远端狭窄性病变,1例示回肠局部边缘呈毛刺样改变。19例行腹部CT,其中8例消化道管壁节段性局部或弥漫性水肿增厚(食管下段2例,胃窦2例,十二指肠2例,空回肠5例,结肠1例),2例脾大,3例腹腔或腹膜后淋巴结增大,1例肠系膜区淋巴结肿大,1例腹腔大量腹水,1例单侧胸腔积液。1例行腹部MR示腹腔及腹腔后多发稍大淋巴结。
2.6内镜及病理学检查29例行胃镜检查,25例行结肠镜检查,其中21例同时行胃镜、结肠镜检查,2例行胃镜、结肠镜及单气囊小肠镜检查,1例行超声胃镜检查。内镜下主要表现为黏膜充血红斑,以胃窦、十二指肠最多见,其次为糜烂(见图1A~1B)。黏膜粗糙、苍白、隆起、出血、息肉、溃疡及管腔狭窄少见。1例超声胃镜表现为管壁全层增厚,层次欠清,黏膜皱襞增厚。本文有2例同时伴反流性食管炎,1例伴十二指肠溃疡H期。31例EG患者均行内镜下组织活检,病理表现为黏膜慢性炎伴大量Eos浸润(Eos≥20/HPF)(见图1C~1D)。Eos检出部位以十二指肠、回肠多见(见表1)。31例EG患者,单部位受累者20例,多部位受累者11例。
2.7治疗治疗主要包括剔除饮食、抗过敏、糖皮质激素(简称激素)及对症治疗。31例EG患者均予清淡饮食,并根据过敏原测定结果避免接触明确过敏原,或经验性剔除可疑食物。17例予抗组胺药物应用(扑尔敏4 mg tid或氯雷他定10 mg qd),其中8例治疗有效,4~10 d症状明显缓解或消失,9例无效加用激素治疗。20例予激素治疗,其中11例口服泼尼松龙(20~40 mg,1次/d),9例静滴甲泼尼龙琥珀酸钠(40 mg,qd)3~10 d后改为口服泼尼松龙(30~60 mg,qd)或甲泼尼龙片(24~40 mg,qd),激素治疗平均1周后症状明显缓解,2周后逐渐减量,总疗程为1~3个月,其中1例同时予H.pylori根除治疗。3例予抑酸剂、解痉对症治疗,3~6 d后症状明显缓解。
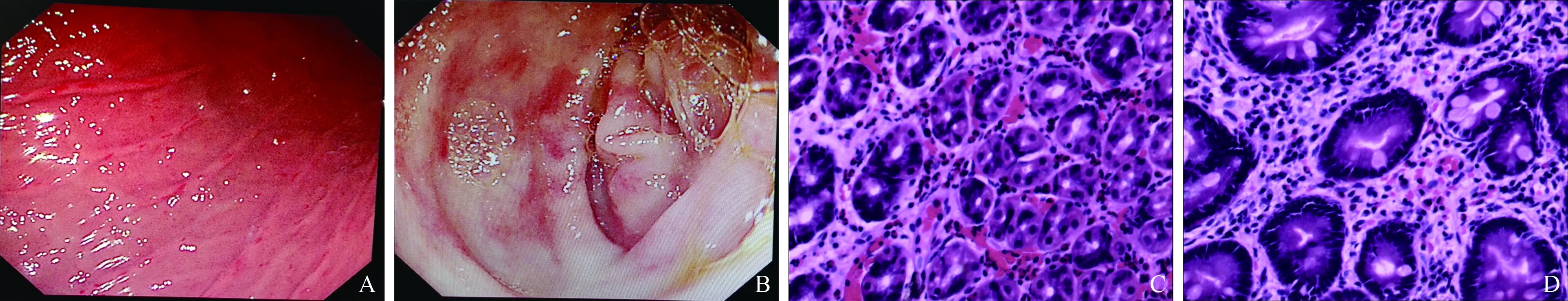
图1 嗜酸粒细胞胃肠炎患者的内镜及病理表现 A:胃体黏膜散在糜烂;B:乙状结肠散在片状充血;C~D:胃体和结肠组织活检示黏膜慢性炎伴大量嗜酸粒细胞浸润(HE 400×)
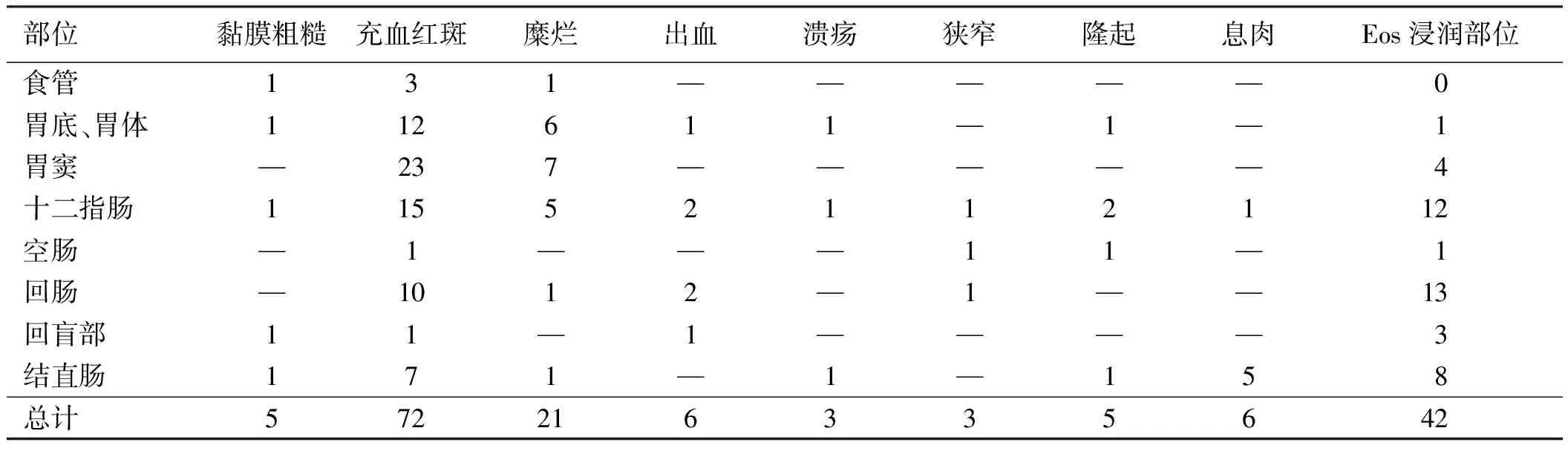
部位黏膜粗糙充血红斑糜烂出血溃疡狭窄隆起息肉Eos浸润部位食管131—————0胃底、胃体112611—1—1胃窦—237—————4十二指肠11552112112空肠—1———11—1回肠—1012—1——13回盲部11—1————3结直肠171—1—158总计572216335642
2.8随访31例EG患者电话随访至2016年9月30日,其中3例因联系方式更换而失访。完成随访的EG患者中,有6例复发,其中1例肌层型,5例黏膜型。1例服用中药治疗后症状消失。1例反复出现腹痛,且每次发作均由过敏性鼻炎诱发,予扑尔敏(4 mg tid)3~5 d后腹痛消失。4例激素治疗后复发:1例再次予泼尼松片(50 mg qd)治疗5 d后腹泻消失;2例症状轻微予抑酸剂、解痉对症治疗好转;1例肌层型因连续口服甲泼尼龙片40 mg qd 1个月后诱发双肺真菌性感染,停止激素4个月后致使幽门梗阻,频繁出现呕吐、消瘦,行远端胃大部分切除手术(毕Ⅱ术),术后未予激素应用,体质量逐渐增加。28例患者均无死亡。
2.9分组比较31例EG患者的外周血Eos绝对值计数中23例升高。对上述23例EG患者按性别、有无过敏史、临床分型及是否激素治疗进行分组,比较其治疗前后Eos水平。前三种分组比较,差异无统计学意义(P>0.05);激素组与非激素组比较,差异有统计学意义(P<0.05,见表2)。
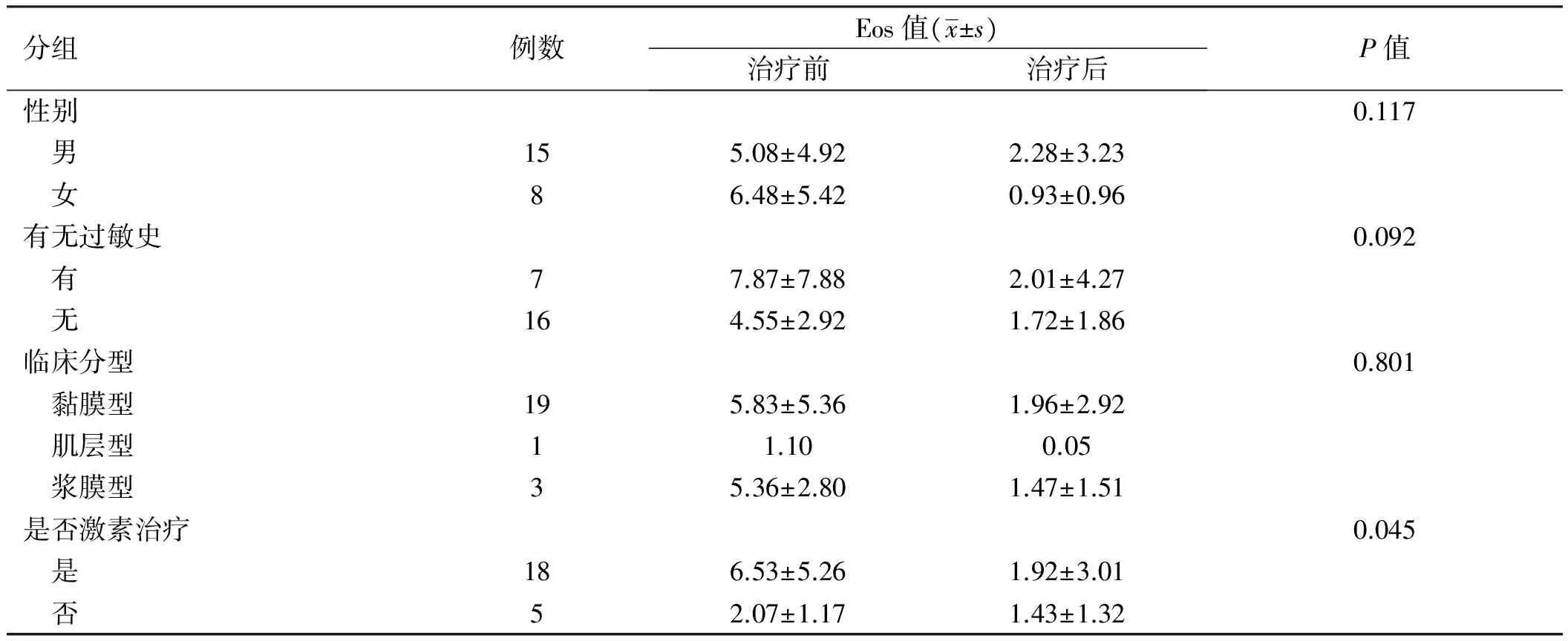
表2 外周血Eos升高的23例EG患者不同分组比较
3 讨论
3.1发病机制近年来,有关EG的临床报道逐渐增多,但发病机制仍未阐明。有文献[7]报道,50%~75%的EG患者伴随过敏疾病或过敏史,认为EG是由内源性或外源性过敏原引起的变态反应性疾病。本文中38.7%伴有过敏病史,与文献[7]报道不符,推测可能与样本量少、临床医师对过敏原检测不重视而漏检有关。本组中2例过敏性鼻炎发作时均出现胃肠道症状,1例患者过敏原检测提示,鸡蛋、西红柿、大豆过敏,发病前有进食鸡蛋、西红柿病史。本研究支持EG是一种过敏性疾病的观点。目前更多的学者认为,EG是Th1/Th2免疫失衡及Th2细胞释放的细胞因子所致的免疫反应性疾病,并提出卫生假设学说[8]。
3.2临床表现与辅助检查临床表现无特异性,多数患者以腹痛、恶心/呕吐、腹泻、腹胀为首要症状。本文31例EG患者以腹痛、恶心/呕吐最常见。根据临床分型标准,本文31例患者中有黏膜型、肌型和浆膜型,其中以黏膜型最多。外周血Eos升高和影像学异常表现可为EG的诊断提供重要依据。影像学多表现为腹腔积液、消化道管腔狭窄、管壁增厚及腹腔淋巴结肿大等。本文23例患者伴随外周血Eos升高,5例行腹腔穿刺,3例腹水中可见大量Eos,19例行腹部CT,8例表现为消化道管壁增厚且病理确诊为EG。但相关文献[9]报道,外周血Eos升高仅见于80%的患者,影像学表现异常也仅见于2/3的患者且无特异性。因此,临床医师对仅存在消化道症状的EG患者,排除急腹症和其他疾病后,应高度怀疑本病。
3.3内镜检查目前内镜检查趋于普遍,但EG的内镜下表现多样、无特异性。有文献[10]报道,仅50%的患者内镜下表现异常,且以胃和十二指肠的黏膜红斑多见。本文中31例EG患者以胃窦、十二指肠黏膜充血红斑最多见,而Eos检出部位以十二指肠和回肠最多,表明内镜与组织病理学表现不一致,内镜下表现正常,组织活检可见大量Eos异常浸润,反之内镜下表现异常而组织活检未见Eos异常浸润。因此,内镜下应多点活检,尤其内镜下表现正常而又高度怀疑本病时应在以上常见部位常规取活检,以免漏诊。生理状态下,胃肠道黏膜内的Eos数量不仅与种族、年龄及过敏原、感染原暴露有关,也随消化道的部位不同而不同。目前公认的EG诊断标准为Eos≥20个/HPF[8,11]。31例EG患者中H.pylori阳性者1例,H.pylori感染率明显低于一般人群,这与FURUTA等[12-13]报道一致,认为幼年若无感染细菌可导致Th1细胞的免疫反应不能激活,引起Th1和Th2细胞免疫反应失衡,而Th2细胞免疫反应与过敏反应有关。
3.4治疗本文中31例EG患者以不同组合形式接受剔除饮食、抗组胺和激素药物治疗。剔除饮食包括经验性剔除某些常见致敏原和根据过敏原检测结果避免接触已明确的过敏原[2,4]。本文中,1例根据过敏原检测结果避免食用鸡蛋、西红柿和大豆,30例根据经验避免接触海产品、牛奶、蛋类。8例给予扑尔敏或氯雷他定4~10 d症状明显缓解。因此,轻症患者可予抗组胺药物治疗,无效再加用激素治疗。激素是目前临床上最有效的治疗药物,可迅速缓解患者的临床症状,且复发患者再次给予激素治疗仍有效。泼尼松片和甲泼尼龙片是临床上最常用药物,常规剂量0.5~1.0 mg·kg-1·d-1,2~14 d症状明显缓解,随后逐渐减量,总疗程3~4个月[14]。本文中20例EG患者接受激素治疗,平均1周后症状明显缓解,总疗程为1~3个月。本文将外周血Eos升高的23例按是否激素治疗进行分组,接受激素治疗的患者治疗后Eos下降程度显著。该组患者随访过程中4例复发,其中1例再次予激素治疗2~3 d症状消失,1例因激素应用不当而诱发肺部真菌感染,并导致幽门梗阻而外科手术切除。表明泼尼松疗效显著,且对复发者仍然有效,但长期应用所致的严重并发症不容忽视。与泼尼松相比,布地奈德具有高代谢率,长期应用其不良反应发生率低。有文献[15]报道,予布地奈德9 mg/d控制症状,3~6 mg/d长期维持与泼尼松相比,疗效相当,但安全性更高。其他药物治疗包括酮替芬、白三烯受体抑制剂、色甘酸钠、Th2细胞因子拮抗剂、大环内酯类及粪便移植[14,16],仅见于个案报道,其实用性有待进一步证实。本文中1例伴H.pylori感染,同时给予激素和H.pylori根除治疗,随访至今未复发。相关文献[13]报道了1例EG患者伴H.pylori感染,仅接受H.pylori根除治疗便可治愈。少数出现肠梗阻或肠穿孔等并发症的患者经保守治疗无效需行外科手术治疗,术后需低剂量激素维持。
总之,EG是一种良性消化道疾病,发病机制与变态反应有关,其临床症状、实验室检查、影像学及内镜下表现均无特异性,确诊依靠组织病理学检查,泼尼松治疗疗效确切,但长期应用出现的严重不良反应不容忽视,临床中应重视这类疾病的鉴别诊断、治疗与随访。EG是一种变态反应性疾病,其临床表现及内镜下表现均无特异性,确诊依据组织或腹水病理学检查见大量Eos,予抗过敏或激素可明显缓解。
[1] ZHANG M, LI Y. Eosinophilic gastroenteritis: A state-of-the-art review [J]. Gastroenterol Hepatol, 2017, 32(1): 64-72. DOI: 10.1111/jgh.13463.
[2] 弋东敏, 陆小丹, 李健. 嗜酸性胃肠道疾病的研究进展[J]. 胃肠病学和肝病学杂志, 2016, 25(8): 941-944. DOI: 10.3969/j.issn.1006-5709.2016.08.029.
YI D M, LU X D, LI J. Research progress of eosinophilic gastrointestinal disease [J].Chin J Gastroenterol Hepatol, 2016, 25(8): 941-944. DOI: 10.3969/j.issn.1006-5709.2016.08.029.
[3] 王巍, 姜春燕. 嗜酸粒细胞性胃肠炎的临床表现及内镜特点[J]. 胃肠病学和肝病学杂志, 2015, 24(7): 810-814. DOI: 10.3969/j.issn.1006-5709.2015.07.013.
WANG W, JIANG C Y. The clinical and endoscopic features of eosinophilic gastroenteritis [J]. Chin J Gastroenterol Hepatol, 2015, 24(7): 810-814. DOI: 10.3969/j.issn.1006-5709.2015.07.013.
[4] ZHANG L, DUAN L, DING S, et al. Eosinophilic gastroenteritis: clinical manifestations and morphological characteristics, a retrospective study of 42 patients [J]. Scand J Gastroenterol, 2011, 46: 1074-1080. DOI: 10.3109/00365521.2011.579998.
[5] MEHTA P, FURUTA G T. Eosinophils in gastrointestinal disorders: eosinophilic gastrointestinal diseases, celiac disease, inflammatory bowel diseases, and parasitic infections [J]. Immunol Allergy Clin North Am, 2015, 35(3): 413-437. DOI: 10.1016/j.iac.2015.04.003.
[6] UPPAL V, KREIGER P, KUTSCH E. Eosinophilic gastroenteritis and colitis: a comprehensive review [J]. Clinic Rev Allerg Immunol, 2016, 50(2): 175-188. DOI: 10.1007/s12016-015-8489-4.
[7] BABU K S, POLOSA R, MORJARIA J B. Anti-IgE--emerging opportunities for Omalizumab [J]. Expert Opin Biol Ther, 2013, 13(5): 765-777. DOI: 10.1517/14712598.2013.782391.
[8] BISCHOFF S C, ULMER F A. Eosinophils and allergic diseases of the gastrointestinal tract [J]. Best Pract Res Clin Gastroenterol, 2008, 22(3): 455-479. DOI: 10.1016/j.bpg.2007.11.010.
[9] CHANG J Y, CHOUNG R S, LEE R M, et al. A shift in the clinical spectrum of eosinophilic gastroenteritis toward the mucosal disease type [J]. Clin Gastroenterol Hepatol, 2010, 8: 669-675. DOI: 10.1016/j.cgh.2010.04.022.
[10] REED C, WOOSLEY J T, DELLON E S. Clinical characteristics, treatment outcomes, and resource utilization in children and adults with eosinophilic gastroenteritis [J]. Dig Liver Dis, 2015, 47: 197-201. DOI: 10.1016/j.dld.2014.11.009.
[11] MATSUSHITA T, MARUYAMA R, ISHIKAWA N, et al. The number and distribution of eosinophils in the adult human gastrointestinal tract: a study and comparison of racial and comparison of racial and environmental factors [J]. Am J Surg Pathol, 2015, 39: 521-527. DOI: 10.1097/PAS.0000000000000370.
[12] FURUTA K, ADACHI K, AIMI M, et al. Case-control study of association of eosinophilic gastrointestinal disorders with Helicobacter pylori infection in Japan [J]. J Clin Biochem Nutr, 2013, 53(1): 60-62. DOI: 10.3164/jcbn.13-15.
[13] SOAVI C, CASELLI M, SIOULIS F, et al. Eosinophilic gastroenteritis cured with Helicobacter pylori eradication: case report and review of literature [J]. Helicobacter, 2014, 19(3): 237-238. DOI: 10.1111/hel.12122.
[14] GUPTA N, AGGARWAL A, GUPTAKE R, et al. The management of eosinophilic gastroenteritis [J]. Scand J Gastroenterol, 2015, 50(11): 1309-1314. DOI: 10.3109/00365521.2015.1049655.
[15] PINETON DE CHAMBRUN G, GONZALEZ F, CANVA J Y, et al. Natural history of eosinophilie gastroenteritis [J]. Clin Gastroenterol Hepatol, 2011, 9(11): 950-956. e1. DOI: 110.1016/j.cgh.2011.07.017.
[16] PRUSSIN C. Eosinophilic gastroenteritis and related eosinophilic disorders [J]. Gastroenterol Clin North Am, 2014, 43(2): 317-327. DOI: 10.1016/j.gtc.2014.02.013.

