组蛋白去乙酰化酶抑制剂ACY1215对急性肝衰竭小鼠肝脏炎症反应的影响
刘 扬,张海月,焦方舟,张文斌,陈 倩,龚作炯
武汉大学人民医院感染科,湖北 武汉 430060
急性肝衰竭(acute liver failure,ALF)是一种严重的临床综合征,炎症在肝衰竭发生、发展中具有重要作用[1]。血清降钙素原(procalcitonin,PCT)的升高与ALF的发生、发展密切相关[2]。高迁移率族蛋白B1(high mobility group box 1,HMGB1)作为一种重要的晚期炎症介质,在ALF的发生、发展中具有重要作用,且HMGB1与其他炎症因子相互作用,可进一步促进ALF中的炎症反应[3-4]。近年来部分研究发现,微小RNA(microRNA)可与HMGB1结合并调控其表达,但具体机制尚不明确。本实验室前期研究[5]发现,组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂曲古菌素A(Trichostatin A,TSA)可减轻慢加急性肝衰竭大鼠肝脏炎症损伤。本实验通过使用HDAC抑制剂ACY1215对ALF小鼠进行干预,观察其是否对ALF小鼠肝组织具有保护作用及其对ALF炎症反应的影响。
1 材料与方法
1.1动物模型的制备将体质量为20~25 g的雄性SPF级C57BL/6小鼠(购自湖北省动物实验中心)适应性喂养5 d后随机分为3组,即对照组、ALF模型组、ACY1215干预组,每组6只。除对照组外,其余两组小鼠腹腔注射D-氨基半乳糖(D-galactosamine,D-GalN,购自美国Sigma-Aldrich公司)400 mg/kg及脂多糖(lipopolysaccharide,LPS,购自美国Sigma-Aldrich公司)100 μg/kg制备ALF模型。在制备ALF模型前2 h给予ACY1215干预组小鼠腹腔注射ACY1215(购自美国Selleck公司)20 mg/kg,ALF模型组腹腔注射等量等渗生理盐水。干预24 h后摘除小鼠眼球采血,并取肝脏标本。
1.2肝组织HE染色取小鼠肝组织约0.3 cm×0.4 cm于质量浓度为40 g/L的多聚甲醛溶液中固定,行常规石蜡包埋,切片后行HE染色,光镜下观察肝组织结构。余肝组织置于冻存管中,-80 ℃冻存以备ELISA、Western blotting及Real-time PCR(RT-PCR)检测。
1.3血清肝功能检测采用生化法检测血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和总胆红素(TBIL)水平。
1.4ELISA法检测肝组织PCT的表达称取肝组织100 mg加入质量浓度为9 g/L的生理盐水900 μl冰上匀浆,离心后取上清按照ELISA检测试剂盒(购自武汉华美生物工程有限公司)说明书进行检测,建立标准曲线,通过加样、洗涤、显色、终止、检测的步骤测定各组在450 nm波长处的吸光度值,再通过标准曲线计算出各组对应的浓度值。
1.5Westernblotting法检测肝组织HMGB1的表达称取肝组织100 mg加入裂解液1 ml冰上匀浆,提取总蛋白,通过BCA法测定蛋白浓度。配制质量浓度为100 g/L的SDS-PAGE凝胶,每孔加样40 μg,电泳,转膜后用质量浓度为50 g/L的脱脂奶粉室温下摇床封闭2 h,洗膜,加入一抗(购自美国Cell Signaling Technology公司)4 ℃摇床孵育过夜,洗膜后加入IRDye800CW二抗(购自美国LI-COR公司)避光室温下摇床孵育2 h,洗膜,显色曝光。
1.6RT-PCR检测肝组织miR-141的表达称取肝组织100 mg加入Trizol 900 μl冰上匀浆,提取总RNA,再用1 μg RNA反转录成cDNA,通过RT-PCR扩增出目的基因。反应条件为:预变性95 ℃,10 min;95 ℃,15 s,60 ℃,60 s,40个循环;末段延伸60 ℃,5 min。miR-141-RT:5′-CTCAACTGGTGTCGTGGAGTCGGCAAT TCAGTTGAGCCATCT TT-3′;miR-141-S:5′-ACACTCCAGCTGGGTAACACTGTCTGGTAA-3′;miR-141-A:5′-TGGTGTCGTGGAGTCG-3′;U6-RT:5′-AACGCTTCACGAATTTGCGT-3′;U6-S:5′-CTCGCTTCGGCAGCACA-3′;U6-A:5′-AACGCTTCACGAATT TGCGT-3′。所有引物均由武汉赛维尔生物科技有限公司合成。
2 结果
2.1ACY1215对ALF小鼠肝组织病理学的影响HE染色结果显示,对照组小鼠肝组织结构清晰完整,肝板排列整齐,肝细胞形态正常,无变性和坏死,无炎性细胞浸润;ALF模型组小鼠肝组织结构紊乱,肝细胞坏死,可见炎性细胞浸润;ACY1215干预组小鼠肝组织细胞损伤程度较模型组明显减轻,炎性细胞浸润明显减少(见图1)。
2.2ACY1215对ALF小鼠肝功能的影响ALF模型组小鼠血清ALT、AST、TBIL水平较对照组明显升高(P<0.05);ACY1215干预组小鼠血清ALT、AST、TBIL水平较ALF模型组明显降低(P<0.05),但仍高于对照组(见表1)。
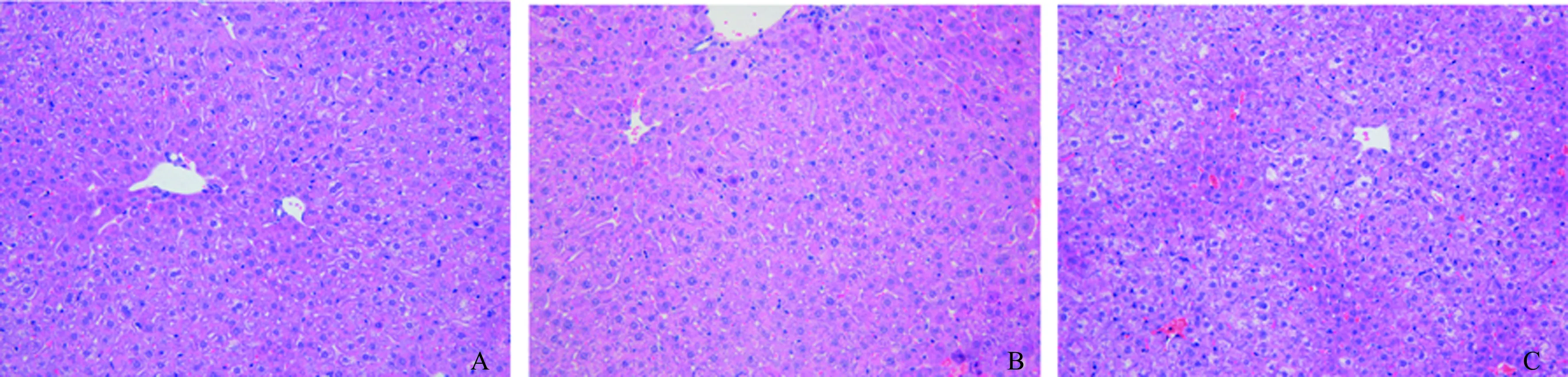
图1 小鼠肝组织切片HE染色(200×) A:对照组;B:ALF模型组;C:ACY1215干预组Fig 1 HE staining of liver tissue biopsy in mice (200×)A: control group; B: ALF model group; C: ACY1215 group
Tab 1 Comparison of liver function in mice among three groups (±s) U/L
注:与对照组相比,*P<0.05;与ALF模型组相比,#P<0.05。
2.3ACY1215对ALF小鼠肝组织炎症相关指标的影响与对照组相比,ALF模型组小鼠肝组织PCT、HMGB1水平明显升高(P<0.05),miR-141表达显著降低(P<0.05);ACY1215干预组小鼠肝组织PCT、HMGB1水平较ALF模型组显著降低(P<0.05),miR-141表达显著升高(P<0.05,见图2)。
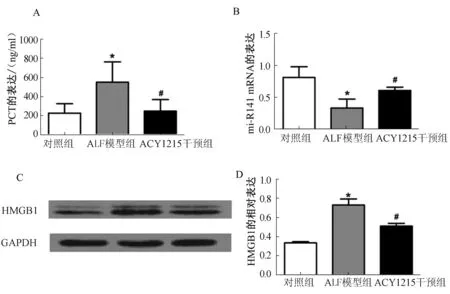
注:与对照组相比,*P<0.05;与ALF模型组相比,#P<0.05。
3 讨论
ALF是一种严重的、危及患者生命的临床综合征。目前,肝移植是ALF唯一有效的治疗措施,然而仍存在着肝源紧张、并发症多、费用较高等诸多问题[6]。目前认为,ALF肝损伤的机制主要分为两类,即直接损伤和免疫介导的肝损伤。研究[7]发现,肝脏和循环中的炎性因子在ALF中发挥重要作用,包括肝细胞坏死、肝外并发症和肝细胞再生。越来越多的证据表明,免疫介导的肝损伤在肝衰竭的发生、发展中起重要作用[8]。
乙酰化修饰是一种普遍存在的蛋白质翻译后修饰,是乙酰基供体通过酶学或非酶学的方式将乙酰基团共价结合到赖氨酸残基上的过程,参与转录、趋化作用、新陈代谢、细胞信号传导、应激反应、蛋白质水解、细胞凋亡及神经元发育等过程[9]。该过程主要由组蛋白乙酰基转移酶(histone acetyltransferase,HAT)和HDAC共同调控。目前关于HDAC抑制剂在抗炎作用方面的研究越来越多。VAN DEN BOSCH等[10]发现,HDAC抑制剂对肺部炎症性疾病的治疗具有重要作用。GAN等[11]在慢性阻塞性肺疾病的研究中发现,通过调控HDAC2的表达能抑制炎性因子水平。本实验室前期研究[5]也观察到,HDAC抑制剂TSA能降低慢加急性肝衰竭大鼠体内炎性因子TNF-α、IL-1β等的水平,但其具体的抗炎机制尚不明确。ACY1215是一种选择性HDAC6抑制剂,在肿瘤性疾病的治疗中具有重要作用[12-14]。本实验利用D-GalN联合LPS诱导ALF小鼠模型,并使用ACY1215进行干预发现,ALF模型组小鼠血清AST、ALT、TBIL水平显著升高,肝组织结构紊乱,肝细胞坏死,可见炎性细胞浸润;ACY1215干预组小鼠较ALF模型组血清AST、ALT、TBIL水平显著降低,肝组织细胞损伤程度明显减轻,炎性细胞浸润明显减少。提示HDAC抑制剂ACY1215对ALF小鼠肝功能具有保护作用,可能与其能减轻肝组织炎症反应有关。
病理状态下肝脏等组织能产生较高的PCT[15-16]。相关研究[17]表明,PCT是一项与感染密切相关的炎症指标,并可能作为一种炎性因子参与炎症的病理生理学过程。SUGIHARA等[18]研究发现,ALF患者体内PCT水平明显升高。我们前期的研究[2]也证实,ALF大鼠肝组织PCT表达明显升高。本实验采用ELISA法对小鼠肝组织PCT水平检测发现,与对照组相比,ALF模型组小鼠肝组织PCT水平明显升高,与前期研究结果一致,ACY1215干预组小鼠肝组织PCT水平较ALF模型组显著降低,提示HDAC抑制剂可能减轻ALF小鼠肝组织炎症反应程度,对肝组织及肝功能具有保护作用。
HMGB1作为一种晚期促炎因子,可与晚期糖基化终产物受体、Toll样受体、T细胞免疫球蛋白黏蛋白3受体等细胞表面受体结合,激活免疫系统,诱发组织炎性因子释放及炎性细胞浸润,使组织持续处于炎性损伤状态[19-23]。研究[23-25]发现,HMGB1释放到细胞外的过程受乙酰化调控的影响。我们前期研究[5]发现,ALF大鼠肝组织HMGB1水平明显升高,且TSA可显著降低肝组织HMGB1水平,减轻肝组织炎症反应。本实验采用Western blotting法对小鼠肝组织HMGB1水平进行检测发现,ALF小鼠肝组织HMGB1水平较对照组明显升高,HDAC抑制剂ACY1215干预的ALF小鼠肝组织HMGB1水平明显下降,提示ACY1215可调控小鼠肝组织HMGB1的表达及释放,其机制可能与ACY1215能调控HMGB1的乙酰化修饰有关。
有研究[26]提示,微小RNA作为一种内源性非编码RNA分子,可参与调控多种致炎基因表达,从而影响炎性细胞增殖、分化及炎症因子的产生和释放等,参与脓毒症的发病过程。DING等[27]研究发现,LPS诱导的内毒素大鼠心肌细胞miR-141表达明显下降。ZHANG等[28]通过生物信息学软件发现,miR-141可能与HMGB1 mRNA序列中的3’UTR非编码区结合,并通过实验证实miR-141能调控单核细胞HMGB1的表达水平,从而在调控炎症反应过程中发挥重要作用。因此,本实验采用RT-PCR法对小鼠肝组织miR-141水平进行检测发现,ALF小鼠肝组织miR-141表达下降,HDAC抑制剂ACY1215干预的ALF小鼠肝组织miR-141表达升高,提示miR-141的表达水平受乙酰化调控的影响,可能与HMGB1的表达有关,但具体机制仍需进一步研究。
综上所述,D-GalN联合LPS可诱导小鼠ALF的发生,导致小鼠肝功能明显下降,肝组织炎症反应加重。ACY1215对ALF小鼠肝组织具有保护作用,可能与其能减轻肝组织炎症反应程度有关。
[1] BERNSMEIER C, ANTONIADES C G, WENDON J. What’s new in acute liver failure? [J]. Intensive Care Med, 2014, 40(10): 1545-1548. DOI: 10.1007/s00134-014-3350-4.
[2] 徐虹, 李汛, 王鲁文, 等. 急性肝衰竭大鼠血清与组织中降钙素原的检测及意义[J]. 中西医结合肝病杂志, 2012, 22(5): 296-305. DOI: 10.3969/j.issn.1005-0264.2012.05.014.
XU H, LI X, WANG L W, et al. Detection and significance of procalcitonin in serum and tissue of rats with acute liver failure [J]. Chinese Journal of Integrated Traditonal and Western Medicine on Liver Diseases, 2012, 22(5): 296-305. DOI: 10.3969/j.issn.1005-0264.2012.05.014.
[3] 王福财, 谢勇. HMGB1在消化系疾病炎症性损伤与修复中的作用[J]. 生物医学工程学杂志, 2015, 32(4): 919-923. DOI: 10.7507/1001-5515.20150164.
WANG F C, XIE Y. Role of HMGB1 in inflammatory-mediated injury caused by digestive system diseases and its repair [J]. Journal of Biomedical Engineering, 2015, 32(4): 919-923. DOI: 10.7507/1001-5515.20150164.
[4] 张宇, 王刚, 祝文彩, 等. 急性肝衰竭大鼠高迁移率族蛋白B1的变化和意义[J]. 世界华人消化杂志, 2015, 23(9): 1402-1410. DOI: 10.11569/wcjd.v23.i9.1402.
ZHANG Y, WANG G, ZHU W C, et al. Changes in expression of high mobility group protein B1 in acute liver failure in rats [J]. World Chinese Journal of Digestology, 2015, 23(9): 1402-1410. DOI: 10.11569/wcjd.v23.i9.1402.
[5] ZHANG Q, YANG F, LI X, et al. Trichostatin A protects against intestinal injury in rats with acute liver failure [J]. J Surg Res, 2016, 205(1): 1-10. DOI: 10.1016/j.jss.2016.05.028.
[6] DONNELLY M C, HAYES P C, SIMPSON K J. Role of inflammation and infection in the pathogenesis of human acute liver failure: clinical implications for monitoring and therapy [J]. World J Gastroenterol, 2016, 22(26): 5958-5970. DOI: 10.3748/wjg.v22.i26.5958.
[7] WU Z, HAN M, CHEN T, et al. Acute liver failure: mechanisms of immune-mediated liver injury [J]. Liver Int, 2010, 30(6): 782-794. DOI: 10.1111/j.1478-3231.2010.02262.x.
[8] 王晓晶, 张小平, 宁琴. 肝衰竭的免疫发病机制[J]. 临床肝胆病杂志, 2014, 30(10): 984-991. DOI: 10.3969/j.issn.1001-5256.2014.10.004.
WANG X J, ZHANG X P, NING Q. Immune-mediated liver failure [J]. J Clin Hepatol, 2014, 30(10): 984-991. DOI: 10.3969/j.issn.1001-5256.2014.10.004.
[9] 吕斌娜, 梁文星. 蛋白质乙酰化修饰研究进展[J]. 生物技术通报, 2015, 31(4): 166-174. DOI: 10.13560/j.cnki.biotech.bull.1985.2015.03.003.
LV B N, LIANG W X. The research progress of protein acetylation [J]. Biotechnology Bulletin, 2015, 31(4): 166-174. DOI: 10.13560/j.cnki.biotech.bull.1985.2015.03.003.
[10] VAN DEN BOSCH T, LEUS N G, WAPENAAR H, et al. A 6-alkylsalicylate histone acetyltransferase inhibitor inhibits histone acetylation and pro-inflammatory gene expression in murine precision-cut lung slices [J]. Pulm Pharmacol Ther, 2017, 44: 88-95. DOI: 10.1016/j.pupt.2017.03.006.
[11] GAN L, LI C, WANG J, et al. Curcumin modulates the effect of histone modification on the expression of chemokines by type Ⅱ alveolar epithelial cells in a rat COPD model [J]. Int J Chron Obstruct Pulmon Dis, 2016, 11: 2765-2773. DOI: 10.2147/COPD.S113978.
[12] PUTCHA P, YU J, RODRIGUEZ-BARRUECO R, et al. HDAC6 activity is a non-oncogene addiction hub for inflammatory breast cancers [J]. Breast Cancer Res, 2015, 17(1): 149. DOI: 10.1186/s13058-015-0658-0.
[13] DASMAHAPATRA G, PATEL H, FRIEDBERG J, et al. In vitro and in vivo interactions between the HDAC6 inhibitor ricolinostat (ACY1215) and the irreversible proteasome inhibitor carfilzomib in non-Hodgkin lymphoma cells [J]. Mol Cancer Ther, 2014, 13(12): 2886-2897. DOI: 10.1158/1535-7163.
[14] HIDESHIMA T, COTTINI F, OHGUCHI H, et al. Rational combination treatment with histone deacetylase inhibitors and immunomodulatory drugs in multiple myeloma [J]. Blood Cancer J, 2015, 5: e312. DOI: 10.1038/bcj.2015.38.
[15] QU J, FENG P, LUO Y, et al. Impact of hepatic function on serum procalcitonin for the diagnosis of bacterial infections in patients with chronic liver disease: a retrospective analysis of 324 cases [J]. Medicine (Baltimore), 2016, 95(30): e4270. DOI: 10.1097/MD.0000000000004270.
[16] GIULIA B, LUISA A, CONCETTA S, et al. Procalcitonin and community-acquired pneumonia (CAP) in children [J]. Clin Chim Acta, 2015, 451(Pt B): 215-218. DOI: 10.1016/j.cca.2015.09.031.
[17] 傅叁君, 高国生, 胡爱荣, 等. 血清降钙素原和常用炎症指标联合CTP评分对慢加急性肝衰竭短期预后的预测价值[J]. 中国实用内科杂志, 2015, 35(6): 519-521. DOI: 10.7504/nk2015050403.
FU S J, GAO G S, HU A R, et al. Short-term prognostic value of serum procalcitonin and common inflammation markers combined with CTP score in patients with acute-on-chronic liver failure [J]. Chinese Journal of Practical Internal Medicine, 2015, 35(6): 519-521. DOI: 10.7504/nk2015050403.
[18] SUGIHARA T, KODA M, OKAMOTO T, et al. Serum procalcitonin in patients with acute liver failure [J]. Yonago Acta Med, 2017, 60(1): 40-46.doi:10.3969/j.issn.1006-5709.2018.02.015
[19] WANG X, XIANG L, LI H, et al. The role of HMGB1 signaling pathway in the development and progression of hepatocellular carcinoma: a review [J]. Int J Mol Sci, 2015, 16(9): 22527-22540. DOI: 10.3390/ijms160922527.
[20] LOHANI N, RAJESWARI M R. Dichotomous life of DNA binding high mobility group box1 protein in human health and disease [J]. Curr Protein Pept Sci, 2016, 17(8): 762-775. DOI: 10.2174/1389203717666160226145217.
[21] LEE S A, KWAK M S, KIM S, et al. The role of high mobility group box 1 in innate immunity [J]. Yonsei Med J, 2014, 55(5): 1165-1176. DOI: 10.3349/ymj.2014.55.5.1165.
[22] WEBER D J, ALLETTE Y M, WILKES D S, et al. The HMGB1-RAGE inflammatory pathway: implications for brain injury-induced pulmonary dysfunction [J]. Antioxid Redox Signal, 2015, 23(17): 1316-1328. DOI: 10.1089/ars.2015.6299.
[23] VENEREAU E, DE LEO F, MEZZAPELLE R, et al. HMGB1 as biomarker and drug target [J]. Pharmacol Res, 2016, 111: 534-544. DOI: 10.1016/j.phrs.2016.06.031.
[24] YANG Z, LI L, CHEN L, et al. PARP-1 mediates LPS-induced HMGB1 release by macrophages through regulation of HMGB1 acetylation [J]. J Immunol, 2014, 193(12): 6114-6123. DOI: 10.4049/jimmunol.1400359.
[25] KIM Y M, PARK E J, KIM J H, et al. Ethyl pyruvate inhibits the acetylation and release of HMGB1 via effects on SIRT1/STAT signaling in LPS-activated RAW264.7 cells and peritoneal macrophages [J]. Int Immunopharmacol, 2016, 41: 98-105. DOI: 10.1016/j.intimp.2016.11.002.
[26] KINGSLEY S M, BHAT B V. Role of microRNAs in sepsis [J]. Inflamm Res, 2017, 66(7): 553-569. DOI: 10.1007/s00011-017-1031-9.
[27] DING T, LI Y, TANG R, et al. Differential expression of miRNAs in myocardial tissues of rats with lipopolysaccharide-induced endotoxemia [J]. Nan Fang Yi Ke Da Xue Xue Bao, 2015, 35(2): 213-217. DOI: 10.3969/j.issn.1673-4254.2015.02.11.
[28] ZHANG Z H, CHEN X H, JIANG Z X, et al. Role of microRNA-141 in the regulation of synthesis of high mobility group protein B1 in THP-1 cells [J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2013, 25(10): 604-607. DOI: 10.3760/cma.j.issn.2095-4352.2013.10.007.

