钛铁矿制四氧化三铁/二氧化钛及其光催化性能*
黄智淼,林 君,张 洋,高郑开,单洁云
(杭州电子科技大学,浙江杭州310000)
20世纪70年代初,日本科学家Fuishima首次发现TiO2具有光催化性能[1],从此推动了光催化技术的发展。光催化反应通常使用的TiO2是以分散相悬浮在溶液中,均匀分散在溶液中的TiO2有较大的表面积,能充分吸收光子能量,光催化活性很高,但是粉末状TiO2存在易失活、易凝聚和难回收问题[2-5],所以制备可回收再利用的光催化剂受到人们的广泛关注。Fe3O4是一种磁性材料,把TiO2与Fe3O4复合制成磁性复合材料,用外加永久磁铁将其从废水中吸附出来,使之与母液分离,就可以很好地解决TiO2光催化材料回收难的问题。近年来,在合成磁性复合光催化剂方面已经取得了一定的进展[6]。李显伟[7]用水热法和还原一步法合成了还原氧化石墨烯(RGO)/Fe3O4/TiO2复合光催化剂;李加辉[8]用共沉淀法和溶胶-凝胶法合成了Fe3O4/TiO2/EG(乙二醇)磁性可漂浮光催化剂。但是发展简单的特别是绿色的合成方法合成高效的可回收的可见光催化剂仍然是摆在人们面前的一个难题[9]。工业上生产TiO2的方法主要有硫酸法和氯化法。硫酸法使用钛铁矿为原料,此方法生产工艺成熟、操作简单、设备相对简单,目前中国95%以上的企业采用硫酸法制备TiO2,既可生产金红石型 TiO2,又可生产锐钛型 TiO2[6]。 钛铁矿资源储量大、分布广,几乎遍布全球,但在传统的工业制备流程中,由于铁没有被充分利用往往造成资源的浪费[10]。
笔者以廉价且资源丰富的钛铁矿为原料,通过一系列实验制得Fe3O4/TiO2复合物异质杂化催化剂,充分利用了钛铁矿中的钛和铁[10]。同时研究了Fe3O4/TiO2复合物在光催化氧化降解有机污染物罗丹明B中的应用,并探索了催化剂的分离、回收方法及其循环应用的催化稳定性,寻求既能高效降解水污染物中的有机物,又便于回收的光催化剂。
1 实验部分
1.1 实验原理
钛铁矿由许多矿物成分组成,因此它与硫酸的反应是复杂的多相反应过程。主要反应方程式:

制备Fe3O4/TiO2复合物采用液相沉积法,在TiO2颗粒表面包覆Fe3O4,得到Fe3O4/TiO2复合物。Fe3O4由FeSO4·7H2O晶体制备而成。
1.2 实验原料
无水乙醇、氨水、还原铁粉、浓硝酸、聚乙二醇(PEG-6000)、浓硫酸、罗丹明 B、硅油、盐酸均为分析纯;水为去离子水;钛铁矿为攀枝花钢铁有限责任公司钛业分公司提供,主要化学成分见表1。

表1 钛铁矿主要化学成分
1.3 钛铁矿制取Fe3O4/TiO2复合物
1.3.1 制取 FeSO4·7H2O 和 TiO2
称取20g钛铁矿加入三口烧瓶中,初始预热温度为160℃,反应时间为120 min。缓慢加入13.5 mol/L硫酸,开启磁力搅拌器反应1 h。加入50 mL温度为90℃的稀硫酸反应50 min。加入0.5 g铁粉反应15 min。停止加热,冷却至常温,抽滤得滤液。将滤液置于6℃的冰箱中结晶两天,抽滤得到FeSO4·7H2O晶体,密封保存。滤液主要为TiOSO4,并有少量Fe3+。收集滤液,加入三口烧瓶中,控制TiO2+浓度为0.15 mol/L。加入7 g/L PEG-6000溶液,升温至90℃反应3 h,陈化21 h。抽滤,用去离子水和无水乙醇各洗涤3次,在80℃烘干1 h,得到偏钛酸。放入马弗炉中在 600 ℃煅烧 4 h,得到 TiO2粉末[11-12]。
1.3.2 制备Fe3O4/TiO2复合物
取一定量FeSO4·7H2O晶体,分为两份,质量比为1∶2,分别配成溶液1和溶液2。在溶液2中加入足量硝酸,使Fe2+氧化为Fe3+。将两份溶液混合加入三口烧瓶中,加入一定量TiO2粉末。开启磁力搅拌器并设置温度为80℃,反应1 h。取30 mL稀氨水,逐滴加入三口烧瓶中,控制pH大于9。反应结束后将溶液倒入烧杯中,在烧杯底部放置强磁铁,静置25 min,倒去上清液,重复操作2~3次。将沉淀物放入50℃电热鼓风干燥箱中烘干,充分研磨,得到复合物 A,FeSO4·7H2O 和 TiO2质量比为 1∶3。 调整FeSO4·7H2O 和 TiO2质量比为 1∶10,得到复合物 B。
1.3.3 XRD和FT-IR表征
用X′Pert Pro型X射线衍射仪对复合物A、TiO2、Fe3O4样品的物相进行表征。用Nicolet IS 50型傅里叶红外光谱仪对复合物A、TiO2、Fe3O4样品的分子结构进行表征。
1.4 光催化实验
1.4.1 催化剂光催化实验
称取140 mg催化剂,加入50 mL浓度为1×10-5mol/L的罗丹明B溶液中,用超声波清洗器超声分散。先暗置30 min,使染料在光催化剂粉末的表面达到吸附-脱附平衡[13]。 再用高压汞灯(150 W)和CHF-XM-500W短弧氙灯分别照射,并开启磁力搅拌器,分时取样测定染料的浓度。
1.4.2 催化剂重复使用实验
以复合物B为光催化剂,以浓度为1.5×10-5mol/L的罗丹明B为污染源,以短弧氙灯为光源进行光催化重复实验,实验步骤同1.4.1节。催化实验结束后,借助外加磁场使含催化剂的废液静置一段时间,倒去上清液,洗涤、烘干后称其质量。每组实验催化40 min后取样分析。催化剂回收率(η)计算:η=(m0-m1)/m0×100%。 式中:m0为实验前催化剂质量;m1为实验后催化剂质量。
1.4.3 罗丹明B浓度检测
用TU-1901型紫外可见分光光度计测定罗丹明B浓度,测定波长取罗丹明B在可见光区最大吸收波长554 nm。在低浓度范围内吸光度A与浓度c之间有很好的线性关系,遵守朗伯-比耳定律[2]。A与c满足下列公式:A=lg(1/T)=Kbc。式中:T 为透射比;K为摩尔吸收系数;b为吸收层厚度。以降解率(Y)来衡量染料降解程度,通过测定不同时刻吸光度A 即 可 计 算 出 降 解 率 Y=(c0-ct)/c0=(A0-At)/A0×100%。式中:A0为光照前吸光度;At为光照t时刻吸光度。
2 结果讨论与分析
2.1 磁性能测试
将少量复合物B加入去离子水中,溶液澄清之后用磁铁沿侧壁进行磁性能测试[14],结果见图1。图1表明,复合物B具有良好的磁性能,可在光催化实验结束后用磁铁分离回收再利用。

图1 Fe3O4/TiO2复合物磁性能测试
2.2 XRD分析
图2a、b、c 分别为 Fe3O4、TiO2、复合物 A 的 XRD谱图。 由图2a看出,Fe3O4样品在 2θ为 30.3、35.5、43.2、48.1、53.8、57.1、62.8 °有较为明显的衍射峰,分别对应 Fe3O4(JCPDS 75-1609)标准物质(220)(311)(400)(331)(422)(511)(440)晶面,而且衍射峰强度较强,说明该样品为尖晶石结构的Fe3O4。由图2b看出,TiO2样品在 2θ为 25.4、37.8、48.1、54.2、62.7、69.1°有较为明显的衍射峰,分别对应锐钛型TiO2(JCPDS 84-1286) 标准物质 (101)(004)(200)(211)(204)(116)晶面,为体心立方结构,属于锐钛矿晶型。由图2c看出,复合物 A 样品在 2θ为 25.4、37.8、48.1、54.2、62.7、69.1°有较为明显的衍射峰,分别对应锐钛型TiO2的(101)(004)(200)(211)(204)(116)晶面,可以判断 TiO2是锐钛矿型; 在 2θ为 30.3、35.5、43.2、48.1、53.8、57.1、62.8 °的衍 射峰 明显 减弱, 说明Fe3O4衍射峰已被TiO2衍射峰消弱或掩盖,进一步证明复合物 A 为 Fe3O4/TiO2磁性复合物[6,15]。
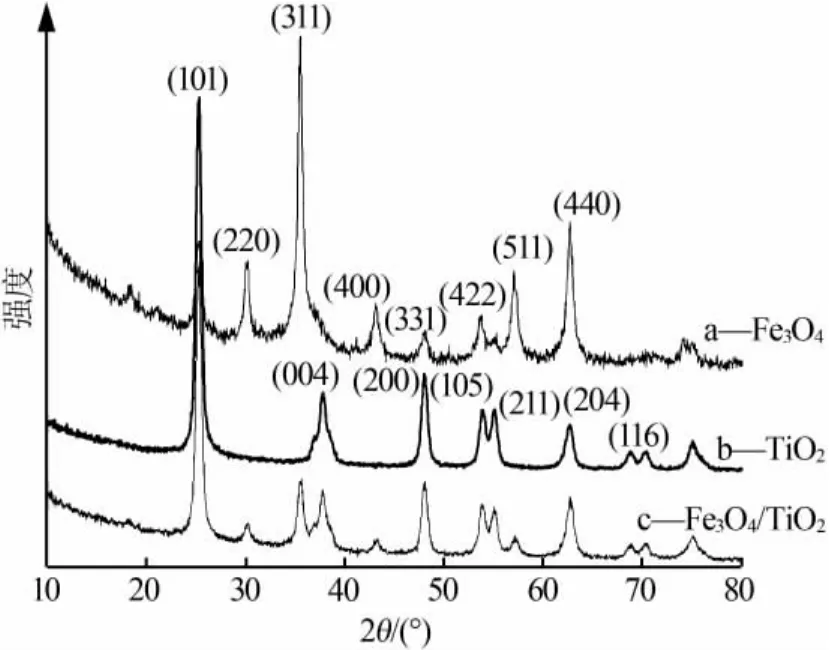
图2 Fe3O4、TiO2、Fe3O4/TiO2复合物 XRD 谱图
2.3 FT-IR 分析
图3 为 Fe3O4、TiO2、复合物 A 的 FT-IR 图。400~700 cm-1是Ti—O伸缩振动区域,从图3看出Ti—O伸缩振动区域并不明显且区域较宽,没有看到比较明显的特征峰。量子尺寸效应认为,小尺寸颗粒会使得红外吸收带的精细结构消失,引起谱带宽化,当TiO2颗粒达到纳米级时,会使得Ti—O伸缩振动区域宽化且精细结构消失[16]。此外,从图3看到,样品中含有一些杂质,3 230~3 400 cm-1强而宽的峰归属层间水分子H—O—H伸缩振动,与中波段1 638.1、1 636.1、1 607.6 cm-1处水分子H—O—H的弯曲振动对应[17];2 361 cm-1和 2 355 cm-1处的峰是样品池中CO2干扰所致。
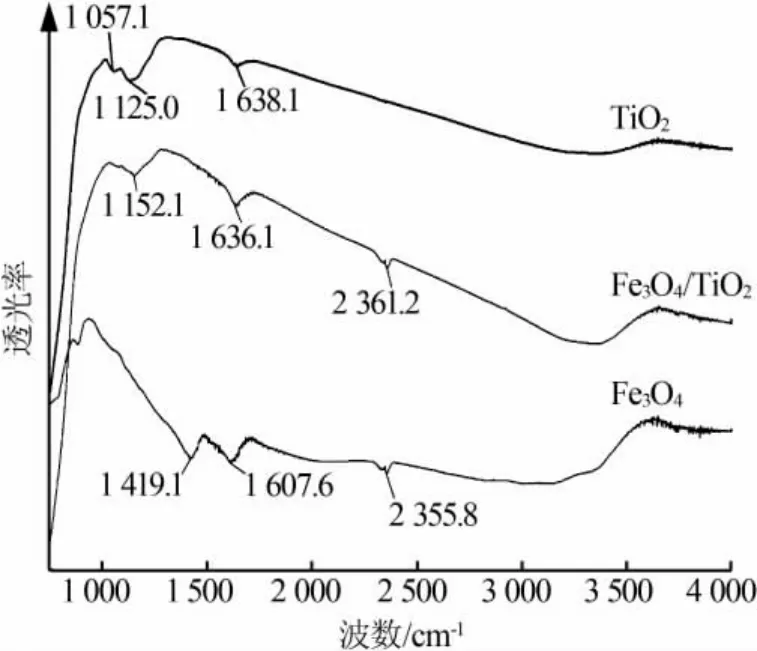
图3 Fe3O4、TiO2、Fe3O4/TiO2 复合物 FT-IR 图
2.4 光催化性能
2.4.1 紫外光下复合物A、TiO2、复合物B对罗丹明B的光催化效果
图4为紫外光下复合物A、TiO2、复合物B对罗丹明B的光催化效果。由图4看出,在紫外光下,TiO2光催化罗丹明B的降解率达到96.2%,复合物B光催化罗丹明B的降解率达到83.6%,复合物A光催化罗丹明B的降解率达到29.3%。TiO2的光催化效果最好,其次是复合物B,复合物A的效果最差。
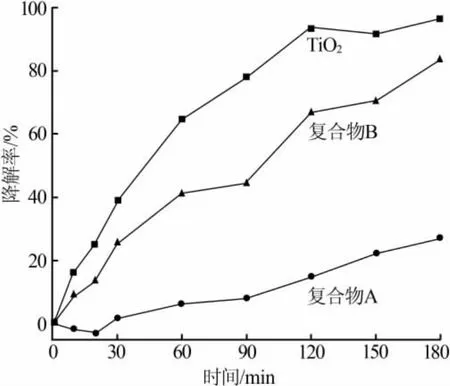
图4 紫外光下复合物A、TiO2、复合物B对罗丹明B的光催化效果
实验结果表明,Fe3O4含量越高光催化效果越差。可能的原因是,当Fe3O4与TiO2直接接触时形成异质结。磁性Fe3O4的带隙能仅为0.1 eV,TiO2的带隙能为3.2 eV。基于这样的结构,光生电子更容易转移到较低能级的Fe3O4导带上。这样,Fe3O4成为光生电子-空穴的复合中心,从而光催化活性降低[18]。陈金媛等[19]在研究Fe3O4/TiO2光催化复合材料中,总结了 TiO2与 Fe3O4物质的量比在(20~30)∶1 时光催化性能最好,该实验结果与文献报道一致。在后续实验中均以复合物B进行光催化实验。
2.4.2 不同光源下复合物B对罗丹明B的光催化效果
采用高压汞灯辐射较强的365.0 nm长波紫外线[20],以此作为模拟紫外光源;短弧氙灯在可见光波段与太阳光有较好的匹配,且紫外光波段的能量很弱,以此作为模拟太阳光源[21],实验使用氙灯功率为350 W。不同光源下复合物B对罗丹明B的光催化效果见图5。在紫外光实验中,复合物B光催化降解罗丹明B的降解率达到83.6%;在太阳光实验中,复合物B光催化降解罗丹明B的降解率达到97.7%。同时,从图5可以明显看出,太阳光条件下光催化速率更快,光催化40 min罗丹明B的降解率趋于稳定,且降解率更高。
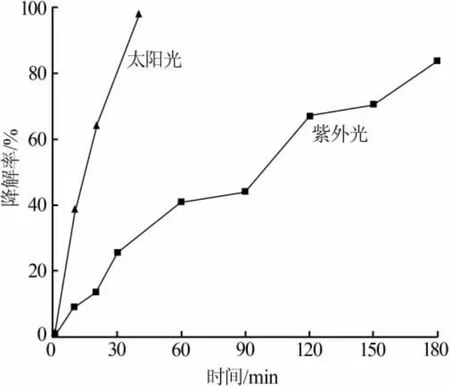
图5 不同光源下复合物B对罗丹明B的光催化效果
以TiO2为代表的一系列半导体光催化剂一般具有较大的禁带宽度(如锐钛矿TiO2禁带宽度Eg=3.2 eV),仅在紫外光范围内有响应,而波长在400 nm以下的紫外光不足太阳光总能量的5%,占太阳光总能量43%的可见光主要集中在400~700 nm波段。磁性Fe3O4的引入,使复合催化剂Fe3O4/TiO2的光吸收带发生了较大幅度的红移,并进入可见光区,吸收光强度也明显增大[22]。实验结果表明,实验制备的磁性光催化剂在太阳光作用下具有良好的光催化活性,且催化效果明显高于紫外光,在实际生产生活中将具有更广阔的应用前景与更高的应用价值。
2.5 催化剂回收和循环利用
图6为复合物B循环使用对罗丹明B的降解效率及其回收率。复合物B经过4次循环使用,每次回收率都在90%以上,说明催化剂结构稳定,具有易于回收、可重复使用的特点。随着循环使用次数的增加,光催化剂催化活性降低,这可能是由于催化剂新鲜表面在不断循环使用后被部分染料吸附污染,导致其初始吸附活性降低[23],使得光催化活性下降。复合催化剂循环使用4次之后仍然保持75%以上的降解率,说明该复合催化剂有较好的光催化性能与稳定的结构,具有良好的应用前景。
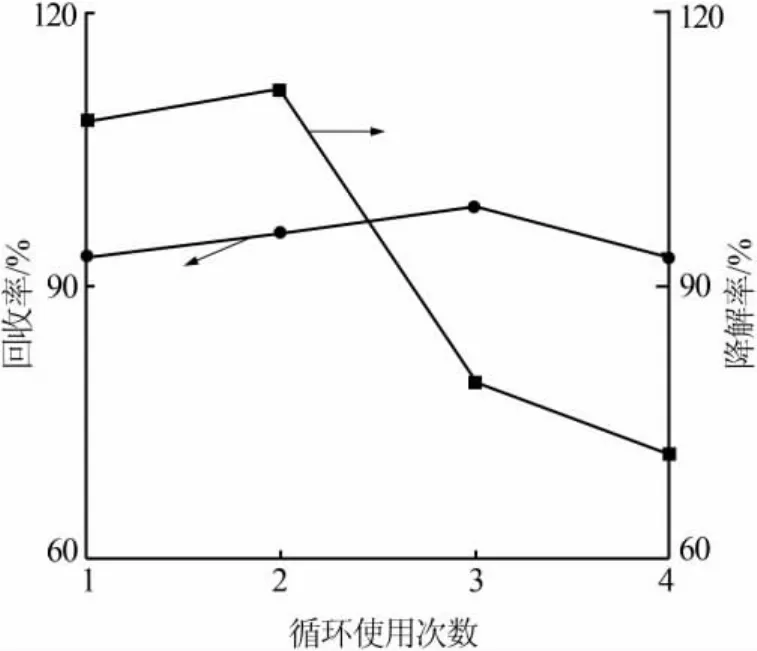
图6 复合物B循环使用对罗丹明B的降解效率及其回收率
3 结论与展望
3.1 结论
1)以钛铁矿为原料采用硫酸法制备二氧化钛,经XRD与FT-IR分析表明,TiO2为锐钛矿型。利用钛铁矿中的铁制得Fe3O4,实现了钛铁矿的充分利用。2)采用液相沉积法在TiO2颗粒表面包覆Fe3O4,制备Fe3O4/TiO2磁性光催化剂。Fe3O4所占比例会对复合物的光催化性能构成影响,所占比例越高复合物的光催化效果越差。3)实验制得的复合磁性催化剂具有良好的光催化性能,在太阳光下对罗丹明B的降解率达到97.7%;在紫外光下对罗丹明B的降解率达到83.6%。4)Fe3O4的引入使催化剂具有较强的磁性,通过外加磁场可将其分离回收,同时对TiO2本身的光催化性能没有造成影响。经过4次循环使用,复合催化剂仍可保持75%以上的光催化活性和90%以上的回收率。
3.2 展望
利用硫酸法制备二氧化钛,虽然能够有效地溶出钛铁矿中的TiO2+,但会产生较多的废液,需要在后续的操作中进一步处理,不仅增加了实验的工作量,而且浪费资源。建议进一步开展以下研究工作:1)对钛铁矿提取钛液方案进行优化,在提高TiO2+析出率的同时,对反应过程中的废渣进行再利用,实现真正的绿色合成;2)对TiO2磁性复合物的制备进行考察,通过掺杂不同的物质拟制备出既有良好的光催化效果又有良好的磁性能的复合物。随着材料学、电磁学、催化科学等的进一步发展,磁性催化剂的基础研究和应用研究必将迎来一个新的发展阶段,从而适合工程放大生产和应用[14]。
[1]Fujishima A.TiO2photocatalysis and related surface phenomena[J].Surface Science Reports,2008,63(12):515-582.
[2]包淑娟,张校刚,刘献明,等.TiO2/SiO2/Fe3O4的制备及其光催化性能[J].应用化学,2004,21(3):261-265.
[3]张哲,陈爱平,马磊,等.CNTs/TiO2多孔复合膜的组装及光催化性能[J].高等学校化学学报,2013,34(3):656-661.
[4]于秀娟,李显伟,万家峰,等.Fe3O4@TiO2-膨胀石墨的制备及其光催化性能研究[J].工业水处理,2014,34(3):68-70.
[5]王雪姣,任学昌,念娟妮,等.TiO2/PS/Fe3O4光催化剂的低温制备及其光催化和磁回收性能[J].环境科学,2012,33(8):2752-2758.
[6]宋海南,李国喜,周建庆,等.Fe3O4/TiO2磁性催化剂的制备及在污水治理中的应用[J].分子催化,2011,25(6):557-562.
[7]李显伟.Fe3O4/TiO2/EG磁性可漂浮光催化剂制备及降解苯酚的研究[D].哈尔滨:黑龙江大学,2013.
[8]李加辉.功能化TiO2纳米复合材料的制备及其光催化性能研究[D].天津:天津工业大学,2015.
[9]王震.钛制取工艺研究进展[J].稀有金属,2014,38(5):915-927.
[10]王昌松,姚文俊,陆小华.钛铁矿资源综合利用概述[J].无机盐工业,2014,46(1):4-7.
[11]王振翠.二氧化钛纳米材料的制备及其对农药乐果的光催化性能研究[D].北京:北京化工大学,2015.
[12]马春蕾.钛铁矿溶剂萃取法制备二氧化钛的新工艺研究[D].天津:天津大学,2014.
[13]兰明轩,洪天杰,卢治宇,等.钛铁矿制备Fe3O4/TiO2及光催化降解罗丹明 B[J].绍兴文理学院学报,2016,36(9):63-67.
[14]辛铁军,张和鹏,马明亮,等.Fe3O4@TiO2核壳磁性纳米材料的制备及表征[J].功能材料,2014,45(1):1072-1077.
[15]郭小华.Fe3O4@TiO2光催化剂的制备及其性能研究[J].化学研究与应用,2015,27(10):1559-1563.
[16]苏文悦,傅贤智,魏可镁,等.TiO2光催化剂的光谱研究[J].光谱学与光谱分析,2001,21(1):32-34.
[17]滕娜,杭玉蓉,张芝专,等.Fe3O4/TiO2的制备及太阳光催化性能研究[J].山东化工,2016,45(3):10-12,14.
[18]韩梅.(Ag@AgCl)-Fe3O4/RGO磁性复合材料的制备及光催化性能研究[D].南京:南京理工大学,2013.
[19]陈金媛,高鹏飞.磁性纳米TiO2/Fe3O4复合材料的制备及光催化降解性能[J].浙江工业大学学报,2005,33(1):78-82.
[20]陈大华.高压汞灯原理特性和应用[J].灯与照明,2002,26(5):13-15.
[21]陈文志,张然,钟楚巍,等.连续氙灯发光光谱的设计与应用研究[J].发光学报,2013,34(12):1651-1656.
[22]梁翠芬.磁性纳米 Fe3O4与 Fe3O4/TiO2复合材料的制备[J].华南师范大学学报:自然科学版,2010(2):63-66.
[23]喻黎明.低温合成TiO2/Fe3O4磁载光催化剂的光催化性能研究[J].北京化工大学学报:自然科学版,2011,38(2):63-68.

