原料配比对合成一氧化锰/碳微球结构和性能的影响*
龚显年 ,黄荣榕 ,谢永纯 ,喻 航 ,苏 静 ,龙云飞 ,吴晓丹 ,文衍宣
(1.广西大学化学化工学院,广西南宁530004;2.中信大锰矿业有限责任公司)
锂离子电池因具有能量密度高、寿命长和安全稳定等特点而被广泛应用于手机、摄像机、笔记本电脑等便携式电子设备领域,且有望成为电动汽车的动力源[1-3]。随着人们生活水平的提高以及对环保重视程度的提高,人们对锂离子电池的需求和要求也在不断提升,迫切希望容量更高循环性能更好的锂离子电池出现。然而目前传统商业化锂离子电池负极材料石墨的理论容量(372 mA·h/g)较低,限制了其在高性能设备以及其他能量储存领域的应用[4-5]。所以,研发一种更高比容量、更长寿命、更优异倍率性能的锂离子电池负极材料至关重要。
在众多负极材料中,过渡金属氧化物因比容量高(通常大于700 mA·h/g,几乎是石墨理论比容量的2倍)而倍受重视[6]。而在过渡金属氧化物中,MnO具有相对较低的电压滞后(<0.8 V)、适宜的可逆电位(~1.032 V vs.Li+/Li)、高达 755 mA·h/g的理论比容量、较低的市场价格以及环境友好等优点,使之成为有可能替代石墨的负极材料[7-9]。但较差的电子电导率和锂离子嵌入脱嵌时的巨大体积变化导致MnO 的循环性能和倍率性能都不尽如人意[1,4,6]。 目前颗粒细化和碳包覆是改善MnO电化学性能比较常见的方法[10-12]。
MnO材料的合成方法主要有沉淀法[13]、水热法[14]、模板法[15]等,其中沉淀法具有适合大规模生产的优点而成为制备MnO的最常用方法。沉淀法制备 MnO 主要以水为溶剂[13,16-18],采用其他溶剂制备MnO的研究较少。低共熔溶剂是指由氢键供体和氢键受体按照一定化学计量比组合而成的两组分或多组分在低温或常温下呈液态的混合物[19],一般其熔点显著低于各个组分纯物质的熔点。低共熔溶剂因熔点低、热稳定性好、溶解度高、不易挥发和电导率高等特点而被称作绿色溶剂,在实际应用中凸显出许多传统溶剂无法比拟的优点[20]。
笔者在氯化胆碱-乙二醇低共熔溶剂中,以MnCl2·4H2O和NH4HCO3为原料,用化学沉淀法合成MnO/C多孔微球,并用X射线衍射、扫描电镜、场发射扫描电镜(FE-SEM)、比表面积及孔径测试、恒电流充放电测试、循环伏安测试等研究了原料配比对MnO/C材料形貌、结构及电化学性能的影响。
1 实验部分
1.1 材料制备
将氯化胆碱和乙二醇按物质的量比为1∶2混合,边搅拌边加热至80℃,保温2 h,自然冷却至室温,得到无色透明液体,装瓶封口,放在干燥器中备用。将MnCl2·4H2O加入低共熔溶剂中配成0.4mol/L的MnCl2低共熔溶液;配制一定浓度的NH4HCO3低共熔溶液。将两种溶液加入反应容器中恒温35℃搅拌反应4 h,过滤、洗涤得到浅粉色MnCO3粉末。将MnCO3与蔗糖溶液按质量比为10∶4超声混合,在60℃干燥得到MnCO3/蔗糖前驱体。将MnCO3/蔗糖前驱体在650℃氮气气氛中恒温焙烧6 h,得到黑色MnO/C复合材料粉末。
1.2 材料表征
用X′Pert PRO型XRD仪分析材料的组成和晶体结构;用S-3400N型SEM和SU8010型FE-SEM观察样品的形貌和颗粒大小;用V-Sorb X800比表面测试仪测量样品的比表面积和孔径。
1.3 电化学测试
MnO/C活性材料、乙炔黑和黏结剂聚丙烯酸锂(PAA-Li)按质量比为 8∶1∶1 在水溶剂中混合均匀,调成浆料并均匀涂在铜箔上,在120℃真空干燥箱中干燥12 h,最后切成直径为14 mm的圆片制成正极片。将正极片、金属锂负极、隔膜(Celgard 2400聚丙烯微孔膜)和电解液[1 mol/L的LiPF6的EC(碳酸乙烯酯)/DMC(碳酸二甲酯)/EMC(碳酸甲乙酯)溶液,体积比为 1∶1∶1]在充满氩气的手套箱中装配成CR2032型钮扣电池。采用CT-3008电池测试系统测量材料的循环性能和倍率性能,电压范围为0.01~3.0 V。交流阻抗和循环伏安采用PCI4750型电化学工作站进行测试。交流阻抗的交流电压为5 mV,频率测试范围为10-3~105Hz。循环伏安的电压范围为0.01~3.0 V,扫描速率为0.1 mV/s。
2 结果与讨论
2.1 原料配比对材料形貌、结构的影响
2.1.1 XRD分析
图1 为不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的XRD谱图。从图1看出,不同原料配比条件下制得MnO/C的衍射峰均与MnO的标准谱图(PDF#78-0424)相吻合,均属于立方晶系;无其他杂峰和碳的衍射峰存在,说明得到的样品是单一晶型的MnO材料,而且其中的碳是以无定形的形式存在。
2.1.2 SEM分析
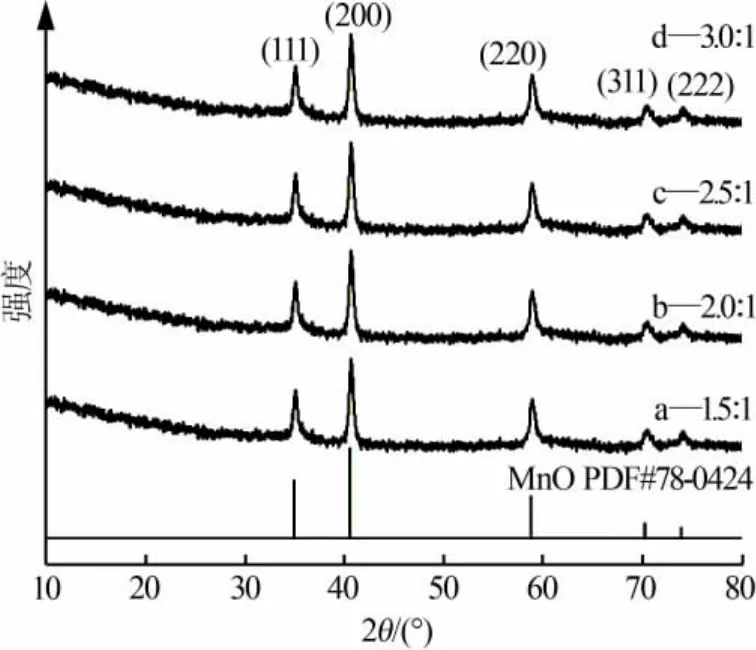
图1 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的 XRD 谱图
图2 、图3 分别为不同 n(NH4HCO3)∶n(MnCl2)合成MnCO3和MnO/C的SEM照片。由图2看出,前驱体MnCO3颗粒直径为0.5~2.5 μm。随着NH4HCO3加入量增加,颗粒直径逐渐变小,颗粒大小分布趋于均匀,颗粒球体形状越趋完整。在n(NH4HCO3)∶n(MnCl2)为 2.0∶1 时,MnCO3颗粒大小较为均匀,颗粒形状基本呈球形,颗粒直径平均在1 μm左右。随着NH4HCO3加入量进一步增加,MnCO3颗粒形状又偏离球体形状,多为形似立方体或多面体形状。图3中MnO/C的颗粒大小和形状与图2中MnCO3的颗粒大小和形状基本保持一致,且在n(NH4HCO3)∶n(MnCl2)为 2.0∶1 时 MnO/C 的颗粒大小分布较为均匀,颗粒的球体形状较为完整,表明经过650℃高温焙烧后材料的形貌没有发生显著的变化。

图2 不同 n(NH4HCO3)∶n(MnCl2)合成 MnCO3的 SEM 照片

图3 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的 SEM 照片
2.1.3 氮气吸附-脱附等温线分析
图4 为不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的氮气吸附-脱附等温线及其孔径分布曲线。由图4看出,不同原料配比合成MnO/C的氮气吸附-脱附等温线都具有典型的H2型滞后环,说明合成的样品均属于介孔结构材料。这主要是由于焙烧过程中MnCO3分解为MnO和CO2,CO2气体的产生并从反应体系中逸出从而形成了相互连通的多孔结构[21]。

图4 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的氮气吸附-脱附等温线及其孔径分布曲线
表1 为不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的氮气吸附-脱附曲线分析结果。从表1看出,MnO/C的比表面积、孔径和孔体积均随着n(NH4HCO3)∶n(MnCl2)的提高先增大后减小,在 n(NH4HCO3)∶n(MnCl2)为 2.0∶1 时 MnO/C 的比表面积、孔径和孔体积最大,与SEM照片相吻合。

表1 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的氮气吸附-脱附曲线分析结果
2.2 原料配比对材料电化学性能的影响
2.2.1 循环性能和充放电比容量-电压曲线
图5a 为不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C在1C(755 mA/g)测试条件下的循环性能。由图5a看出,不同原料配比合成的MnO/C首次比容量均高于理论比容量(755 mA·h/g),这主要是由于形成了不可逆的SEI膜,从而造成了首次放电比容量偏高。随着n(NH4HCO3)∶n(MnCl2)增大,MnO/C 比容量呈现先增大后减小的趋势,循环稳定性趋势也是如此。当n(NH4HCO3)∶n(MnCl2)为 2.0∶1 时,MnO/C 第二次循环放电比容量为830 mA·h/g,循环50次后容量保持率接近100%,具有较高的比容量和较好的循环性能。 主要是由于 n(NH4HCO3)∶n(MnCl2)为 2.0∶1时,颗粒分布比较均匀,粒径较小,具有较高的比表面积、孔径和孔体积,从而增大了电极/电解液界面接触面积,减小了锂离子扩散距离,有利于锂离子迁移和嵌入,从而具有较好的循环性能。图5b为不同n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的充放电比容量-电压曲线。由图5b可知,不同原料配比合成MnO/C的充放电比容量-电压曲线都在0.35 V左右有一个放电平台,对应Mn2+还原为Mn过程。与放电曲线相比充电曲线没有出现明显的电压平台,但在1.0~1.5 V有一个较缓斜坡,主要是金属锰氧化生成MnO的反应,而在2.0 V左右的另一个较小斜坡则是由于 Mn2+被进一步氧化为更高价态[4,6,22]。
2.2.2 倍率性能和充放电比容量-电压曲线
图6a、b 分别为 n(NH4HCO3)∶n(MnCl2)为 2.0∶1时合成MnO/C的倍率性能和充放电比容量-电压曲线。从放电循环曲线和充放电比容量-电压曲线可知,随着电流密度增大,材料的比容量呈阶梯状下降、电压平台变窄,说明电流增大会引起电极极化增大,导致充放电比容量下降。由放电循环阶梯倍率性能曲线可知,在 0.5、1.0、2.0、3.0、0.5C 放电倍率下对应的放电比容量分别为 885.7、794.0、725.1、670.2、920.5 mA·h/g,当电流恢复到小倍率时,容量也恢复到原来的高水平,说明制备的MnO/C负极材料具有优异的倍率性能。
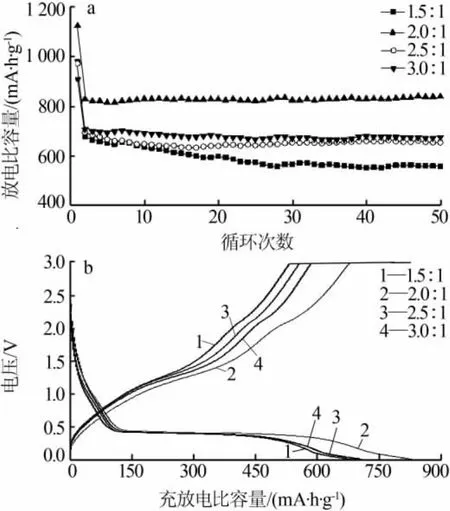
图5 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的循环性能曲线(a)和充放电比容量-电压曲线(b)
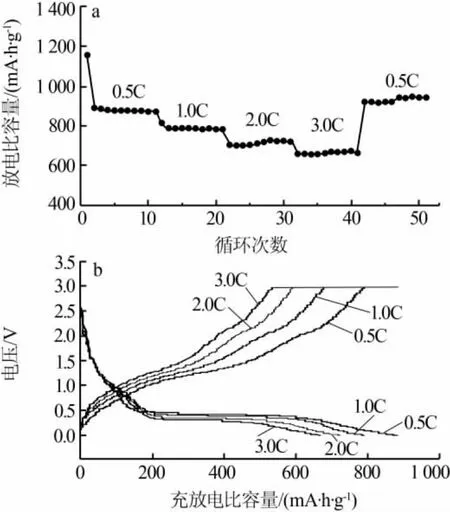
图6 n(NH4HCO3)∶n(MnCl2)为 2.0∶1 时合成 MnO/C 的倍率性能曲线(a)和充放电比容量-电压曲线(b)
2.2.3 循环伏安曲线
图7 为 n(NH4HCO3)∶n(MnCl2)为 2.0∶1 时合成MnO/C的循环伏安曲线。从图7看出,第一圈曲线的阴极扫描出现一个细长尖锐的还原峰,峰电压为0.02 V,这个尖锐峰的出现主要是由于第一圈材料放电时形成了不可逆的固态SEI膜,同时对应于MnO还原生成金属锰。从第二圈开始还原峰电压变成了0.3 V,并且电压位置不再发生变化,这表明从第二圈开始MnO+2Li→Mn+Li2O是一个可逆反应。再看闭合曲线上半部分,很容易发现从第一圈到第五圈都出现了一高一低2个氧化峰,第一个氧化峰电压均为1.3 V对应Mn+Li2O→MnO+2Li反应,而第二个氧化峰电压均为2.05 V,这个多出来的氧化峰已经被广泛证实,经过优良制备的氧化锰由于快速Li反应动力提升,电极中Mn2+可以进一步氧化为更高的氧化态(大于2价)[22-24]。 也正是Mn2+可以进一步氧化为更高的氧化态,因此使得最优材料的放电比容量比理论比容量要高。从图7看出,自第二圈起,循环伏安曲线基本重叠在一起,这说明制备的材料具有优良的电化学性能,这与循环性能图相对应。
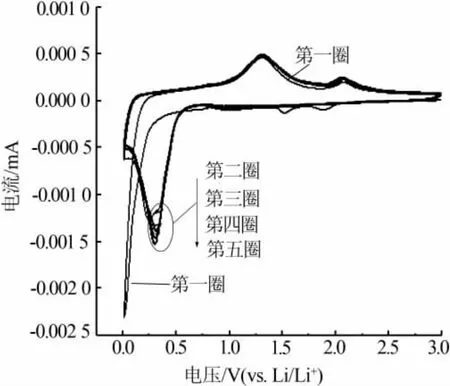
图7 n(NH4HCO3)∶n(MnCl2)为 2.0∶1合成MnO/C的循环伏安曲线
2.2.4 交流阻抗拟合谱图及等效电路
图8 为不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的交流阻抗拟合谱图及其等效电路。由交流阻抗拟合谱图可知,各个样品的曲线都是由高频区半圆、中频区半圆和低频区斜线组成,高频区半圆与SEI膜电阻和欧姆电阻有关,中频区半圆与电荷转移电阻和双电层电容有关,而低频区斜线对应锂离子在界面扩散引起的 Warburg 阻抗[25]。
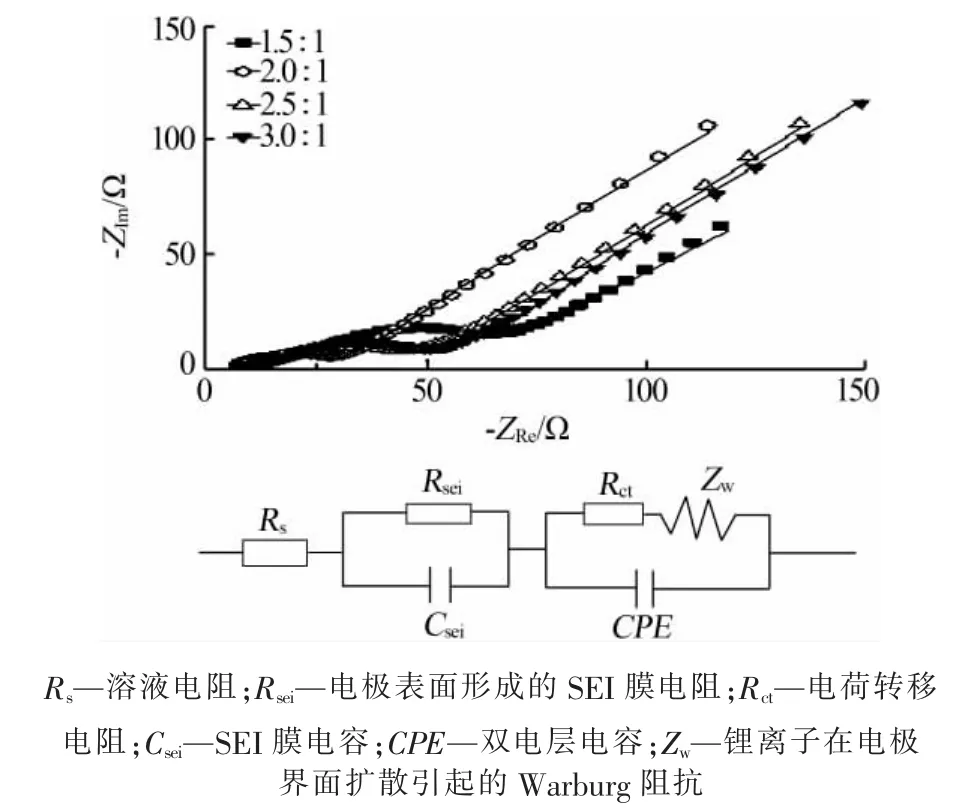
图8 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的交流阻抗谱图及其等效电路
表2 给出不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C交流阻抗谱图等效电路参数。从表2看出,随着n(NH4HCO3)∶n(MnCl2)增大,Rs、Rsei、Rct先减小后增大,而锂离子扩散系数则先增大后减小,但Rs变化幅度较小。 当 n(NH4HCO3)∶n(MnCl2)为 2.0∶1 时,MnO/C 具有较低 Rs、Rsei、Rct以及较大的锂离子扩散系数。主要是该条件合成的MnO/C具有较大的比表面积、孔径、孔体积以及较小的粒径,从而具有较大的电极/电解液界面接触面积和较短的锂离子扩散距离,有利于锂离子迁移和嵌入,从而具有较好的循环性能和倍率性能,与图5和图6结果一致。
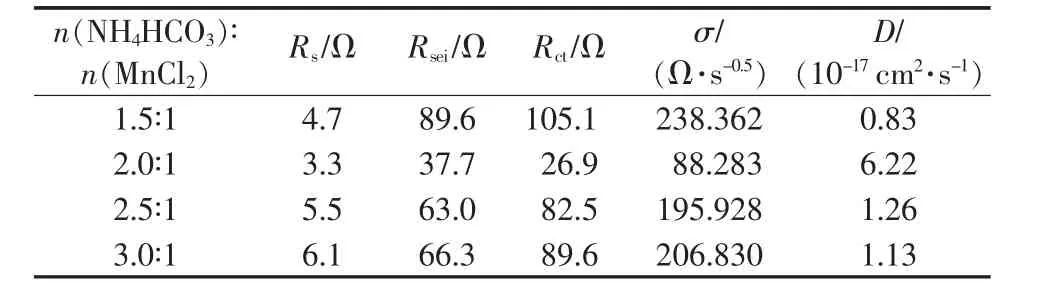
表2 不同 n(NH4HCO3)∶n(MnCl2)合成MnO/C的交流阻抗拟合结果
3 总结
在低共熔溶剂中用沉淀法制备了锂离子电池MnO/C多孔微球负极复合材料,并研究了n(NH4HCO3)∶n(MnCl2)对材料形貌、结构和电化学性能的影响。得出如下结论:1)MnO/C比表面积、孔径、孔体积、比容量、循环性能和倍率性能均随着 n(NH4HCO3)∶n(MnCl2)增加先增大后减小;2)n(NH4HCO3)∶n(MnCl2)为2.0∶1时制备的MnO/C多孔球体颗粒直径为0.5~2.5μm,平均孔径为11.5nm,比表面积高达127.7m2/g;3)MnO/C多孔球体颗粒在1C测试条件下放电比容量为830 mA·h/g,循环50次后容量保持率接近100%,具有较高的比容量和较好的循环性能。
[1]Zhu C,Han C G.Facile synthesis of MnO/carbon composites by a single-step nitrate-cellulose combustion synthesis for Li ion battery anode[J].Journal of Alloys& Compounds,2016,689:931-937.
[2]Dunn B,Kamath H,Tarascon J M.Electrical energy storage for the grid:a battery of choices[J].Science,2011,334(6058):928-935.
[3]Roy P.Nanostructured anode materials for lithium ion batteries[J].Journal of Materials Chemistry A,2015,3(6):2454-2484.
[4]Liu B,Li D,Liu Z,et al.Carbon-wrapped MnO nanodendrites interspersed on reduced graphene oxide sheets as anode materials for lithium-ion batteries[J].Applied Surface Science,2016,394:1-8.
[5]Yoo H D,Markevich E,Salitra G,et al.On the challenge of developing advanced technologies for electrochemical energy storage and conversion[J].Materials Today,2014,17(3):110-121.
[6]Liu D H,Lü H Y,Wu X L,et al.Constructing the optimal conductive network in MnO-based nanohybrids as high-rate and long-life anode materials for lithium-ion batteries[J].Journal of Materials Chemistry A,2015,3(39):19738-19746.
[7]Zhang K,Han P,Gu L,et al.Synthesis of nitrogen-doped MnO/graphene nanosheets hybrid material for lithium ion batteries[J].ACS Applied Materials& Interfaces,2012,4(2):658-664.
[8]Xia Y,Xiao Z,Dou X,et al.Green and facile fabrication of hollow porous MnO/C microspheres from microalgaes for lithium-ion batteries[J].ASC Nano,2013,7(8):7083-7092.
[9]Jiang H,Hu Y,Guo S,et al.Rational design of MnO/carbon nanopeapods with internal void space for high-rate and long-life Li-ion batteries[J].ACS Nano,2014,8(6):6038-6046.
[10]SunX,XuY,DingP,etal.Thecompositesphereofmanganeseoxide and carbon nanotubes as a prospective anode material for lithiumionbatteries[J].JournalofPowerSources,2014,255(6):163-169.
[11]Zhong K,Xia X,Zhang B,et al.MnO powder as anode active materials for lithium ion batteries[J].Journal of Power Sources,2010,195(10):3300-3308.
[12]ChaeC,ParkH.ALi-ionbatteryusingLiMn2O4cathodeand MnOx/C anode[J].Journal of Power Sources,2013,244(4):214-221.
[13]Liu Y,Zhao X.Facile synthesis of MnO/C anode materials for lithium-ion batteries[J].Electrochimica Acta,2011,56 (18):6448-6452.
[14]Park H,Yeom D H.MnO/C nanocomposite prepared by one-pot hydrothermal reaction for high performance lithium-ion battery anodes[J].Korean Journal of Chemical Engineering,2015,32(1):178-183.
[15]Wang T,Peng Z P,Wang Y,et al.MnO nanoparticle@mesoporous carbon composites grown on conducting substrates featuring highperformance lithium-ion battery,supercapacitor and sensor[J].Scientific Reports,2013,3(9):2693-2701.
[16]Zhong K,Zhang B,Luo S,et al.Investigation on porous MnO microsphere anode for lithium ion batteries[J].Journal of Power Sources,2011,196(16):6802-6808.
[17]Li K,Shua F,Guo X,et al.High performance porous MnO@C composite anode materials for lithium-ion batteries[J].Electrochimica Acta,2016,188(3):793-800.
[18]Wang S,Xing Y.MnO nanoparticles interdispersed in 3D porous carbon framework for high performance lithium-ion batteries[J].ACS Applied Materials& Interfaces,2014,6(15):12713-12718.
[19]韦露,樊友军.低共熔溶剂及其应用研究进展[J].化学通报,2011,74(4):333-339.
[20]Welton T.Room-temperature ionic liquids.solvents for synthesis and catalysis[J].Chemical Reviews,1999,99(8):2071-2083.
[21]Yang Z,Zhang W,Wang Q,et al.Synthesis of porous and hollow microspheres of nanocrystalline Mn2O3[J].Chemical Physics Letters,2006,418(1/2/3):46-49.
[22]Sun Y.Reconstruction of conformal nanoscale MnO on graphene as a high-capacity and long-life anode material for lithium ion batteries[J].Advanced Functional Materials,2013,23(19):2436-2444.
[23]Wang H,Cui L F,Yang Y,et al.Mn3O4-graphene hybrid as a highcapacity anode material for lithium ion batteries[J].Journal of the American Chemical Society,2010,132(40):13978-13980.
[24]Guo J,Liu Q.Interdispersed amorphous MnOx-carbon nanocomposites with superior electrochemical performance as lithium-storage material[J].AdvancedFunctionalMaterials,2012,22(4):803-811.
[25]庄全超,徐守冬,邱祥云,等.锂离子电池的电化学阻抗谱分析[J].化学进展,2010,22(6):1044-1057.

