酸改性镁剂烟气脱硫废渣除磷性能研究*
朱 伟 ,董延茂 ,顾明玉 ,赵羿博 ,章启帆 ,蔡顺智
(1.苏州科技大学环境科学与工程学院,江苏苏州215009;2.苏州科技大学化学生物与材料工程学院;3.江苏省环境功能材料重点实验室)
磷是自然界中重要的营养元素,但是过量P进入水体会造成富营养化。常用的除磷方法有化学沉淀法、生物法、吸附法、人工湿地法等[1],其中吸附法具有操作简便、无二次污染等优点。目前以废治废和制备成本低、吸附效果好的吸附剂均是国内外研究的热点,如将明矾泥[2]、废弃铁铝泥[3]、粉煤灰[4]等固体废弃物改性制成新型除磷吸附剂。镁剂脱硫废渣(MDR)产生于热电厂湿法氧化镁烟气脱硫工艺,含有硅藻土[5]以及大量氧化镁和脱硫产生的镁盐[6],具有极大的吸附除磷能力。围绕MDR资源化利用以及废水除磷,研究了改性MDR制备新型除磷吸附剂的工艺条件及其除磷性能与机理。
1 实验部分
1.1 实验原料
镁剂脱硫废渣取自南通醋酸纤维公司热电厂;硫酸、磷酸二氢钾、氢氧化钠、盐酸、钼酸铵、抗坏血酸、酒石酸锑钾,均为分析纯;去离子水。
1.2 实验方法
1.2.1 酸改性实验
调节集热式恒温水浴搅拌器至设定的温度(25~70℃)。称取10g干燥的MDR于250 mL锥形瓶中,加入一定量硫酸溶液(0.5~2.5 mol/L),控制固液质量比为1∶(2~6)。置于恒温水浴搅拌器中,以 200 r/min的搅拌转速反应一段时间(60~300 min)。反应结束后,将物料倒入蒸发皿中,置于80℃烘箱中烘干。破碎、研磨、过筛(孔径为75μm),制成酸改性脱硫废渣(A-MDR),装瓶保存。
1.2.2 除磷实验
称取0.439 4 g干燥的KH2PO4溶解并定容至1 000 mL,制得KH2PO4质量浓度为50 mg/L的模拟废水。取50 mL模拟废水于碘量瓶中,调节pH至适宜值,加入一定量A-MDR,置于恒温水浴振荡器中以180 r/min的振荡速率反应一段时间,控制振荡器温度为25℃。反应结束后静置30 min,取上清液过滤,测定滤液的剩余磷质量浓度ρe(mg/L),计算磷去除率 η(%)和吸附量 q(mg/g):η=(ρ0-ρe)/ρ0×100%;q=(ρ0-ρe)V/m。式中:ρ0为水样磷质量浓度,50 mg/L;V为水样体积,0.05 L;m为A-MDR投加量,g。
1.3 分析方法
用DR5000紫外分光光度计测定水样磷质量浓度。用Quanta 250 FEG热场发射环境扫描电镜(SEM)观测样品的表面微观形貌。用ApolloSDD10能谱仪(EDS)测定样品的元素组成。用V-Sorb2800TP比表面积与孔径分析仪测定样品的比表面积、孔容和孔径。用DX2700型X射线粉末衍射仪(XRD)分析样品的晶体结构。用TJ270-30红外分光光度计对样品进行表面官能团分析。
2 结果与讨论
2.1 MDR微观结构与成分分析
MDR的SEM照片见图1,其中a、b、c对应①②③结构的相似颗粒。a、b、c的EDS图见图2,计算得出MDR的主要元素组成见表1。结合图1和图2可知,MDR微观结构复杂,按形状大致分为3类:1)表面含微孔的圆盘状结构(图1a),粒径为20~50 μm,元素主要为Si和O,并有少量Al、Fe、Mg等金属元素,该结构符合王宗霞等[7]对硅藻土的微观描述,确定是硅藻土成分;2)球状结构(图1b),主要含 Si、Al、O元素,推测主要成分是Al的氧化物,Si是硅藻土的成分;3)表面粗糙的不规则块状结构(图1c),主要元素是Mg、O,应该是MDR中未被利用的MgO。这3种结构的颗粒并非都是单独存在,多数情况呈聚集态,相互堆叠。经分析计算,判断MDR主要成分为硅藻土和MgO,按质量分数计SiO2占50%~60%,Al、Fe、Ca 等金属氧化物约占 5%,MgO、MgCO3等含镁化合物约占40%。

图1MDR的SEM照片
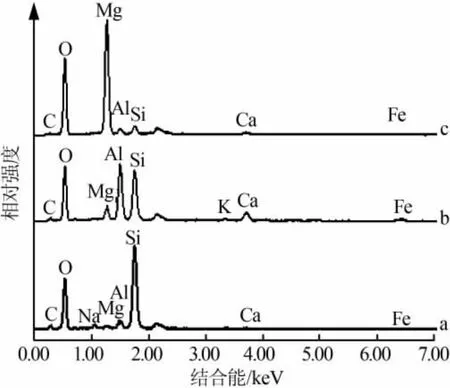
图2 MDR 中 a、b、c的 EDS图
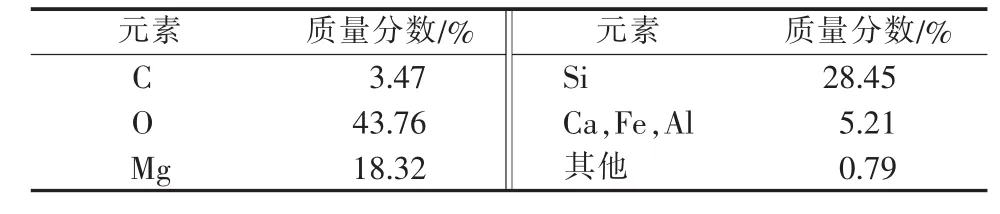
表1 MDR主要元素组成
2.2 MDR改性实验
改性MDR制备除磷吸附剂有很好的潜力。原因是MDR中的硅藻土有较大的比表面积和大量孔道,本身就具有物理吸附磷的能力[8],具有大量吸附位点,是良好的吸附剂基质。此外,MDR中大量镁盐在一定条件下能与水中的磷酸根、次磷酸根等结合形成磷酸盐沉淀,具有很强的化学吸附磷的能力[9]。
MDR中的镁盐以MgO为主,MgO难溶于水,吸附磷过程中需先溶解形成Mg(OH)2,导致处理效率低、反应时间长。陈静霞等[10]以MgO为镁盐的脱氮除磷实验中,反应超过2 h后才取得良好的效果。而且吸附反应中产生的不溶性物质会沉积在MgO表面,进一步降低磷的吸附能力。
经过实验分析,确定通过硫酸改性制备新型除磷吸附剂A-MDR。酸改性会将MDR中的MgO转化为离子态,形成MgSO4等晶体附着于硅藻土表面,增强吸附剂的表面活性,从而提升化学吸附能力;而硅藻土基质通过酸改性,也可以溶解酸溶性杂质,疏通内部孔道,增大整体孔容积和比表面积,提高物理吸附效果[11]。
通过单因素实验初步确定MDR改性条件:硫酸浓度为2.0 mol/L,固液质量比为1∶4,改性时间为180 min,水浴温度为60℃。选取各因素最佳条件为中值的3个水平,以L9(34)正交表进行正交实验。正交实验因素及水平见表2,实验方案及结果表3。由表3看出,硫酸浓度为主要因素,固液质量比为次要因素;在A2B1C2D3条件下制备的A-MDR对磷的去除率最高(97.1%)。A-MDR最佳制备条件:硫酸浓度为2.0 mol/L,固液质量比为1∶3.5,改性时间为180 min,水浴温度为65℃。

表2 正交实验因素及水平
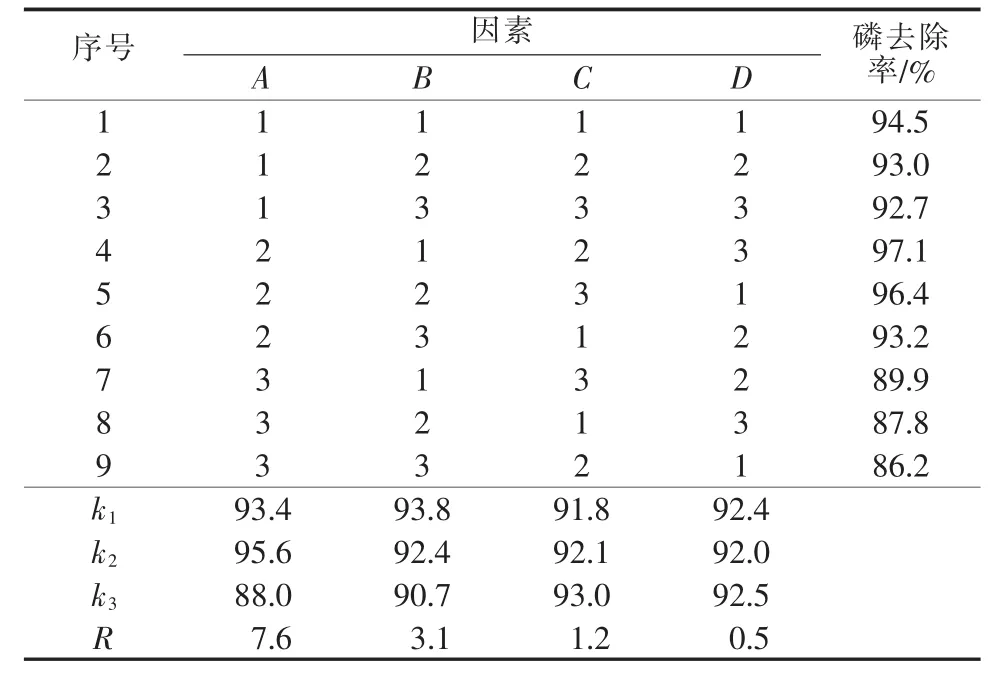
表3 正交实验方案及结果
2.3 MDR改性前后性能表征
2.3.1 A-MDR形貌分析
图3为A-MDR的SEM照片。A-MDR以硅藻土颗粒为骨架,表面附着大量晶体,并夹杂部分球状金属氧化物。与图1对比,A-MDR具有新的表面结构,原来硅藻土的部分微孔被覆盖,但同时有大量不规则新微孔产生;整体孔径均有减小,这是因为改性时析出的Mg2+进入孔道形成镁盐附着于孔道中造成孔径减小。但是,也因为形成了新表面结构,A-MDR整体比表面积明显增大,表面有效吸附位点增多、活性增强,磷吸附能力得到提高。

图3A-MDR的SEM照片
2.3.2 MDR和A-MDR的BET分析
MDR和A-MDR的BET分析结果见表4。两者比表面积均较大,孔径为2~50 nm,属于介孔材料。A-MDR与MDR相比,比表面积增大了46.6%,孔容积增大了28.0%。结合BET与SEM分析,A-MDR比表面积和孔容积的增加是由于MDR形成了新的疏松表面,出现较多不规则孔道;而A-MDR平均孔径略有减小,其原因主要是改性反应中游离态的金属离子进入孔道,形成金属盐堆积堵塞孔道或附着于其中而导致孔径变小。但是,这些金属盐在除磷反应中会逐渐溶解释放出大量的活性吸附点位,反而增强了孔道的吸附能力。
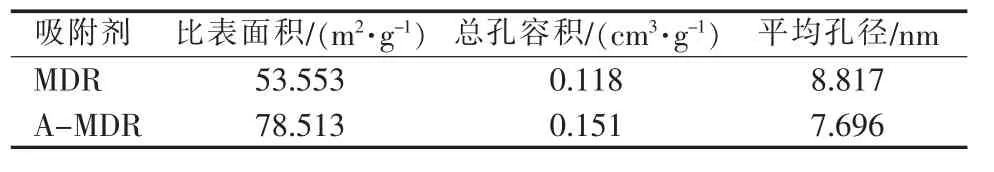
表4MDR和A-MDR的BET分析结果
2.3.3 MDR和A-MDR晶型结构分析
MDR和A-MDR的XRD谱图见图4。MDR和A-MDR 在 2θ为 21.79、26.64、46.79、53.85 °出现硅藻土特征峰[12], 在 2θ为 32.65、35.84、42.99 °出现MgCO3、MgO特征峰,MgCO3是MDR中MgO暴露于空气中在表面形成的碱式碳酸镁;A-MDR在2θ为25.16、41.55 °出现 MgSO4、MgS2O7等镁盐特征峰。 两样品的主要峰型尖锐窄小、基线平稳,说明样品纯度与结晶度高[13]。以 Scherrer公式(D=Kλ/Bcos θ)计算出样品的主要晶体粒径范围由改性前的10.39~74.71 nm提升至改性后的21.98~86.67 nm,上升幅度较小。这是因为,MDR改性后在其表面形成的MgSO4等镁盐晶体的结晶水含量较多。
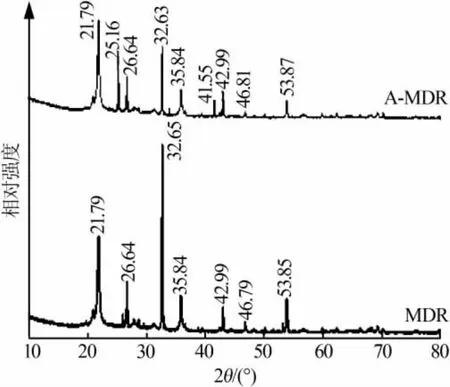
图4MDR和A-MDR的XRD谱图
2.3.4 表面官能团分析
MDR和A-MDR的IR图见图5。A-MDR在3055~3218cm-1处较宽的吸收峰,MDR在3 236 cm-1处的吸收峰以及在1 617、1 639 cm-1处的吸收峰,均属于 HCO3-特征峰[14],主要来自 MgO与空气中的CO2、H2O 反应形成的碱式碳酸镁;在 1 385、1 399、1 093 cm-1处可能是SiO42-或者SO42-特征吸收峰,AMDR在1 093 cm-1处的吸收峰强而宽,可能是形成的新表面中SO42-增多的原因;在3 410~3 530 cm-1出现强而宽的吸收峰是结晶水中羟基(—OH)和Mg—OH 的伸缩振动峰[15],分析推测 A-MDR 利用Mg—OH中羟基与磷的配位体交换达到除磷目的[16]。
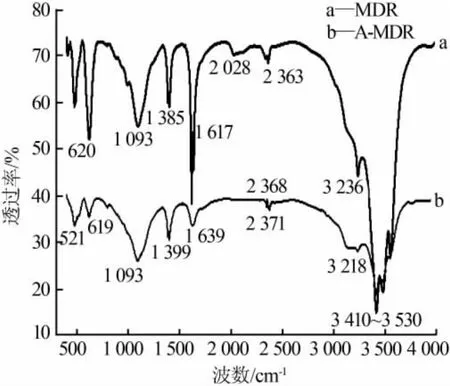
图5MDR和A-MDR的红外光谱图
2.4 吸附除磷实验
2.4.1 溶液初始pH及A-MDR投加量的影响
在A-MDR投加量为5g/L、吸附时间为120 min条件下,控制溶液初始pH为4~13进行除磷实验,结果见图6a。溶液pH对A-MDR除磷的影响较大,pH为4~7时磷去除率较低,而在偏碱性条件下磷去除率随pH提高明显上升,但是pH超过11以后磷去除率又略微下降。磷的去除效果在pH为9~11时最佳,选择溶液初始pH为9。溶液偏酸性时,磷主要以 H3PO4、H2PO4-、HPO42-等形态存在,难以与金属离子结合形成沉淀[17],导致磷去除率较低。随着pH上升,磷的形态逐渐转变为以HPO42-和PO43-为主,磷去除率开始上升。但是,pH升高溶液中的氢氧根含量增多,有利于与 Mg2+结合形成 Mg(OH)2,pH 大于11 时溶液中 OH-与 PO43-竞争吸附点位[18],对磷的去除过程产生抑制作用,导致磷去除率略有下降。
在溶液初始pH为9、反应时间为120 min条件下,投加0.1~0.7g的A-MDR进行除磷实验,即AMDR投加量为2~14 g/L,实验结果见图6b。磷去除率随A-MDR投加量增加而上升,原因是A-MDR投加量增多可以提供更多的吸附比表面积和吸附点位,使固液相接触面积增大,提升磷吸附量[19]。A-MDR投加量超过12 g/L以后磷去除率趋于稳定,这是因为吸附磷酸盐已达到固定反应时间内的平衡,继续增加投加量并不能使吸附达到完全饱和。选择A-MDR投加量为12 g/L。
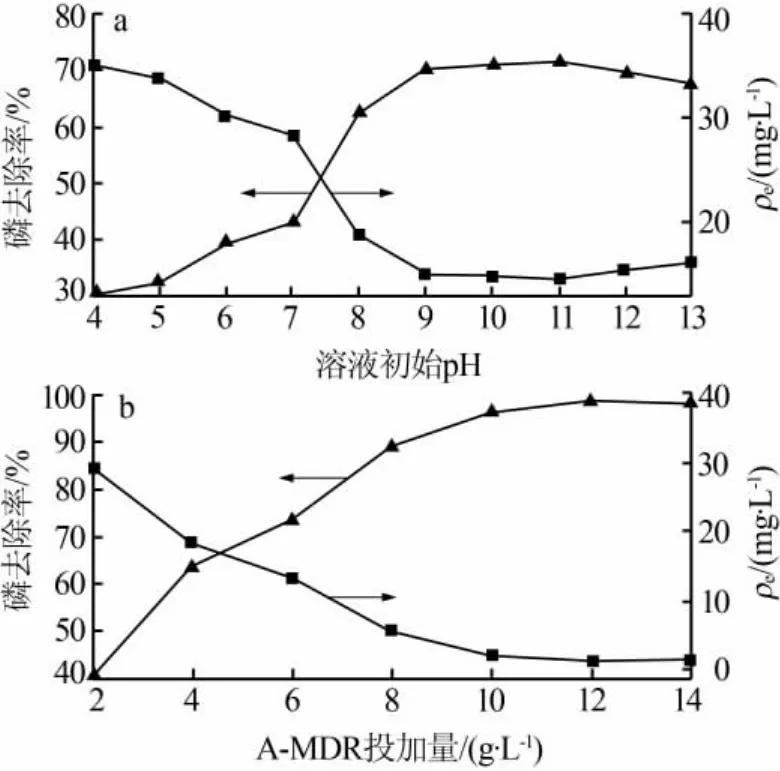
图6 溶液初始pH(a)及A-MDR投加量对除磷效果的影响
2.4.2 共存阴离子的影响
对共存阴离子的抗干扰能力是除磷吸附剂的重要性能。 废水中常存在 Cl-、SO42-、HCO3-和 NO32-等[20],会对磷的吸附过程产生影响。在溶液pH为9、A-MDR投加量为5 g/L、吸附时间为120 min条件下,共存阴离子对A-MDR除磷能力的影响见图7。在 Cl-、SO42-、NO32-质量浓度分别为 1.0、10、100 mg/L情况下,三者各自的磷去除率随着离子质量浓度的增加而降低的极差仅有1.5%、0.8%、2.2%,说明AMDR对Cl-、SO42-、NO32-的抗干扰能力较强; 在 HCO3-存在时,磷的去除能力受到明显抑制,质量浓度分别为1.0、10、100 mg/L时,磷的去除率分别为97.6%、94.1%、82.4%,这是因为A-MDR中的 Mg2+易与结合,与和等同时存在于液相中会互相竞争表面的吸附位点,故会对磷的吸附过程产生一定的抑制作用。
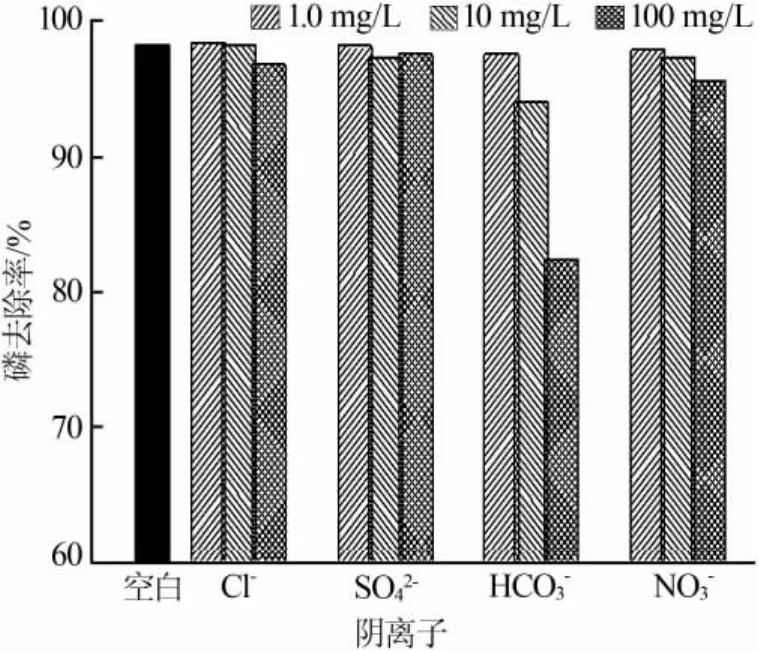
图7 溶液中共存阴离子对除磷效果的影响
2.4.3 反应时间及吸附动力学
为研究A-MDR的吸附机理,进行吸附动力学实验。在溶液初始pH为9、A-MDR投加量为12g/L、反应时间为15~360 min条件下,反应时间对除磷效果的影响见图8。吸附过程分别用式(1)准一级动力学方程和式(2)准二级动力学方程进行拟合[21],作 t对 lg(qe-qt)和 t对 t/qt拟合图,结果见图9,动力学参数见表5。

式中:qe为平衡吸附量,mg/g;qt为 t时刻吸附量,mg/g;k1为准一级反应速率常数,min-1;k2为准二级反应速率常数,g/(mg·min)。
由图8可知,反应时间为15~90 min,A-MDR表面大量结合点位吸附溶液中的磷,磷去除率快速上升,在90 min时达到95.8%;当反应时间超过90 min以后,吸附剂表面的结合点位逐渐减少[22],磷去除率缓慢上升,并逐渐趋于稳定;反应时间达到240 min以后吸附达到平衡,磷去除率稳定在99.2%,qe为4.96 mg/g。实际处理含磷废水时吸附反应时间不宜过长,选择120 min较为合适,磷的去除率为98.2%。
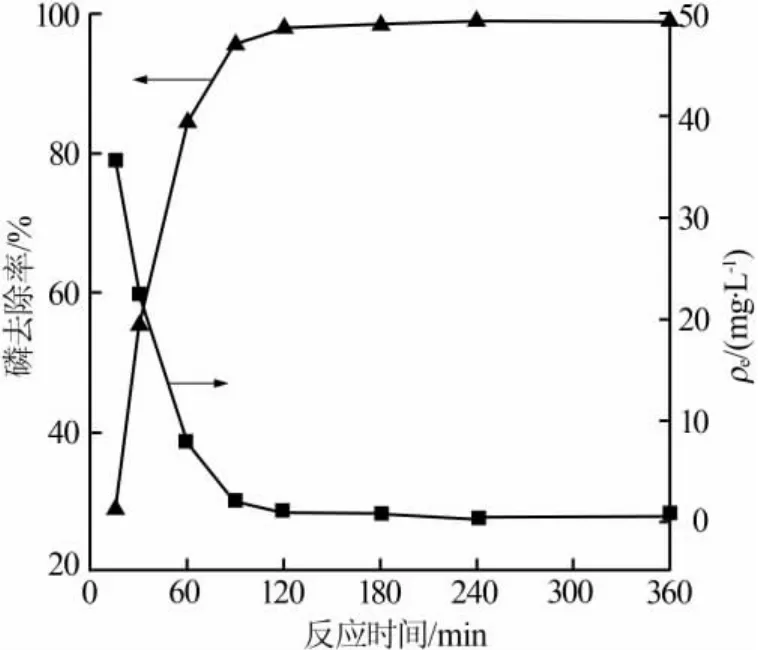
图8 反应时间对除磷效果的影响
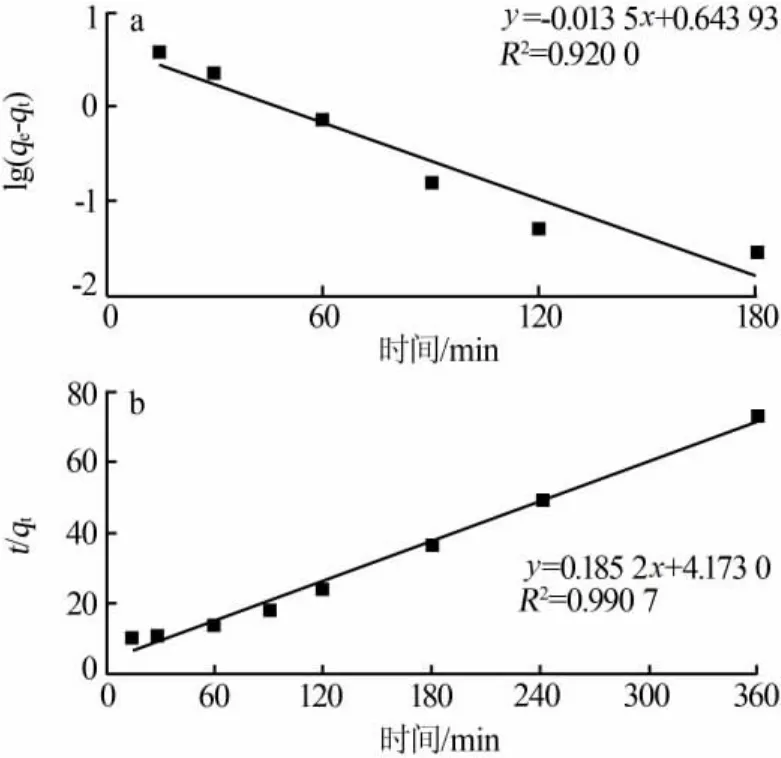
图9 动力学模型拟合
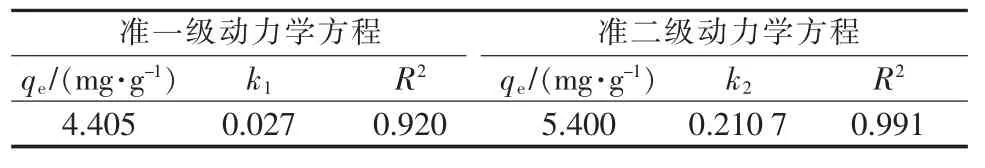
表5 A-MDR吸附磷的动力学参数
由图9和表5可知,A-MDR除磷吸附过程比较遵循准二级动力学模型,R2为0.991,准一级动力学方程R2为0.920,说明物理吸附作用相对较小,主要是Mg2+和Mg—OH对磷的化学吸附。
2.4.4 等温吸附模型
配制质量浓度为500 mg/L的模拟废水,分别稀释 至 质 量 浓 度 为 50、100、150、200、250、300、400、500 mg/L进行实验。实验条件:溶液初始pH为9,A-MDR投加量为10 g/L,吸附时间为360 min。Langmuir方程和Freundrich方程是常用等温吸附模型,Langmuir模型适用于拟合单分子层吸附过程,Freundrich模型适用于拟合非均质或多层吸附过程,其公式如式(3)(4),拟合结果见图10和表6。
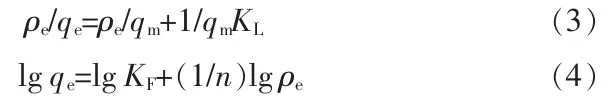
式中:qe为平衡吸附量,mg/g;qm为饱和吸附量,mg/g;ρe为吸附平衡时剩余磷质量浓度,mg/L;KL为Langmuir平衡常数;KF和n为Freundrich平衡常数。
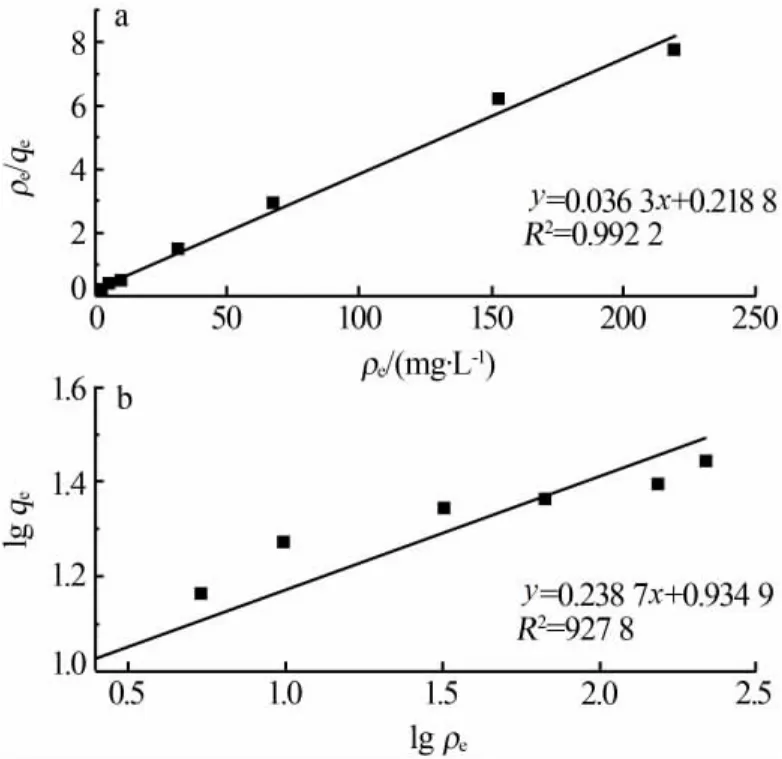
图10 吸附等温线

表6 A-MDR吸附磷的等温吸附方程参数
从图10和表6看出,Langmuir模型比Freundrich模型更适合A-MDR除磷吸附数据拟合,二者R2分别为0.992和0.928,说明吸附过程属于单分子层吸附。改性后的A-MDR活性增加,表面出现大量结合点位[23],溶液中的PO43-主要与这些点位上的金属离子吸附,发生化学沉淀反应。Langmuir方程中,qm与KL的乘积可表示最大缓冲容量,其值为4.573 L/g,说明A-MDR对固液体系有较强的缓冲能力[24]。根据 Langmuir等温吸附模型可算出A-MDR的qm为27.548 mg/g,高于大多数同类型除磷吸附剂,如热活化废弃铁铝泥[4]为 22.86 mg/g、人工合成水 铁 矿[18]为 6.95 mg/g、热 改 性 钢 渣[20]为13.62 mg/g,说明A-MDR是一种成本低、吸附容量大的新型除磷吸附剂。
2.4.5 吸附除磷机理
A-MDR投加至废水中,其表面的吸附位点与固液界面层的液膜间存在磷的高低浓度梯度力,磷酸盐受到此梯度力而快速迁移至A-MDR表面,进入活性吸附位点中,其吸附速率主要受膜扩散过程控制。表面吸附位点中含有活性较强的Mg2+和Mg—OH官能团,这两者都具有较强的化学吸附磷的能力。磷酸盐受电子力牵引能与吸附点位中的Mg2+结合形成化学键而被牢牢固定于A-MDR表面;或者磷酸盐与Mg—OH中的羟基发生配位体交换而被吸附。随着吸附反应的进行,磷不断由液相转移至固相,最后通过固液分离而被去除。
3 结论
1)A-MDR制备条件:硫酸浓度为2.0 mol/L,固液质量比为1∶3.5,改性时间为180 min,水浴温度为65℃。2)表征结果:MDR中主要是硅藻土和MgO为主的镁盐;A-MDR形成了新表面,主要是MgSO4等镁盐晶体;A-MDR比表面积、孔容和晶体粒径等均有增大;A-MDR表面官能团出现了Mg—OH。3)A-MDR吸附除磷最佳条件:溶液 pH为 9.0,A-MDR投加量为12 g/L,反应时间为120 min;而且A-MDR 具有抗 Cl-、SO42-、NO32-等共存阴离子影响的能力。A-MDR的吸附结果遵循准二级动力学方程,属于化学吸附;其等温吸附过程符合Langmuir模型,最大吸附量为27.548 mg/g,高于多数改性固体废弃物除磷吸附剂。4)A-MDR依靠Mg2+和Mg—OH的化学吸附过程除磷,是一种成本低、制备简单、吸附性能好、吸附容量高的新型除磷吸附剂。
[1]唐朝春,刘名,陈惠民,等.吸附除磷技术的研究进展[J].水处理技术,2014,40(9):1-7,12.
[2]BabatundeAO,ZhaoYQ.Equilibriumandkineticanalysisofphosphorus adsorption from aqueous solution using waste alum sludge[J].Journal of Hazardous Materials,2010,184(1):746-752.
[3]高思佳,王昌辉,裴元生.热活化和酸活化给水处理厂废弃铁铝泥的吸磷效果[J].环境科学学报,2012,32(3):606-611.
[4]王宇,谌建宇,李小明,等.镧改性粉煤灰合成沸石的同步脱氨除磷研究[J].中国环境科学,2011,31(7):1152-1158.
[5]Meng X,Huang H,Shi L.Reactive mechanism and regeneration performanceofNiZnO/Al2O3-diatomiteadsorbentbyreactiveadsorption desulfurization[J].Industrial&Engineering Chemistry Research,2013,52(18):6092-6100.
[6]董延茂,郭叶书,江建军,等.改性氧化镁脱硫废渣协效阻燃环氧树脂的研究[J].环境科技,2012,25(3):16-20.
[7]王宗霞,曾路,王小波,等.硅藻土在扫描电镜下的微观形貌[J].电子显微学报,2006,25(增刊):345-346.
[8]吴蕾,陈云峰.改性硅藻土用于巢湖水脱磷研究[J].环境工程学报,2011,5(4):777-782.
[9]徐丰果,罗建中,凌定勋.废水化学除磷的现状与进展[J].工业水处理,2003,23(5):18-20.
[10]陈静霞,李咏梅.鸟粪石沉淀法预处理高氨氮废水的镁盐研究[J].环境工程学报,2011,5(12):2663-2667.
[11]刘阳,赵丹,董延茂,等.改性硅藻土除磷剂的研究进展[J].污染防治技术,2012,25(4):23-26.
[12]苏营营,于艳卿,杨沛珊,等.纳米TiO2/硅藻土光催化降解蒽醌染料废水的研究[J].中国环境科学,2009,29(11):1171-1176.
[13]陈敏东,王洪艳,刘宝生,等.镁铝水滑石固载重铬酸钾及其氧化性能[J].环境化学,2008,27(5):591-595.
[14]梁艳,赵杰,王来.贝壳的傅立叶变换红外光谱和热分析[J].矿物岩石,2007,27(2):12-16.
[15]孔茜,杜倩.镁铝LDH制备表征及吸附磷酸根离子的性能研究[J].环境科学与技术,2011,34(3):102-104.
[16]陈再明,方远,徐义亮,等.水稻秸秆生物碳对重金属Pb2+的吸附作用及影响因素[J].环境科学学报,2012,32(4):769-776.
[17]刘理华,刘书群,柴永明,等.磷化镍催化剂的制备机理及其加氢脱氮性能[J].燃料化学学报,2013,41(3):335-340.
[18]He G,He L,Zhao Z,et al.Thermodynamic study on phosphorus removal from tungstate solution via magnesium salt precipitation method[J].Transactions of Nonferrous Metals Society of China,2013,23:3440-3447.
[19]崔蒙蒙,王殿升,黄天寅,等.人工合成水铁矿对含磷废水的吸附性能[J].环境科学,2016(9):3498-3507.
[20]李佳,林建伟,詹艳慧,等.镧改性沸石对水中磷酸盐和铵的去除性能[J].上海海洋大学学报,2012,21(5):800-808.
[21]Cui H J,Wang M K,Fu M L,et al.Enhancing phosphorus availability in phosphorus-fertilized zones by reducing phosphate adsorbed on ferrihydrite using rice straw-derived biochar[J].Journal of Soils and Sediments,2011,11:1135-1141.
[22]Yu J,Liang W,Wang L,et al.Phosphate removal from domestic wastewater using thermally modified steel slag[J].Journal of Environmental Sciences,2015,31:81-88.
[23]李坤权,郑正,罗兴章,等.KOH活化微孔活性炭对对硝基苯胺的吸附动力学[J].中国环境科学,2010,30(2):174-179.
[24]陆燕勤,朱丽,何昭菊,等.沸石负载氧化铁吸附剂吸附除磷研究[J].环境工程,2015(4):48-52.

