氯化铵制备氯化钙及除氨工艺研究*
张晓同,李 军,金 央,贾晓艳,余德芳
(四川大学化学工程学院,四川成都610065)
联氨法制碱工业、萃取法生产硫酸钾工业、稀土湿法分离工业都会产生大量氯化铵废液。中国对于氯化铵废液的利用方式主要是以氮的形式加入复合肥,但是这种肥料对于干旱少雨地区以及对氯离子敏感的作物都不宜使用,而且氯化铵应用于氮肥只是利用了其中的氮元素,对于有价值的氯元素没有加以利用[1],因此需要对氯化铵废液作进一步处理。氯化铵废液的处理方法主要有索尔维法和新旭法[2],这两种方法是向质量分数为10%的氯化铵溶液中加入石灰乳,生成氯化钙和氨,将氨蒸出返回纯碱系统,实现氨的循环。但是这类方法会产生大量氯化钙质量分数为10%的废液,造成环境污染和水资源的浪费。刘润静等[3]提出将高浓度的氯化铵溶液与氢氧化钙粉末反应,生成氨和固体氯化钙,将氨蒸出实现氨的循环利用,同时副产固体氯化钙。但是这种方法能耗高,对设备要求高,生产的氯化钙纯度低。 周振喜[4]、莫如财等[5]、尹小春等[6]的专利提出,将低浓度的氯化铵废液与氧化钙或氢氧化钙反应,蒸馏出体系中的氨,氯化钙溶液澄清处理,但是各专利均未给出氯化钙溶液浓缩和氨脱除的具体数据。笔者对氯化铵溶液与氧化钙的反应进行了研究,考察了反应温度、原料配比、氯化铵溶液质量分数以及蒸发真空度、蒸发温度、蒸发时间等因素对反应和浓缩除氨过程的影响,确定了生产氯化钙固体的最佳工艺条件,且氨气回收再利用。
1 实验部分
1.1 试剂与仪器
试剂:氯化铵(AR)、氧化钙(AR)、氢氧化钠溶液(质量分数为 40%)、硝酸溶液(7.5 mol/L)、硫酸溶液(0.05 mol/L)、氢氧化钠标准溶液(0.100 0 mol/L,邻苯二甲酸氢钾基准试剂标定)、硝酸银标准溶液(0.050 0 mol/L,氯化钠基准试剂标定)、甲基红-亚甲基蓝指示剂、去离子水。
仪器:DF-101S集热式恒温加热磁力搅拌器,SHZ-95B型循环水式多用真空泵,VC-100A真空控制器,RE-52CS旋转蒸发器,KDN-102F自动定氮仪,916Ti-Touch型电位滴定仪,BSA224S型电子天平,JJ1000型电子天平。
1.2 实验方法
将氯化铵溶液、氧化钙粉末按照不同的配比加入反应器中,将反应器固定到集热式磁力搅拌器中,调整搅拌转速为650 r/min,将物料在不同温度下反应40 min使反应完全[7]。反应结束后将溶液倒入旋转蒸发仪的蒸馏烧瓶中,调整旋转速度为40 r/min,在不同温度和不同压力下蒸发浓缩20 min。取样,加入到100 mL容量瓶中定容,摇匀。检测样品中氯化钙质量分数达到45%、氨质量分数降到3%以下。将溶液倒入布氏漏斗减压抽滤,滤液倒回蒸馏烧瓶中,按上述步骤蒸发浓缩70 min。取样,分析样品中氨和氯化钙的质量分数。
采用凯氏定氮法测定溶液中的氮浓度[8]然后计算氨的质量分数;采用硝酸银滴定法(916 Ti-Touch电位滴定仪,银电极6.0430.100)测定氯离子浓度[9]并计算氯化钙溶液质量分数。
2 实验结果与讨论
2.1 反应温度的影响
氧化钙和质量分数为35%的氯化铵溶液以n(CaO)∶n(NH4Cl)=1.3∶2 加料,反应时间为 40 min,考察反应温度对溶液中氨和氯化钙质量分数的影响,结果见图1。从图1看出,反应温度为50~70℃时,溶液中氨和氯化钙的质量分数保持不变,分别为9.00%和29.79%,通过计算反应已经完全;当反应温度为80℃时,溶液中氨和氯化钙的质量分数分别出现了下降和上升,证明混合溶液的沸点在80℃左右;当反应温度为90℃时,溶液中氨的质量分数减少至4.88%、氯化钙的质量分数增加至31.02%。这主要是由于,气液两相物系在同一气相溶质分压下,气体在溶液中的溶解度随温度的升高而减小[10],所以温度升高氨气逸出。因为反应结束后要进行减压蒸发浓缩除氨,所以综合考虑能耗、除氨效果选择反应温度为80℃。
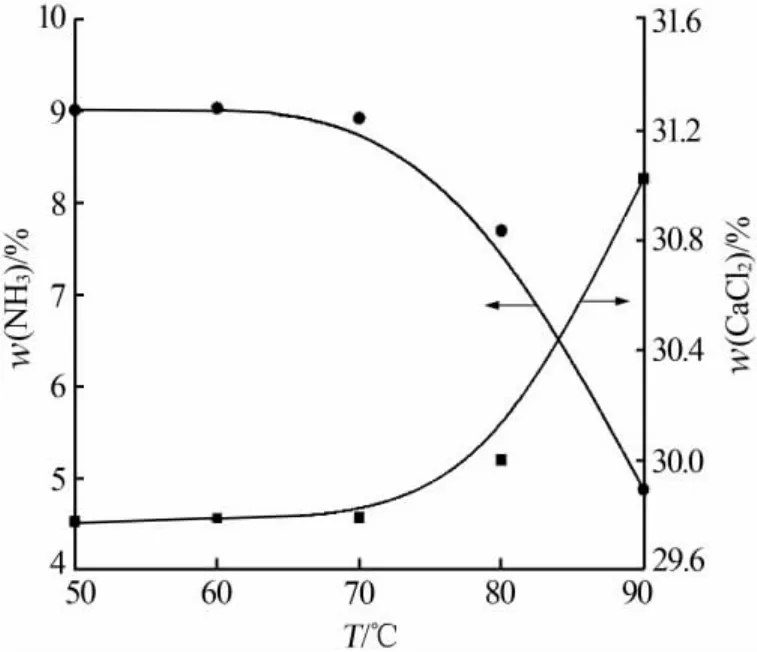
图1 反应温度对溶液中氨和氯化钙质量分数的影响
2.2 氧化钙与氯化铵物质的量比的影响
氧化钙和质量分数为35%的氯化铵溶液以不同 n(CaO)∶n(NH4Cl)加料,在 80 ℃反应 40 min,反应结束后将溶液在120℃、常压下蒸发,考察n(CaO)∶n(NH4Cl)对蒸发过程中氨和氯化钙质量分数的影响。
图2 为 n(CaO)∶n(NH4Cl)对蒸发过程体系 pH的影响。由图2 看出,随着 n(CaO)∶n(NH4Cl)增加体系pH变大,但变化幅度逐渐减小。当n(CaO)∶n(NH4Cl)为 1.3∶2 时,体系 pH 保持在 10.4 左右。
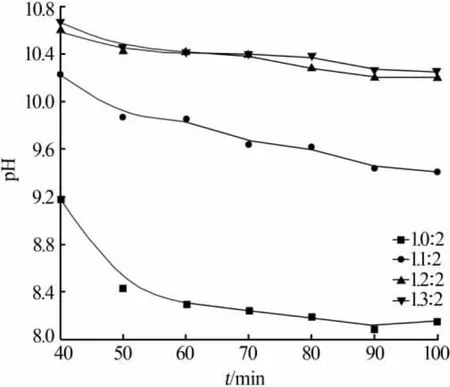
图2 n(CaO)∶n(NH4Cl)对溶液 pH 的影响
图3 为 n(CaO)∶n(NH4Cl)对蒸发过程体系氨(a)和氯化钙(b)质量分数的影响。由图3看出,随着n(CaO)∶n(NH4Cl)增加,溶液中氨的质量分数减小、氯化钙质量分数增大。 当 n(CaO)∶n(NH4Cl)由 1.0∶2增加至1.3∶2时,蒸发100 min时溶液中氨的质量分数由3.48%减小到0.80%、氯化钙质量分数由33.80%增加到38.65%。
这主要是由于,随着 n(CaO)∶n(NH4Cl)增大,氧化钙用量增加,溶液中氢氧化钙浓度增加,导致体系pH上升。但是氢氧化钙在体系中的溶解度是一定值,当氧化钙用量增加至 n(CaO)∶n(NH4Cl)为 1.3∶2时,生成的氢氧化钙不能全部溶解,因此体系pH上升趋势减缓。根据氨水解离常数定义:Kb=c(NH4+)·c(OH-)/c(NH4OH)[11],溶液 pH 增加,OH-浓度变大,氨水解离度变小,氨在溶液中的溶解度不变,所以蒸发过程中氨的质量分数随着溶液pH增加而减小,氯化钙质量分数随pH增加而升高。综上所述,为提高氯化钙质量分数,并达到较好的除氨效果,确定 n(CaO)∶n(NH4Cl)=1.3∶2。
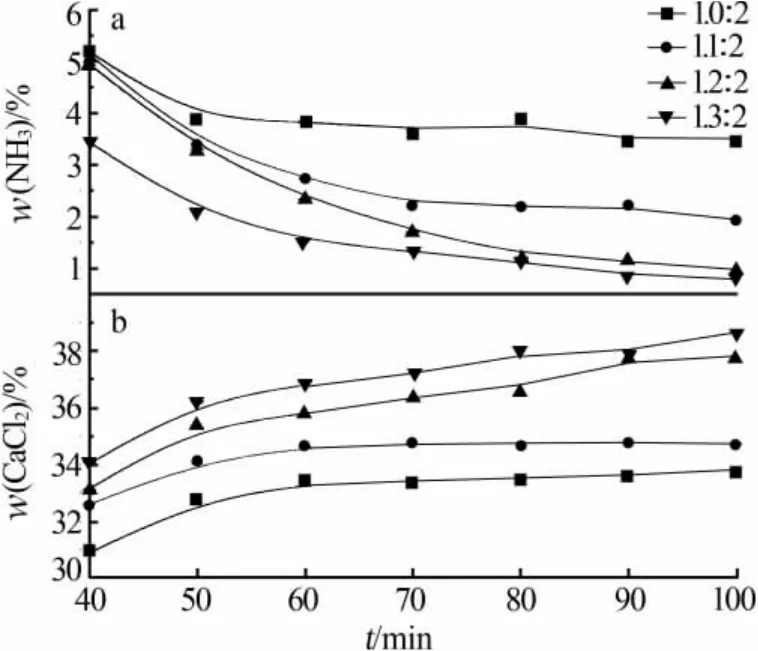
图3 n(CaO)∶n(NH4Cl)对蒸发过程体系氨(a)和氯化钙(b)质量分数的影响
2.3 氯化铵溶液质量分数的影响
氧化钙和不同质量分数的氯化铵溶液以n(CaO)∶n(NH4Cl)=1.3∶2 加料,在 80 ℃反应 40 min,然后在100℃、真空度为80 kPa条件下浓缩,分别在20 min和60 min取样分析,探索氯化铵质量分数对溶液蒸发浓缩的影响,结果见图4。
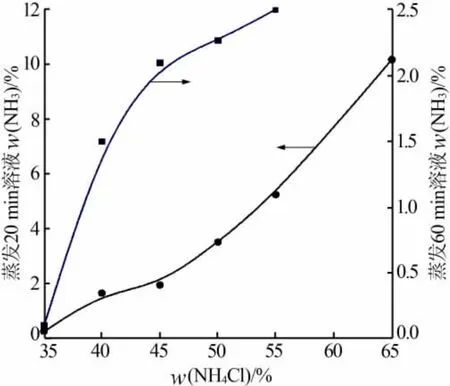
图4 氯化铵溶液质量分数对蒸发20、60 min溶液中氨质量分数的影响
由于溶液中含有不溶性的氢氧化钙和一些杂质,所以在100℃、真空度为80 kPa条件下蒸发20min后要对溶液进行抽滤,过滤掉杂质(氯化钙质量分数在45%左右)。由图4看出,当氯化铵溶液质量分数为35%时,蒸发20 min后溶液中氨的质量分数为0.25%;当氯化铵溶液质量分数为65%时,蒸发20 min后溶液中氨的质量分数为10.16%。当氯化铵溶液质量分数为35%时,蒸发60 min后溶液中氨的质量分数为0.10%;当氯化铵溶液质量分数为55%时,蒸发60 min后溶液中氨的质量分数为2.50%,这主要是由于水分蒸发的携带作用[12]减弱造成的。当氯化铵溶液质量分数增大时,体系中水分减少,蒸发出去的水分减少,因此携带出的氨气量减少。在抽滤时,如果溶液中氨的质量分数超过3%会有刺激性气味,而且大量氨溢出回收困难;蒸发结束后,高浓度的氯化钙溶液喷浆造粒生产二水氯化钙,要求溶液中氨的质量分数低于0.2%。所以最佳的氯化铵溶液质量分数为35%。
2.4 蒸发温度和真空度的影响
将最佳条件下反应完全的氯化钙溶液在不同温度和不同真空度下蒸发浓缩1 h,考察蒸发温度和真空度对蒸发效果的影响,结果见图5。从图5看出,在真空度相同条件下,蒸发温度由60℃上升至100℃,溶液中氨的质量分数下降、氯化钙质量分数上升。当蒸发温度为60℃时,真空度在60 kPa以下条件下溶液中氨和氯化钙的质量分数保持不变,真空度为80 kPa条件下溶液中氨的质量分数下降至2.78%、氯化钙质量分数上升为35.54%。当蒸发温度为80℃时,真空度大于20 kPa条件下溶液中氨的质量分数下降,真空度大于40 kPa条件下溶液中氯化钙质量分数上升,真空度在80 kPa条件下蒸发1 h溶液中氨的质量分数降到0.31%、氯化钙质量分数上升到45%。当蒸发温度为100℃时,溶液中氨和氯化钙的质量分数随真空度的上升分别呈现持续下降和持续上升趋势,真空度在80 kPa条件下蒸发1 h溶液中氨的质量分数可降到0.09%、氯化钙质量分数上升至57%,浓缩除氨效果较好。在蒸发温度为100℃、真空度为100 kPa条件下蒸发,溶液中的水分迅速被蒸发,携带作用不强,氯化钙质量分数为57%、氨的质量分数为0.95%,表明除氨效果不好。综上所述,为达到较好的除氨效果,选择蒸发温度为100℃、真空度为80 kPa。
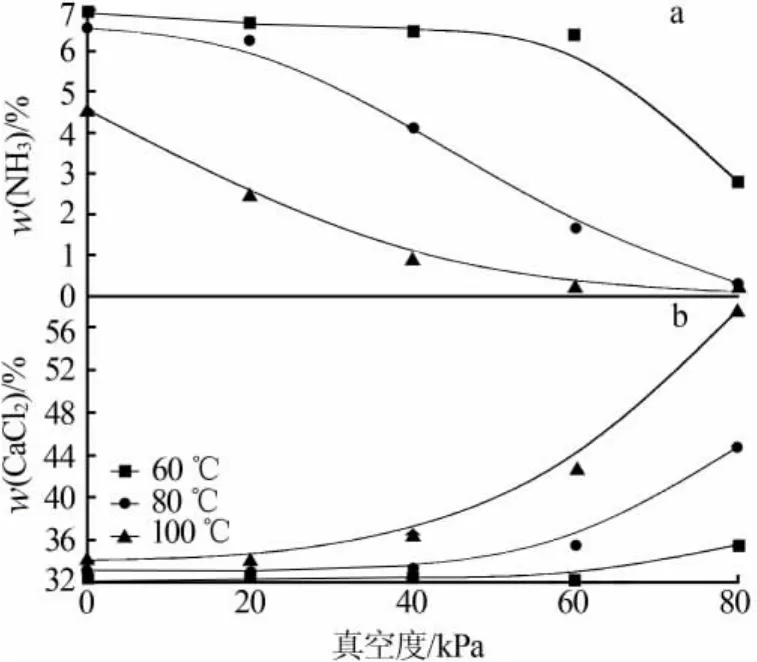
图5 蒸发温度、真空度对溶液中氨(a)和氯化钙(b)质量分数的影响
2.5 蒸发时间的影响
将最佳条件下反应完全的氯化钙溶液在3个温度和压力条件下蒸发浓缩不同的时间,探索最佳的蒸发时间。 图6为80℃80kPa、100℃60kPa、100℃80 kPa条件下蒸发不同时间溶液中氨和氯化钙的质量分数。由图6看出,在蒸发时间相同的条件下,100℃80 kPa条件下的浓缩效果最好,其次是80℃80 kPa,效果最差的是100℃60 kPa。由此可以得出,真空度对蒸发浓缩过程的影响比温度更强。在100℃60 kPa条件下,随着蒸发时间的增加,溶液中氨的质量分数呈平缓下降趋势,蒸发90 min时氨的质量分数为0.25%,氯化钙质量分数在蒸发90 min时有明显上升,达到43%;在80℃80 kPa条件下,随着蒸发时间的增加,溶液中氨的质量分数平缓下降、氯化钙质量分数平缓上升,蒸发90 min时氨的质量分数为0.20%、氯化钙质量分数为48%;在100℃80 kPa条件下蒸发浓缩,随着蒸发时间的增加,氨的质量分数呈下降趋势、氯化钙的质量分数呈上升趋势,蒸发90 min时氨的质量分数下降至0.03%、氯化钙的质量分数上升至62%。参照GB/T 26520—2011《工业氯化钙》,100℃80 kPa条件下蒸发浓缩得到的溶液更符合生产工业二水氯化钙的要求。综上所述,选择蒸发温度为100℃、真空度为80 kPa、蒸发时间为90 min。
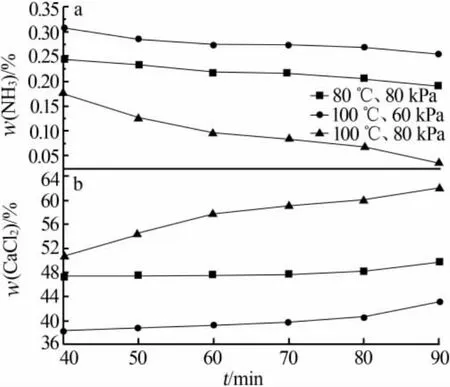
图6 蒸发时间对溶液中氨(a)和氯化钙(b)质量分数的影响
3 结论
氧化钙与氯化铵溶液反应制取氯化钙工艺设备简单,无资源浪费。整个反应在80℃反应40 min可使反应完全,氧化钙和质量分数为35%的氯化铵溶液以 n(CaO)∶n(NH4Cl)=1.3∶2 加料,更有利于蒸发浓缩除氨。在100℃、真空度为80 kPa条件下蒸发浓缩90 min,可得到氨质量分数为0.03%、氯化钙质量分数为62%的氯化钙浓溶液。此工艺可以解决氯化铵废液综合利用存在的问题,氯化钙浓溶液用于生产工业二水氯化钙,反应和蒸发浓缩过程中放出的氨和水都将回收再利用,符合可持续发展的理念。
[1]唐盛伟,周飞,梁斌,等.一种利用氯化铵和电石渣生产氨气和氯化钙的工艺:中国,102976355A[P].2013-03-20.
[2]李汉川,张涛,唐盛伟.电石渣与氯化铵反应特性研究[J].化学反应工程与工艺,2014,30(5):452-457.
[3]刘润静,张振昌,胡永琪,等.高浓度氯化铵分解生成氨联产固体氯化钙的研究[J].纯碱工业,2014(5):11-14.
[4]周振喜.一种从低浓度氯化铵废水中回收氨的方法:中国,105417823A[P].2016-03-23.
[5]莫如财,莫旭东,李振宁.一种氯化铵废液分解回收制氨水和氯化钙溶液的方法:中国,104876383A[P].2015-09-02.
[6]尹小春,于英明,徐志国,等.利用石灰粉分解氯化铵制备高浓度氯化钙溶液的方法:中国,102786073A[P].2012-11-21.
[7]曾蓉,乔秀文,郭丽丽,等.电石渣氯化铵循环法制备高纯氯化钙的工艺[J].石河子大学学报:自然科学版,2014,32(6):665-670.
[8]陈洁红,邱颂方,梁嘉敏.凯氏定氮仪在复混肥料总氮含量测定中的运用[J].广东化工,2008,35(5):103-105.
[9]化学工业部化肥司.磷铵生产分析[M].成都:成都科技大学出版社,1991.
[10]叶世超.化工原理(下册)[M].2 版.北京:科学出版社,2006.
[11]四川大学工科基础化学教学中心.近代化学基础(上册)[M].北京:高等教育出版社,2002.
[12]高鹏程,张一平.氨挥发与土壤水分散失关系的研究[J].西北农林科技大学学报:自然科学版,2001,29(6):22-26.

